
- •Энергоснабжение
- •Факультет энергетики, машиностроения и транспорта:
- •1. Информация о дисциплине
- •1.1. Предисловие
- •1.2. Содержание дисциплины и виды учебной работы
- •1.2.1. Содержание дисциплины по гос
- •1.2.2. Объем дисциплины и виды учебной работы представлены в таблице.
- •1.2.3. Перечень видов практических занятий и контроля:
- •2. Рабочие учебные материалы
- •2.1. Рабочая программа
- •Раздел 1. Теоретические основы теплоэнергетики (18 часов)
- •1.1. Основы технической термодинамики
- •1.2. Первый и второй законы термодинамики
- •Раздел 2. Циклы энергетических установок (24 часа)
- •2.1. Паротурбинные (пту) и парогазовые установки
- •2.2. Теплоцентрали (тэц). Ядерные энергетические установи
- •Раздел 3. Источники энергоснабжения (26 часов)
- •3.1. Котельные установки
- •3.2. Электрические станции и системы
- •Раздел 4. Системы энергоснабжения (28 часов)
- •4.1. Электроснабжение
- •4.2. Теплоснабжение, топливо и водоснабжение, хладоснабжение
- •2.2. Тематический план дисциплины
- •2.2.1. Тематический план дисциплины для студентов очной формы обучения
- •2.2.2. Тематический план дисциплины для студентов очно-заочной формы обучения
- •2.2.3. Тематический план дисциплины для студентов заочной формы обучения
- •2.3. Структурно-логическая схема дисциплины «Энергоснабжение»
- •Раздел 4. Системы энергоснабжения
- •2.4. Временной график изучения дисциплины
- •2.5. Практический блок
- •2.5.1. Практические занятия
- •2.5.1.1. Практические занятия (очная форма обучения)
- •2.5.1.2. Практические занятия (очно-заочная форма обучения)
- •2.5.1.3. Практические занятия (заочная форма обучения)
- •2.5.2. Лабораторные работы
- •2.5.2.2. Лабораторные работы (очная форма обучения)
- •2.5.2.2. Лабораторные работы (очно-заочная форма обучения)
- •2.5.2.3. Лабораторные работы (заочная форма обучения)
- •2.6. Балльно-рейтинговая система оценки знаний
- •3. Информационные ресурсы дисциплины
- •3.1. Библиографический список
- •3.2. Опорный конспект
- •Введение
- •Раздел 1. Теоретические основы теплоэнергетики
- •1.1. Основы технической термодинамики
- •1.1.1. Термодинамическая система, параметры состояния
- •1.1.2. Теплоемкость, энтальпия и энтропия
- •1.2. Первый и второй законы термодинамики
- •Работа и теплота
- •1.2.1. Первый закон термодинамики для потока рабочего тела
- •1.2.2. Второй закон термодинамики
- •1.2.3. Диаграммы водяного пара
- •Вопросы для самопроверки
- •Раздел 2. Циклы энергетических установок
- •2.1. Паротурбинные и парогазовые установок
- •2.2. Теплоэлектроцентрали (тэц). Ядерные энергетические установки
- •2.2.1. Циклы ядерных энергетических установок
- •Вопросы для самопроверки
- •Раздел 3. Источники энергоснабжения
- •3.1. Котельные установки
- •3.1.1. Тепловые схемы источников теплоснабжения
- •3.2. Электрические станции и системы
- •3.2.1. Технико-экономические показатели кэс
- •3.2.2. Теплоэлектроцентрали (тэц)
- •3.2.3. Показатели тепловой экономичности тэц
- •3.2.4. Атомные электростанции (аэс)
- •3.2.5. Гидро- и гидроаккумулирующие станции
- •Вопросы для самопроверки
- •Раздел 4. Системы энергоснабжения
- •4.1. Электроснабжение.
- •4.1. Электроснабжение
- •4.1.1. Общие сведения об электроснабжении
- •4.1.2. Энергетические системы (эс)
- •4.1.3. Электрические сети
- •4.1.4. Приёмники электрической энергии (эп)
- •4.1.5. Графики нагрузок
- •4.1.6. Системы электроснабжения
- •4.1.7. Качество электрической энергии
- •4.2. Теплоснабжение
- •4.2.1. Системы теплоснабжения
- •4.2.2. Закрытая водяная система теплоснабжения
- •4.2.3. Открытая водяная система теплоснабжения
- •4.2.4. Тепловые пункты
- •4.2.5. Паровые системы теплоснабжения
- •4.2.6. Классификация тепловых нагрузок
- •Вопросы для самопроверки
- •Заключение
- •3.3. Глоссарий (словарь терминов)
- •3.4. Методические указания к проведению практических занятий
- •Практическое занятие №1. Расчет цикла Карно
- •Практическое занятие №2.Расчет цикла Ренкина пту и цикла пгу
- •Практическое занятие №3. Расчет показателей экономичности кэс и тэц
- •Практическое занятие №4. Тепловая нагрузка промпредприятий
- •3.5. Методические указания к проведению лабораторных работ
- •Лабораторная работа 1. Расчет теплового баланса и расхода топлива парового котла
- •1. Цель работы
- •2. Основные теоретические положения
- •3. Описание лабораторной установки
- •4. Порядок выполнения работы
- •Форма 1
- •Форма 2
- •П.2. Расчетные присосы холодного воздуха
- •П.3. Энтальпия насыщенного и перегретого пара (кДж/кг)
- •П.4. Энтальпия воды (кДж/кг)
- •5. Содержание отчета
- •Лабораторная работа 2. Изучение оборудования теплового пункта (мтп)
- •1. Цель работы
- •2. Основные теоретические положения
- •3. Порядок выполнения работы
- •4. Обработка результатов опыта
- •5. Содержание отчета
- •4. Блок контроля освоения дисциплины
- •4.1. Задание на курсовую работу
- •4.2. Методические указания к выполнению курсовой работы
- •4.2.1. Состав и объем курсовой работы
- •4.2.2. Расчетно-пояснительная записка
- •4.2.2.1. Задание на курсовую работу
- •4.2.2.2. Производственно-технологическое теплопотребление
- •4.2.2.3. Коммунально-бытовое теплопотребление
- •Расчетные тепловые нагрузки
- •Средние тепловые нагрузки
- •Годовые расходы теплоты
- •4.2.2.4. Отпуск теплоты по сетевой воде
- •4.2.2.5. Выбор основного оборудования
- •4.2.2.6. Показатели тепловой экономичности тэц
- •4.2.2.7. Принципиальная схема системы теплоснабжения
- •Графическая часть
- •П. 3 Укрупненные показатели среднего теплового потока на горячее водоснабжение жилых и общественных зданий при температуре воды 550с qr, Вт/чел.
- •Диаграмма I-s для водного пара
- •4.3. Тренировочные тесты
- •Правильные ответы на тренировочные тесты
- •4.4. Вопросы и задачи для подготовки к экзамену
- •Шелудько Ольга Владимировна энергоснабжение Учебно-методический комплекс
- •191186, Санкт-Петербург, ул. Миллионная, 5
- •Энергоснабжение
1.2. Первый и второй законы термодинамики
Первый закон термодинамики устанавливает взаимосвязь между теплотой Q, работой 1 и изменением энергии Е термодинамической системы.
Работа и теплота
При любом термодинамическом процессе обмен энергией системы Е с окружающей средой происходит в форме теплоты или механической работы. В первом случае обмен осуществляется при контакте тел с различной температурой. Энергия передается на молекулярном уровне от более нагретого тела к холодному. Количество подведенной или отведенной теплоты обозначают буквой Q, Дж.
Если теплоту относят к 1 кг массы, то ее количество обозначают через q, Дж/кг и называют удельной теплотой.
Второй способ передачи энергии происходит при изменении объема тела V. Количество переданной энергии соответствует работе расширения, совершенной над телом или затраченной им. Величину работы расширения обозначают буквой L, Дж, а отнесенное к единице массы ее количество l, Дж/кг - удельной работой.
Работа расширения газа в процессе определяется по формуле
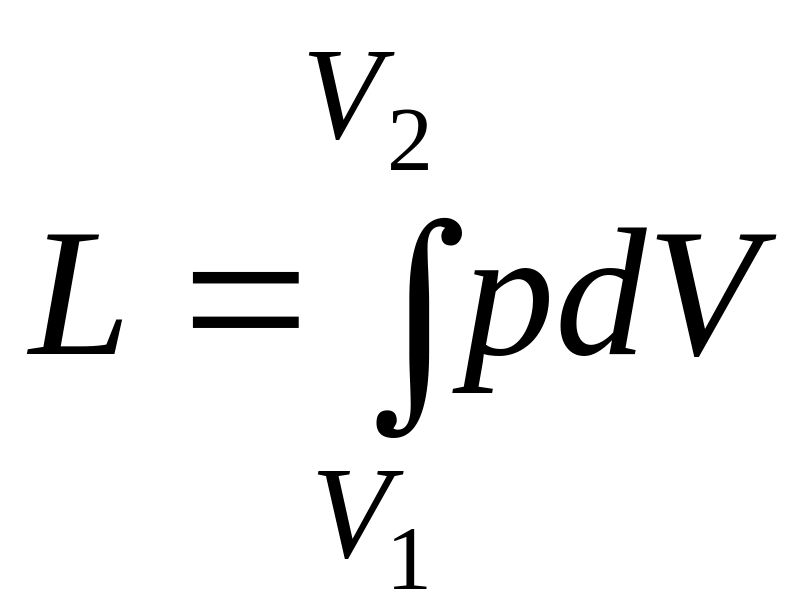 или
или
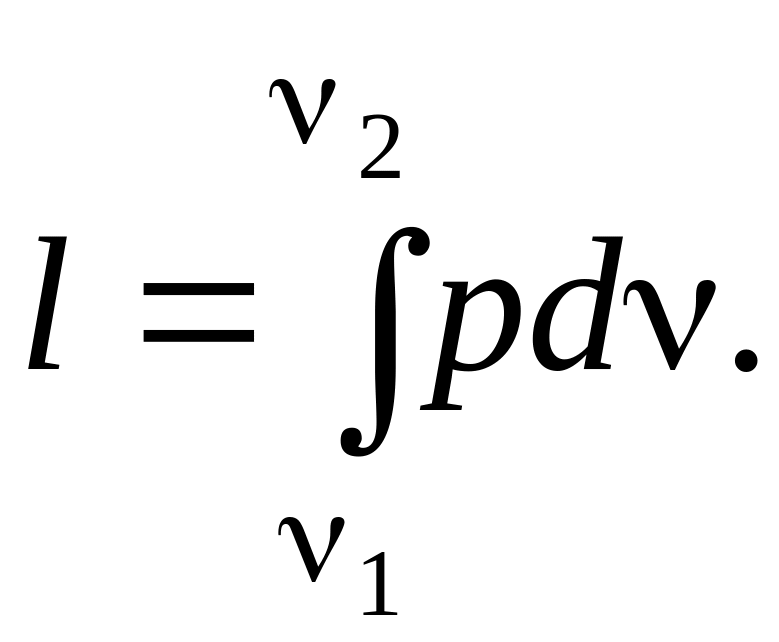 (1.6)
(1.6)
Если dV > 0, то L > 0 , т. е. при расширении работа тела положительна, при этом тело само совершает работу над окружающей средой; если dV < 0, то L < 0, т. е. при сжатии работа отрицательна, это значит , что не система совершает работу, а на ее сжатие затрачивается работа извне.
Любая термодинамическая система обладает запасом энергии, которую называют внутренней энергией системы U. Под внутренней энергией U понимают кинетическую энергию хаотического движения молекул и атомов, а также потенциальную энергию сил взаимодействия между молекулами.
Для задач технической термодинамики важно не абсолютное значение внутренней энергии, а ее изменение в различных термодинамических системах. В свою очередь, изменение внутренней энергии определяется только начальным и конечным состояниями системы:
ΔU = U2 – U1, Дж. или Δu = u2 – u1, Дж/кг. (1.7)
При одновременном тепловом и механическом взаимодействиях системы со средой изменение внутренней энергии будет зависеть как от количества подведенной (отведенной) теплоты, так и от произведенной системой работы, т. е.
q = l + Δu. (1.8)
Уравнение (1.8) называют уравнением первого закона термодинамики. Теплота, сообщаемая системе, идет на приращение ее внутренней энергии и на совершение внешней работы.
В дифференциальной форме уравнение первого закона термодинамики имеет вид
dq = du + dl = du + рdν. (1.9)
Выражение (1.9) можно записать в другой форме, если ввести функцию h = u + pν, называемую энтальпией системы, Дж/кг. Энтальпия, составленная из параметров состояния, также является параметром состояния, имеет полный дифференциал dh:
dh = du + pdν + νdp или du +pdν = dh – νdp (1.10)
Подставляя (1.10) в соотношение (1.9), получаем выражение первого закона через энтальпию h:
dq = dh – νdp. (1.11)
Для основных термодинамических процессов из соотношения (1.9) можно получить частные случаи первого закона.
При q = 0 (адиабатный процесс)
dl = -du или - dl = du; (1.12)
dv = 0 (изохорный процесс)
dq = du (1.13)
dp = 0 (изобарный процесс)
dq = du + dl; (1.14)
dT = 0 (изотермический процесс)
dq = dl. (1.15)
