
- •Глава I. Электрические заряды
- •§ 2. Проводники и диэлектрики. Мы видели в предыдущих опытах, что, прикасаясь заряженным телом к незаряженным предметам, мы сообщаем им электрический заряд. Мы
- •§ 5. Что происходит при электризации? До сих пор мы не
- •Глава II. Электрическое поле
- •§ 12. Действие электрического заряда на окружающие тела.
- •§ 14. Напряженность электрического поля. Рисунки § 13 дают лишь общую качественную картину электрического поля. Для количественной характеристики электрического
- •§ 15. Сложение полей. Если электрическое поле создано одним точечным зарядом q, то напряженность этого поля в какой-либо точке, отстоящей на расстоянии г от заряда, равна, согласно закону Кулона,
- •§ 16. Электрическое поле в диэлектриках и в проводниках.
- •§ 18. Основные особенности электрических карт. При построении электрических карт нужно иметь в виду следующее.
- •§ 20. Работа при перемещении заряда в электрическом поле.
- •§ 21. Разность потенциалов (электрическое напряжение).
- •§ 22. Эквипотенциальные поверхности. Подобно тому как мы графически изображаем линиями напряженность электрического поля, можно изобразить и разность потенциалов (напряжение).
- •§ 23. В чем смысл введения разности потенциалов? в § 21
- •§ 26. В чем различие между электрометром и электроскопом?
- •§ 31. Распределение зарядов в проводнике. Клетка Фарадея.
- •§ 33. Конденсаторы. Возьмем две изолированные металлические пластины 1 и 2 (рис. 58), расположенные на некото
- •Конденсатор емкости 0,001 мкФ заряжен до разности потен-
- •§ 38. Энергия заряженных тел. Энергия электрического поля.
- •§ 47. Сопротивление проводов. В предыдущем параграфе было указано, что электрическое сопротивление для разных проводников различно и может зависеть как от материала,
- •§ 48. Зависимость сопротивления от температуры. Опыт в соответствии с общими соображениями § 46 показывает, что сопротивление проводника зависит также и от его температуры.
- •§ 53. Вольтметр. При помощи гальванометра можно , измерить не только силу тока, но и напряжение, ибо", согласно
- •§ 61. Понятие о расчете нагревательных приборов. Для нормальной работы любого электронагревательного прибора его обмотка должна быть правильно рассчитана.
- •§ 64. Электрическая проводка. На рис. 102 показано устройство комнатной электрической проводки. Ток со станции
- •Глава V. Прохождение электрического тока через электролиты
- •§ 68. Движение ионов в электролитах. Движение ионов в электролитах в некоторых случаях может быть показано весьма наглядно.
- •§ 72. Градуировка амперметров при помощи электролиза.
- •§ 73. Технические применения электролиза. Явление электролиза находит себе многочисленные технические применения.
- •Какова мощность тока, при помощи которого можно полу.
- •Глава VI. Химические и тепловые генераторы тока
- •§ 76. Как возникают э. Д. С. И ток в гальваническом элементе? Легко заметить, что один из электродов гальванического
- •§ 82. Соединение источников тока. Очень часто источники тока соединяют между собой для совместного питания цепи.
- •§ 85. Измерение температуры с помощью термоэлементов.
- •Глава VII. Прохождение электрического тока через металлы
- •Глава Vlil. Прохождение электрического тока через газы
- •§ 94. Молния. Красивое и небезопасное явление природы — молния — представляет собой искровой разряд в атмосфере.
- •§ 95. Коронный разряд. Возникновение ионной лавины не всегда приводит к искре, а может вызвать и разряд другого типа — коронный разряд.
- •§ 103. Природа катодных лучей. Ответ на вопрос о природе катодных лучей дают опыты по исследованию их свойств. Важнейшие результаты этих опытов следующие.
- •Катодные лучи вылетают в направлении, перпендикулярном к поверхности катода, и распространяются
- •§ 106. Электронные лампы. Явление термоэлектронной эмиссии и обусловленный им электронный ток через вакуум лежат в основе устройства очень большого числа
- •§ 108. Природа электрического тока в полупроводниках.
- •Глава X. Основные магнитные явления
- •§ 112. Естественные и искусственные магниты. Прежде чем углублять наши знания о магнитных явлениях, напомним некоторые известные факты.
- •§ 114. Магнитное действие электрического тока. Простейшие электрические и магнитные явления известны людям с очень давних времен.
- •§ 115. Магнитные действия токов и постоянных магнитов.
- •Глава XI. Магнитное поле
- •§ 119. Магнитный момент. Единица магнитной индукции.
- •§ 126. Магнитное поле внутри соленоида. Напряженность магнитного поля. Особый интерес представляет магнитное поле внутри соленоида, длина которого значительно превосходит его диаметр.
- •Глава XIII. Магнитное поле земли
- •§ 129. Элементы земного магнетизма. Так как магнитные и географические полюсы Земли не совпадают, то магнитная стрелка указывает направление север — юг только прибли-
- •Глава XIV. Силы, действующие в магнитном поле на проводники с током
- •§ 138. Условия возникновения индукционного тока. Напомним некоторые простейшие опыты, в которых наблюдается возникновение электрического тока в результате электромагнитной индукции.
- •Глава XVI. Магнитные свойства тел
- •§ 144. Магнитная проницаемость железа. До сих пор мы
- •Глава XVII. Переменный ток
- •§ 151. Постоянная и переменная электродвижущая сила.
- •§ 154. Сила переменного тока. Мы видели, что мгновенное значение переменного тока все время изменяется, колеблясь между нулем и максимальным значением. Тем не
- •§ 159. Закон Ома для переменного тока. Емкостное и индуктивное сопротивления. В § 46 мы установили основной закон постоянного тока — закон Ома I—u/r.
- •§ 162. Сдвиг фаз между током и напряжением. Проделаем -следующий опыт. Возьмем описанный в § 153 осциллограф
- •§ 166. Выпрямление переменного тока. Хотя, как мы уже
- •Глава XVIII. Электрические машины: генераторы, двигатели, электромагниты
- •Необходимо всегда подбирать двигатель такой мощности, какую фактически требует приводимая им в действие машина.
- •§ 175. Обратимость электрических генераторов постоянного тока. В § 172
- •§ 177. Применение электромагнитов. Большинство технических применений магнитов основывается на их способности притягивать и удерживать железные предметы. И в
- •273 , 301, 310, 344 , 347 , 354 Ампер-секунда 31 Ампер-час 176
- •253 Полюс 164
- •58 , 60 , 62 , 94 , 98 Разряд дуговой 218, 219, 408
- •§ 139. Направление индукционного тока. Правило Ленца.
§ 68. Движение ионов в электролитах. Движение ионов в электролитах в некоторых случаях может быть показано весьма наглядно.
Пропитаем листок фильтровальной бумаги раствором электролита (сернокислого натра, Na2S04) и фенолфталеина
———_^ +_
а
Рис.
107. Опыт, показывающий движение ионов.
Листок фильтровальной бумаги
пропитан раствором электролита и
фенолфталеина, ab
—
нитка, смоченная раствором электролита
![]() и
поместим на стеклянную пластинку (рис.
107). Поперек бумаги положим обыкновенную
белую нитку, смоченную раствором едкого
натра (NaOH).
Бумага
под ниткой окрасится в малиновый цвет
благодаря взаимодействию ионов
гидроксила (ОН) из NaOH
с
фенолфталеином. Затем прижмем к краям
листка проволочные электроды,
присоединенные к гальваническому
элементу, и включим ток. Ионы гидроксила
из едкого натра начнут двигаться к
аноду, окрашивая бумагу В
малино-
Рис.
108. К упражнению 68.1 вый
цвет. По скорости перемещения
малинового края можно судить о средней
скорости движения ионов под влиянием
электрического поля внутри электролита.
Опыт показывает, что эта скорость
пропорциональна напряженности поля
внутри электролита. При заданном
поле эта скорость для разных ионов
несколько различна. Но в общем она
невелика и для обычно применяющихся
полей измеряется сотыми и даже тысячными
долями сантиметра в секунду.
и
поместим на стеклянную пластинку (рис.
107). Поперек бумаги положим обыкновенную
белую нитку, смоченную раствором едкого
натра (NaOH).
Бумага
под ниткой окрасится в малиновый цвет
благодаря взаимодействию ионов
гидроксила (ОН) из NaOH
с
фенолфталеином. Затем прижмем к краям
листка проволочные электроды,
присоединенные к гальваническому
элементу, и включим ток. Ионы гидроксила
из едкого натра начнут двигаться к
аноду, окрашивая бумагу В
малино-
Рис.
108. К упражнению 68.1 вый
цвет. По скорости перемещения
малинового края можно судить о средней
скорости движения ионов под влиянием
электрического поля внутри электролита.
Опыт показывает, что эта скорость
пропорциональна напряженности поля
внутри электролита. При заданном
поле эта скорость для разных ионов
несколько различна. Но в общем она
невелика и для обычно применяющихся
полей измеряется сотыми и даже тысячными
долями сантиметра в секунду.
Для определения знака полюсов источника употребляют
«полюсоискатели», представляющие собой небольшую стеклянную
ампулу с двумя введенными в нее проволоками (рис. 108). Ампула
ваполняется раствором поваренной соли с добавленным к нему фенолфталеином, краснеющим под действием щелочи. На каком из полюсов будет появляться красная окраска?
§ 69. Элементарный электрический заряд. Из формулы (66.2), объединяющей оба закона Фарадея, следует, что если заряд q численно равен постоянной Фарадея F, то масса т равна М/п, т. е. при прохождении через электролит заряда, равного 96 484 Кл, выделяется М/п [кг] любого вещества, т. е. 1 In моля этого вещества. Иначе говоря, для выделения одного моля вещества через электролит должен протечь заряд#, численно равный nF [Кл]. Таким образом, при выделении моля одновалентного вещества (1,008 г водорода, 22,99 г натрия, 107,87 г серебра и т. д.) через электролит проходит заряд, численно равный F=* =96 484 Кл; при выделении моля двухвалентного вещества (16,00 г кислорода, 65,38 г цинка, 63,55 г меди и т. д.) через электролит проходит заряд, численно равный 2 F=* =2 • 96 484 Кл = 192 968 Кл, и т. д.
Но мы знаем, что в одном моле любого вещества содержится одно и то же число атомов, равное постоянной Аво- гадро У\/л=6,02-1023 моль-1. Таким образом, каждый, ион одновалентного вещества, выделяющийся на электроде, несет на себе заряд
е=^ = б11т^==1’60-10'18Кл* (691>
При выделении каждого атома двухвалентного вещества через электролит проходит заряд 2/7/Агл=3,20 *10—1в Кл, вдвое больший, и т. д. Вообще при выделении каждого атома я-валентного вещества через электролит переносится заряд nF/N А—пе [Кл].
Мы видим, что заряды, переносимые при электролизе с каждым ионом, представляют собой целые кратные некоторого минимального количества электричества, равного 1,60 * 10~19 Кл. Любой одновалентный ион (ион калия, серебра и т. д.) переносит один такой заряд. Любой двухвалентный ион (ион цинка, ртути и т. д.) переносит два таких заряда. Никогда не встречаются при электролизе случаи, когда бы с ионом переносился заряд, содержащий дробную часть от 1,60 - 10~хв Кл. Немецкий физик и физиолог Герман Гельмгольц (1821—1894), Обративший внимание на это следствие из закона Фарадея, сделал отсюда заключение, что указанное количество электричества 1,60-10—19 Кл представляет собой наименьшее количество электричества, существующее в природе; этот минимальный заряд получил название элементарного заряда. Одновалентные анионы (ионы хлора, йода и т. д.) несут на себе один отрицательный элементарный заряд, одновалентные катионы (ионы водорода, натрия, калия, серебра и т. д.) — один положительный элементарный заряд, двухвалентные анионы — два отрицательных элементарных заряда, двухвалентные катионы — два положительных элементарных заряда и т. д.
Таким образом, в явлениях электролиза исследователи впервые столкнулись с проявлениями дискретной (прерывистой) природы электричества (§ 5) и сумели определить элементарный электрический заряд. Позже были обнаружены и другие явления, в которых проявляется дискретная природа электричества, и были найдены другие способы измерения элементарного отрицательного заряда*— заряда электрона. Все эти измерения дали для заряда электрона то же значение, какое мы получили только что из закона Фарадея. Это является лучшим подтверждением правильности того ионного механизма прохождения тока через электролиты, который мы обрисовали в предыдущем параграфе.
Ионы принято обозначать знаками «+» или «—» около соответствующих формул (обычно справа вверху). Число знаков «+» или «—» равно валентности иона (например, ионы меди бывают Си+ или Си2+, ионы хлора — только С1~,- и т. д.).
§70. Первичные и вторичные процессы при электролизе. Из изложенного выше представления об ионной проводимости электролитов вытекает, что первичным результатом электролиза является выделение на электродах составных частей молекулы растворенного вещества. Однако фактически мы часто обнаруживаем на одном или на обоих электродах не те атомы или атомные группы, которые перемещались в растворе и первоначально выделялись на электродах, а другие, освобождающиеся при вторичных химических реакциях, в которые вступают освободившиеся первичные атомы и группы. Например, при электролизе раствора медного купороса (Си504)на катоде выделяется, как мы говорили, медь, на аноде же мы обнаруживаем выделение не группы 504, а кислорода. Одновременно наблюдается образование в растворе серной кислоты (Н2504). Это объясняется тем, что группа S04 неустойчива; выделившись из раствора, она сейчас же вступает в реакцию с водой по уравнению
2НаО+2S04 = 2H2S04 -fА.
Кислород выделяется в виде пузырьков газа, а серная кислота остается в растворе.
Аналогичные вторичные реакции имеют место и при электролизе других солей и кислот.. Мы видели, например, что при электролизе слабого раствора серной кислоты на электродах выделяются водород и кислород, Но этот окончательный результат является, как и в разобран
ном выше примере, следствием осложняющих электролиз вторичных химических реакций, налагающихся на простой первичный процесс. Сначала на катоде выделяется в виде пузырьков газа водород, а на аноде — группа 504. Эта группа сейчас же вступает с водой в реакцию по написанному выше уравнению, и в результате молекула серной кислоты снова восстанавливается, а на аноде выделяется кислород, входящий в состав воды. Внешне процесс протекает так, что количество серной кислоты в растворе остается неизменным, а количество воды убывает. Поэтому в этом случае, как и при электролизе многих других кислот и оснований, часто говорят о разложении воды электрическим током или об электролизе воды. Это название не совсем точно. Оно правильно передает окончательный результат, но затемняет различие между тем первичным процессом, который непосредственно связан с прохождением тока через электролит, и вторичными химическими реакциями между продуктами этого первичного процесса.
![]() Различие
между первичными и вторичными процессами
при электролизе можно показать на
следующем опыте. Будем производить
электро- " лиз раствора поваренной
соли (NaCl),
Различие
между первичными и вторичными процессами
при электролизе можно показать на
следующем опыте. Будем производить
электро- " лиз раствора поваренной
соли (NaCl),
Раствор
Рис.
109. Электролиз раствора поваренной
соли. На аноде выделяется хлор, на
катоде — натрий![]()

Чтобы убедиться в том, что первичным процессом является именно выделение на электродах натрия и хлора, повторим этот опыт, взяв в качестве анода угольный стерженек, а в качестве катода — слой жидкой ртути, налитой на дно сосуда (рис. 109). Освобождающийся на аноде хлор не реагирует с углем и выделяется в виде пузырьков газа. На катоде же выделяется натрий. Правда, непосредственно мы этого натрия заметить не можем, потому что выделившиеся на поверхности ртути атомы его сейчас же просачиваются (диффундируют) в толщу жидкой ртутн. Однако обнаружить их нетрудно. Достаточно после прохождения тока в течение некоторого времени перегонять ртуть или, еще проще, облить ее горячей водой. Натрий вступает при этом с водой в химическую реакции по уравнению
2Na+2H20 = 2Na0H+Ha.
Пузырьки водорода выделяются на поверхности ртути, а едкий натр (NaOH) растворяется в воде, сообщая ей щелочные свойства: красная лакмусовая бумажка, погруженная в эту воду, окрашивается в синий цвет. Таким образом, выбрав надлежащим образом электроды, мы наблюдаем выделение на них первичных продуктов электролиза: натрия и хлора.
Важно отметить, однако, что независимо от того, выделяются ли на электродах первичные продукты электролиза или продукты вторичных реакций, законы Фарадея всегда сохраняют силу, Например, для вы
деления одного моля водорода требуется прохождение через электролит заряда 96 484 Кл независимо от того, является ли этот водород первичным продуктом, как при электролизе серной кислоты (Н2504), или продуктом вторичной реакции, как при электролизе поваренной соли (NaCl). Это становится совершенно понятным, если мы вспомним, что каждый атом какого-нибудь вещества, выделяющийся на электродах, вступая в дальнейшие химические реакции, может заменить собой либо один атом или группу той же валентности, либо несколько атомов, общая сумма валентностей которых равна его валентности.
§ 71. Электролитическая диссоциация. Мы видим, что представление об ионной проводимости действительно хорошо и просто объясняет явление электролиза. Откуда же берутся ионы внутри электролита, если до растворения молекулы растворенного вещества были в целом не заряжены? Возникают ли эти ионы под действием приложенного электрического поля или же они имеются внутри электролита с самого начала, еще до замыкания цепи?
Несложные опыты и рассуждения показывают, что разделение молекул на заряженные ионы не связано с наличием тока. Действительно, если бы молекулы разрывались внешним электрическим полем, то должна была бы существовать некоторая минимальная напряженность поля в электролите, необходимая для начала электролиза и зависящая от прочности молекул. Опыт же показывает, что это не так и что электролиз начинается при любом, сколь угодно малом поле. Это можно проверить, например, проводя электролиз медного купороса при медных электродах, когда нет искажающего влияния поляризации электродов (§ 77), какое бывает, например, при электролизе подкисленной воды. Подобного рода опыты показывают, что ионы возникают не под действием тока, а образуются в процессе растворения вещества. Образование ионов при растворении носит название электролитической диссоциации.
Растворение не всегда сопровождается диссоциацией на ионы, а поэтому и не все растворы проводят электрический ток. Следующий опыт наглядно показывает такое различие.
Соединим последовательно с электрической лампочкой сосуд, содержащий дистиллированную воду и два металлических электрода, и включим их в осветительную сеть. Лампочка светиться не будет, так как дистиллированная вода практически не является проводником: в ней растворено лишь ничтожное количество примесей, а сами молекулы воды почти недиссоциированы. Бросим теперь в воду щепотку сахара. Раствор по-прежнему будет оставаться непроводящим, значит, молекулы сахара при растворении
не диссоциируют. Но если вместо сахара растворить в воде щепотку поваренной соли или несколько капель соляной кислоты, то лампочка начинает светиться (рис. 110): водный раствор соли проводит электричество, а следовательно,
Рис.
110. Водный раствор кислоты или соли
проводит электрический
ток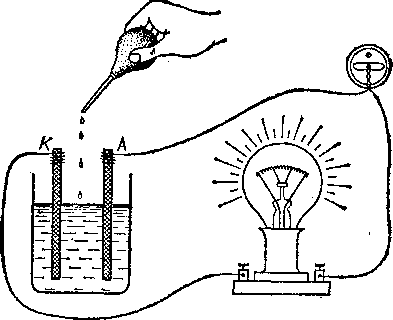
в нем происходит электролитическая диссоциация. Конечно, в этом опыте лампочка служит только индикатором тока и может быть заменена каким-нибудь измерительным прибором.
Представление об электролитической диссоциации, сопровождающей растворение, ввел шведский физик и химик Сванте Аррениус (1859—1927). Аррениус следующим образом объяснил различие между электролитами и неэлектролитами, равно, как и то обстоятельство, что именно водные растворы особенно хорошо проводят электричество. К числу электролитов относятся вещества, молекулы которых построены из положительно и отрицательно заряженных атомов, сдерживаемых силами электрического взаимодействия. Однако сила взаимодействия между двумя зарядами в среде с диэлектрической проницаемостью е, согласно формуле (36.4), уменьшается в е раз. Поэтому в растворителе с большой диэлектрической проницаемостью (у воды 8=81) силы, сдерживающие ионы в молекуле, значительно уменьшаются. Молекулы из таких слабо связанных ионов под действием непрерывных тепловых соударений «разбиваются» на заряженные части — ионы, т, е, испытывают электролитическую диссоциацию.
?71.1. Почему вокруг электролита, например вокруг раствора поваренной соли, нет электрического поля и он представляется нам
незаряженным, хотя внутри него имеются заряженные ионы?
Почему все разноименные ионы в электролите не собираются под действием взаимного притяжения в нейтральные молекулы? Что поддерживает все время ионизацию внутри электролита?
