
- •Глава I. Электрические заряды
- •§ 2. Проводники и диэлектрики. Мы видели в предыдущих опытах, что, прикасаясь заряженным телом к незаряженным предметам, мы сообщаем им электрический заряд. Мы
- •§ 5. Что происходит при электризации? До сих пор мы не
- •Глава II. Электрическое поле
- •§ 12. Действие электрического заряда на окружающие тела.
- •§ 14. Напряженность электрического поля. Рисунки § 13 дают лишь общую качественную картину электрического поля. Для количественной характеристики электрического
- •§ 15. Сложение полей. Если электрическое поле создано одним точечным зарядом q, то напряженность этого поля в какой-либо точке, отстоящей на расстоянии г от заряда, равна, согласно закону Кулона,
- •§ 16. Электрическое поле в диэлектриках и в проводниках.
- •§ 18. Основные особенности электрических карт. При построении электрических карт нужно иметь в виду следующее.
- •§ 20. Работа при перемещении заряда в электрическом поле.
- •§ 21. Разность потенциалов (электрическое напряжение).
- •§ 22. Эквипотенциальные поверхности. Подобно тому как мы графически изображаем линиями напряженность электрического поля, можно изобразить и разность потенциалов (напряжение).
- •§ 23. В чем смысл введения разности потенциалов? в § 21
- •§ 26. В чем различие между электрометром и электроскопом?
- •§ 31. Распределение зарядов в проводнике. Клетка Фарадея.
- •§ 33. Конденсаторы. Возьмем две изолированные металлические пластины 1 и 2 (рис. 58), расположенные на некото
- •Конденсатор емкости 0,001 мкФ заряжен до разности потен-
- •§ 38. Энергия заряженных тел. Энергия электрического поля.
- •§ 47. Сопротивление проводов. В предыдущем параграфе было указано, что электрическое сопротивление для разных проводников различно и может зависеть как от материала,
- •§ 48. Зависимость сопротивления от температуры. Опыт в соответствии с общими соображениями § 46 показывает, что сопротивление проводника зависит также и от его температуры.
- •§ 53. Вольтметр. При помощи гальванометра можно , измерить не только силу тока, но и напряжение, ибо", согласно
- •§ 61. Понятие о расчете нагревательных приборов. Для нормальной работы любого электронагревательного прибора его обмотка должна быть правильно рассчитана.
- •§ 64. Электрическая проводка. На рис. 102 показано устройство комнатной электрической проводки. Ток со станции
- •Глава V. Прохождение электрического тока через электролиты
- •§ 68. Движение ионов в электролитах. Движение ионов в электролитах в некоторых случаях может быть показано весьма наглядно.
- •§ 72. Градуировка амперметров при помощи электролиза.
- •§ 73. Технические применения электролиза. Явление электролиза находит себе многочисленные технические применения.
- •Какова мощность тока, при помощи которого можно полу.
- •Глава VI. Химические и тепловые генераторы тока
- •§ 76. Как возникают э. Д. С. И ток в гальваническом элементе? Легко заметить, что один из электродов гальванического
- •§ 82. Соединение источников тока. Очень часто источники тока соединяют между собой для совместного питания цепи.
- •§ 85. Измерение температуры с помощью термоэлементов.
- •Глава VII. Прохождение электрического тока через металлы
- •Глава Vlil. Прохождение электрического тока через газы
- •§ 94. Молния. Красивое и небезопасное явление природы — молния — представляет собой искровой разряд в атмосфере.
- •§ 95. Коронный разряд. Возникновение ионной лавины не всегда приводит к искре, а может вызвать и разряд другого типа — коронный разряд.
- •§ 103. Природа катодных лучей. Ответ на вопрос о природе катодных лучей дают опыты по исследованию их свойств. Важнейшие результаты этих опытов следующие.
- •Катодные лучи вылетают в направлении, перпендикулярном к поверхности катода, и распространяются
- •§ 106. Электронные лампы. Явление термоэлектронной эмиссии и обусловленный им электронный ток через вакуум лежат в основе устройства очень большого числа
- •§ 108. Природа электрического тока в полупроводниках.
- •Глава X. Основные магнитные явления
- •§ 112. Естественные и искусственные магниты. Прежде чем углублять наши знания о магнитных явлениях, напомним некоторые известные факты.
- •§ 114. Магнитное действие электрического тока. Простейшие электрические и магнитные явления известны людям с очень давних времен.
- •§ 115. Магнитные действия токов и постоянных магнитов.
- •Глава XI. Магнитное поле
- •§ 119. Магнитный момент. Единица магнитной индукции.
- •§ 126. Магнитное поле внутри соленоида. Напряженность магнитного поля. Особый интерес представляет магнитное поле внутри соленоида, длина которого значительно превосходит его диаметр.
- •Глава XIII. Магнитное поле земли
- •§ 129. Элементы земного магнетизма. Так как магнитные и географические полюсы Земли не совпадают, то магнитная стрелка указывает направление север — юг только прибли-
- •Глава XIV. Силы, действующие в магнитном поле на проводники с током
- •§ 138. Условия возникновения индукционного тока. Напомним некоторые простейшие опыты, в которых наблюдается возникновение электрического тока в результате электромагнитной индукции.
- •Глава XVI. Магнитные свойства тел
- •§ 144. Магнитная проницаемость железа. До сих пор мы
- •Глава XVII. Переменный ток
- •§ 151. Постоянная и переменная электродвижущая сила.
- •§ 154. Сила переменного тока. Мы видели, что мгновенное значение переменного тока все время изменяется, колеблясь между нулем и максимальным значением. Тем не
- •§ 159. Закон Ома для переменного тока. Емкостное и индуктивное сопротивления. В § 46 мы установили основной закон постоянного тока — закон Ома I—u/r.
- •§ 162. Сдвиг фаз между током и напряжением. Проделаем -следующий опыт. Возьмем описанный в § 153 осциллограф
- •§ 166. Выпрямление переменного тока. Хотя, как мы уже
- •Глава XVIII. Электрические машины: генераторы, двигатели, электромагниты
- •Необходимо всегда подбирать двигатель такой мощности, какую фактически требует приводимая им в действие машина.
- •§ 175. Обратимость электрических генераторов постоянного тока. В § 172
- •§ 177. Применение электромагнитов. Большинство технических применений магнитов основывается на их способности притягивать и удерживать железные предметы. И в
- •273 , 301, 310, 344 , 347 , 354 Ампер-секунда 31 Ампер-час 176
- •253 Полюс 164
- •58 , 60 , 62 , 94 , 98 Разряд дуговой 218, 219, 408
- •§ 139. Направление индукционного тока. Правило Ленца.
§ 64. Электрическая проводка. На рис. 102 показано устройство комнатной электрической проводки. Ток со станции
Рис.
102.
Электрическая водка в комнате
про-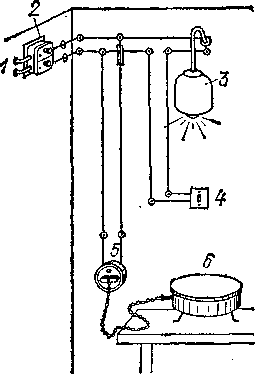
Ф®@® -Hfi*
ж) з) и)
Рис.
103. Условные обозначения на электрических
схемах: а)
выключатель простой; б)
штепсельная розетка; в)
лампа; г)
плавкий предохранитель; д)
соединение
и ответвление проводов; е)
резистор и потенциометр; ж)
'гальванометр, амперметр, вольтметр,
ваттметр; з) батарея аккумуляторов или
гальванических элементов постоянного
тока; и)
источник постоянного тока
Ф
Ф
[J
б)
SJ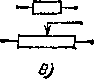
крепятся провода, способы изоляции проводов при проходе через стены, способы соединения и разветвления проводов и т. п. Чрезвычайно важно тщательно соблюдать эти правила, потому что проводка, выполненная не по правилам, легко может стать причиной пожара.
Рис.
104. Схематическое изображение электрической
проводки, показанной иа рис. 102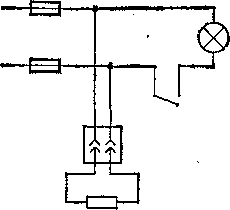
^ 64.1. Начертите схему электрической проводки в вашей комнате.
64.2. Начертите схему включения в осветительную сеть с напря- жением 220 В трех лампочек, из которых одна требует для нор. мального накала 220 В, а две другие — по 110 В каждая.
Начертите схему включения двух штепселей и двух предохранителей так, чтобы при коротком замыкании в каком-либо из штепселей второй не выбывал из строя.
Глава V. Прохождение электрического тока через электролиты
§ 65. Первый закон Фарадея. В §40 мы видели, что при прохождении тока через некоторые растворы, например через раствор серной кислоты, происходит разложение воды на составные части — водород и кислород, выделяющиеся на пластинах, соединенных соответственно с отрицательным и положительным полюсами батареи. Такого рода растворы, разлагающиеся химически при прохождении через них тока, мы будем называть электролитами, а сам процесс разложения вещества электрическим током — электролизом. Далее мы будем называть проводники, погруженные в электролит для подведения к нему тока, электродами: положительный электрод — анодом, а отрицательный — катодом 1).
Продукты разложения электролита, например водород и кислород в опыте, описанном в § 40, выделяются на электродах все время, пока идет ток. Массу выделившегося вещества можно измерить. Если подобрать такой раствор, при котором выделяющееся вещество оседает в виде твердого осадка на электроде, то эту массу можно измерить без затруднений. Так, если пропускать ток через раствор медного купороса (CuS04), то на катоде оседает медь. Это явление легко наблюдать, если сделать катод, например, из угля; на черной поверхности угля ясно заметен красноватый слой выделившейся меди. Взвешивая катод до и после опыта, можно точно определить массу осадившегося металла.
Измерения показывают, что масса вещества, выделившегося на электродах, зависит от силы тока и времени электролиза. Замыкая цепь на разные промежутки времени, можно убедиться в том, что масса выделившегося вещества
Пропорциональна времени прохождения тока. Для того чтобы установить, как она зависит от силы тока, поступим следующим образом. Изготовим несколько совершенно одинаковых электролитических ванн и составим из них цепь, как показано на рис. 105, а. Так как процесс установившийся (§ 42), то через ванны I и II проходит ток одной и той же силы. Такой же ток проходит и через рбе ванны / и 2 вместе, а так как эти ванны одинаковы, то очевидно, что токи
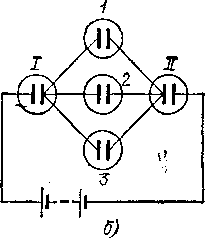
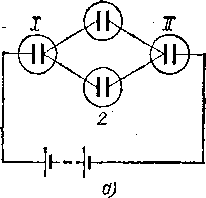 Рис.
105. Схема опыта по установлению зависимости
массы выделенного током вещества от
силы тока: а)
ток между ваннами I и II распределяется
между двумя одинаковыми ваннами 1
и 2;
б)
ток между ваннами I и II распределяется
между тремя одинаковыми ваннами 1,
2 и 3
Рис.
105. Схема опыта по установлению зависимости
массы выделенного током вещества от
силы тока: а)
ток между ваннами I и II распределяется
между двумя одинаковыми ваннами 1
и 2;
б)
ток между ваннами I и II распределяется
между тремя одинаковыми ваннами 1,
2 и 3
через ванны 1 и 2 равны друг другу и, следовательно, каждый из них равен половине тока, идущего через ванну I или
Точно так же, поместив в разветвлении три одинаковые ванны (рис. 105, б), мы получим способ пропустить через каждую из этих ванн ток, втрое меньший тока, идущего через ванну I или II, и т. д. Измеряя массу вещества (например, меди или серебра), выделившегося на катодах каждой из этих ванн, мы убедимся, что массы вещества, выделившегося в ваннах 1 и 2 (или /, 2 и 3 и т. д.), равны между собой и составляют половину (или треть и т. д.) массы вещества, выделившегося в ванне I или II. Таким образом, опыт показывает, что масса выделившегося вещества пропорциональна силе тока.
Итак, масса выделившегося вещества пропорциональна и силе тока и времени электролиза, т. е. их произведению. Но это произведение, согласно формуле (42.1), равно за-1- ряду, прошедшему через электролит. Мы видим, что масса вещества, выделившегося на электроде, пропорциональна заряду, или количеству электричества, прошедшему через электролит. Этот важный закон был установлен впервые Фарадеем и носит название первого закона Фарадея.
Если т — масса выделившегося вещества, I — сила тока, t — время электролиза, a q — полный заряд, прошедший через ванну за время t, то первый закон Фарадея можно записать так;
т = Kq — Kit, (65.1)
где К — коэффициент пропорциональности. Полагая в формуле (65.1) заряд <7=1 Кл, мы получим, что коэффициент К равен массе вещества, выделяемого зарядом 1 Кл, или иначе — массе вещества, выделяемого током 1 А за 1 с.
Исследования Фарадея показали, что величина К является характерной для каждого вещества. Так, например, при электролизе раствора ляписа (азотнокислого серебра, AgNOg) 1 Кл выделяет 1,1180 мг серебра; точно столько же серебра выделяет 1 Кл при электролизе любой серебряной соли, например хлористого серебра (AgCl) и т. д. При электролизе соли другого металла масса выделившегося вещества будет иной. Величина К называется электрохимическим эквивалентом данного вещества. Таким образом, электрохимическим эквивалентом вещества называется масса этого вещества, выделяемая при электролизе одним кулоном протекшего через раствор электричества.
Таблица 5. Электрохимический эквивалент некоторых веществ
Вещество |
К, 10 - • кг/Кл |
Серебро (Ag) Водород (Н) |
1,118 |
0,01045 |
|
Медь (Си) |
0,3294 0,6588 |
Цинк (Zn) |
0,3388 |
В табл. 5 приведены значения электрохимического эквивалента для некоторых веществ.
§ 66. Второй закон Фарадея. Из табл. 5 мы видим, что электрохимические эквиваленты различных веществ существенно ^отличны один от другого. От каких же свойств вещества зависит его электрохимический эквивалент?
Ответ на этот вопрос дает следующий важный закон, также установленный Фарадеем на опыте (второй закон Фарадея): электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность 1).
Для уяснения этого закона рассмотрим конкретный пример. Молярная масса серебра равна 0,1079 кг/моль, его валентность—1. Молярная масса цинка равна
0654 кг/моль, его валентность — 2. Поэтому по второму закону Фарадея электрохимические эквиваленты серебра и цинка должны относиться, как
0,1079.0,0654 _3 30
Согласно табл. 5, экспериментальные значения электрохимических эквивалентов равны 1,118-10_в кг/Кл для серебра и 0,3388-Ю-6 кг/Кл для цинка; их отношение равно 1,118/0,3388=3,30, что согласуется со вторым законом Фарадея.
Если обозначить по-прежнему через К [кг/Кл! электрохимический эквивалент вещества, через М [кг/моль] — его молярную массу, а через и — валентность (п=1, 2,...), то второй закон Фарадея можно записать в виде
Здесь через MF обозначен коэффициент пропорциональности, который является универсальной постоянной, т. е. имеет одинаковое значение для всех веществ. Величина F называется постоянной Фарадея. Ее значение, найденное экспериментально, равно
/7 = 96 484 Кл/моль.
Некоторые элементы в разных соединениях обладают различной валентностью. Так, например, медь одновалентна в хлористой меди(СиС1), закиси меди (Сц,0) и еще в некоторых солях, и медь двухвалентна в хлорной меди (СиС12), окиси меди (СиО), медном купоросе (CuS04) и еще в некоторых соединениях. При электролизе в растворе с одновалентной медью заряд 1 Кл всегда выделяет 0,6588 мг меди. При электролизе же в растворе с двухвалентной медью заряд 1 Кл выделяет всегда вдвое меньше меди, именно 0,3294 мг. Как мы видим, медь имеет два значения электрохимического эквивалента (табл. 5).
Отношение молярной массы какого-либо вещества к его валентности М1п называют химическим эквивалентом дэнно- го вещества. Это отношение показывает, какая масса данного вещества необходима для замещения одного моля водорода в химических соединениях 2). У одновалентных веществ химический эквивалент> численно равен молярной массе. Пользуясь этим понятием, можно выразить второй закон Фарадея следующим образом: электрохимические эквиваленты веществ пропорциональны их химическим эквивалентам.
Объединив формулы (65.1) и (66.1), можно выразить оба закона Фарадея в виде одной формулы:
1 М * 0.
m = F-<7, (66.2)
где т —; масса вещества, выделяющегося при прохождении через электролит количества электричества q. Эта формула имеет простой физический смысл. Положим в ней т— = М/п, т. е. возьмем массу одного химического эквивалента данного вещества. Тогда получим F—q. Это значит, что постоянная Фарадея F численно равна заряду q, который необходимо пропустить через любой электролит, чтобы выделить на электродах вещество в количестве, равном одному химическому эквиваленту.
Каким образом, опустив два провода от гальванического
элемента в стакан с водой, можно узнать, существует ли между
ними напряжение? Вода, не подвергнутая специальной тщательной очистке, всегда содержит растворы различных солей и является проводником.
Для того чтобы определить, какой из полюсов источника тока положительный, а какой отрицательный^ опускают провода, соединенные с полюсами, в стакан с водой и наблюдают, возле какого из проводов выделяется больше газа. Как по этим данным определить, какой из полюсов отрицательный?
Найдите электрохимические эквиваленты свинца, натрия и алюминия. Сколько каждого из этих веществ может быть выделено током 5 А в продолжение 10 ч?
Зная, что электрохимический эквивалент водорода равен 1,045 -10~8 кг/Кл, вычислите электрохимический эквивалент хлора. Валентность хлора равна 1, относительные атомные массы хлора и водорода равны 35,45 и 1,008.
§ 67. Ионная проводимость электролитов. Сам факт разложения электролитов при прохождении через них тока показывает, что в них движение зарядов сопровождается движением атомов или групп атомов, связанных друг с другом (например, S04, N03 и т, п.); эти атомы или атомные
группы представляют собой части молекулы растворенного вещества. Естественно предположить, что заряжены именно эти части молекулы в растворе и что они являются носителями электрического заряда. Их перемещение под действием сил электрического поля и представляет собой электрический ток, идущий через электролит.
Было обнаружено, что при прохождении тока через электролит выделение вещества происходит на обоих электродах. По химическому составу это разные части молекулы растворенного вещества. По количеству, если измерять его в химических эквивалентах, они равны. Знаки зарядов у них, очевидно, противоположны.
Мы говорили уже (§ 5), что заряженные атомы называются ионами. То же название носят заряженные молекулы или их части. Мы можем, следовательно, сказать, что проводимость электролитов является ионной, т. е. обусловлена движением в них положительных и отрицательных ионов, которые образуются из нейтральной молекулы путем распада ее на две части, заряженные равными и противоположными зарядами. Молекулы растворенного вещества, которые до растворения были электрически нейтральны, при
&*-
&>-о
/-"Ч
/~ч
д
К
о
°
о
е
®
О
©
°
О
Ф
О
0
О
0
©
о
К
о
о
о
о
О
<-е
-СЕн
![]()
о
Рис. 106. Проводимость электролита зависит от наличия положительных и отрицательных ионов (кружки со знаками •«+» или «—»): а) цепь разомкнута, тока нет; б) цепь замкнута, через электролит идет ионный
ток
растворении распадаются на положительные и отрицательные ионы, способные перемещаться независимо друг от друга.
Эти представления иллюстрируются рис. 106. Кружками между электродами со значками «+» и «—» схематически изображены положительные и отрицательные ионы растворенного вещества. Пока между электродами А и К не создано поле, ионы эти совершают только беспорядочное тепловое движение, как и все остальные молекулы раствора
(рис. 106, а). В каждом направлении за единицу времени протекает одинаковый положительный и отрицательный заряд, т. е. нет электрического тока — преимущественного переноса заряда в определенном направлении. При наложении разности потенциалов на электроды А и К, когда внутри электролита возникает электрическое поле, на это беспорядочное движение накладывается упорядоченное движение в противоположные стороны ионов различных знаков: отрицательных — к аноду А, положительных — к катоду К (рис. 106, б).
При соприкосновении -с катодом положительные ионы получают недостающие им электроны и выделяются в виде нейтральных атомов, а взамен электронов, нейтрализовавших ионы, новые электроны переходят от батареи к катоду. Точно так же отрицательные ионы при соприкосновении с анодом отдают ему свои избыточные электроны, превращаясь в нейтральные атомы; электроны же уходят по металлическим проводам в батарею. Таким образом, ток в электролите обусловлен движущимися ионами; на электродах же происходит нейтрализация ионов и выделение их в виде нейтральных атомов (или молекул). Итак, электрический ток в электролитах представляет собой движение положительных и отрицательных ионов.
Такое представление об электролизе подкрепляется многочисленными фактами. С этой точки зрения первый закон Фарадея (§ 65) получает простое объяснение. Каждый осаждающийся на электроде ион переносит с собой некоторый электрический заряд. Это значит, что полный заряд, перенесенный всеми ионами, должен быть пропорционален полному числу ионов, осевших на электродах, т. е. массе выделенного вещества. А это и есть первый закон Фарадея. Так же естественно и просто объясняется с этой точки зрения и второй закон Фарадея, дающий возможность вычислить электрический заряд, связанный с каждым ионом (§69).
Отметим, что название «ион» введено Фарадеем (от греческого слова «ион» — идущий). Ионы, заряженные положительно и выделяющиеся на катоде, Фарадей назвал катионами, ионы, выделяющиеся на аноде,— анионами.
Опыт показал, что водород и металлы всегда выделяются на катоде; это значит, что в электролитах водород и металлы образуют положительные ионы.
л 67.1. При прохождении электрического тока через электролиты
они нагреваются. Исходя из представлений об ионной проводимости, объясните это.
Почему провода осветительной сети непременно имеют резиновую оболочку, а провода, предназначенные для сырых помещений, кроме того, бывают просмолены снаружи?
Почему гораздо опаснее браться за электрические провода мокрыми руками, чем сухими?
