
- •5.6. Первая медицинская помощь и помощь на этапах медицинской эвакуации
- •Глава 6. Отравляющие вещества удушающего
- •6.1. Физико-химические и токсические свойства
- •Механизм действия и патогенез токсического отека легких
- •Клиника поражения
- •6.4. Патологоанатомические изменения
- •6.5. Лечение токсического отека легких
- •6.6. Первая медицинская помощь и помощь на этапах медицинской эвакуации
- •Глава 7. Отравляющие вещества раздражающего действия. Зажигательные вещества
- •7.1. Общая характеристика, способы применения
- •7.2. Физико-химические и токсические свойства
- •7.3. Механизм действия и клиника поражения
- •7.4. Первая медицинская помощь и лечение
- •7.5. Фосфор
- •7.6. Зажигательные вещества
- •Вопросы и задания
- •Глава 8. Ракетные топлива и технические жидкости
- •8.1. Общая характеристика
- •8.2 Азотная кислота и окислы азота
- •8.3. Фтор и его соединения
- •8.4. Перекись водорода
- •8.5. Гидразин и его производные
- •Бороводороды
- •8.7. Амино- и нитросоединения
- •8.7.1.Аминосоединения
- •8.7.2.Нитросоединения
Глава 6. Отравляющие вещества удушающего
ДЕЙСТВИЯ
К ОВ удушающего действия относятся такие вещества, которые при ингаляционном отравлении вызывают поражение органов дыхания и токсический отек легких с развитием острого кислородного голодания.
В качестве ОВ удушающего действия в первую мировую войну применялись хлор, хлорпикрин, фосген и дифосген. В последующем хлор из-за низкой токсичности был снят с вооружения. Хлорпикрин в настоящее время применяется как учебное ОВ для проверки противогазов.
Таким образом, к этой группе ОВ сейчас относится фосген и дифосген.
6.1. Физико-химические и токсические свойства
С1
Фосген имеет формулу СОС12, или С = О, и является
С1
хлорангидридом угольной кислоты. Впервые был получен еще в 1812 г. Дж. Деви при взаимодействии окиси углерода и хлора на солнечном свету, откуда и произошло его название фосген, что значит «светорожденный»:
СО + С12------------------- СОС12.
Представляет собой бесцветную жидкость с температурой кипения 8,2°С. При более высоких температурах и обычном давлении превращается в парообразное состояние и имеет запах прелого сена или гнилых яблок. Является типичным нестойким веществом (стойкость на местности в летнее время 15—30 мин). Летучесть фосгена при температуре 20°С равна 6370 мг/л воздуха. Пары его в 3,5 раза тяжелее воздуха.
Фосген является липидотропным веществом, то есть плохо растворяется в воде, а хорошо — в органических растворителях, жирах и липидах.
В воде весьма быстро гидролизуется, в особенности при нагревании, с образованием практически нетоксичных веществ:
СОС12 + Н2О -> СО2 + 2HCI.
Фосген быстро обезвреживается щелочными веществами и аммиаком: СОС12 + 4NaOH ----- Na2CО3 + 2NaCl + 2Н2О
NH2
СОС12 + 4NH3 ---- С= О + 2NH4CI. \
NH2
Следует отметить, что фосген широко применяется в химической промышленности как полуфабрикат для синтеза красок и других веществ, поэтому его производство налажено во многих странах в больших количествах.
Дифосген по молекулярному составу представляет собой удвоенную молекулу фосгена (СОС12)2. По химической структуре является трихлорметиловым эфиром фосгена:
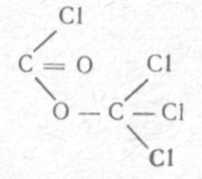
Дифосген — бесцветная или слегка буроватая жидкость с таким же запахом, как у фосгена. Удельный вес 1,7. Температура кипения 128°С, поэтому стойкость его летом до 2—3 ч, в лесу — до 10 ч, зимой — до суток, он относится также к нестойким ОВ, Температура плавления — 57°С, Пары его в 7 раз тяжелее воздуха. Является липидотропным веществом.
Химические свойства аналогичны свойствам фосгена, то есть также гидролизуется водой и обезвреживается щелочами.
Хлорпикрин, CC13NО2, трихлорнитрометан, представляет собой желтоватого цвета жидкость с резким раздражающим запахом. Плотность 1,66 г/см3. Закипает при 113°С, относится также к нестойким ОВ. Температура замерзания — 66,2°С. Пары его в 5,7 раза тяжелее воздуха. Является липидотропным веществом.
По химическим свойствам весьма стоек. Водой не гидролизуется даже при кипячении. Разрушается растворами щелочей и сернистым натрием в водно-спиртовой среде,
В мирное время нередко применяется для дератизации и при неправильном обращении могут быть отравления персонала.
Токсичность. Фосген и дифосген вызывают практически только ингаляционные поражения. Смертельная токсическая доза СL100 —5 мг/л при экспозиции 1 мин, условносмертельная концентрация CL50 — 3,2 мг-мин/л., средневыводящая концентрация 1С50 — 1,6 мг-мин/л. Концентрация паров фосгена 0,3 мг/л вызывает смертельное поражение при экспозиции 15 мин.
Хлорпикрин в концентрации 0,009 мг/л оказывает сильное слезоточивое и раздражающее действие (что и используется для проверки противогазов), а в концентрации 2 мг/л и экспозиции 10—15 мин — смертельное поражение с развитием токсического отека легких.
