
- •Опыт 4. Свойства фенола
- •Лабораторная работа №3. Альдегиды и кетоны опыт 1. Реакции окисления альдегидов
- •Опыт 3. Получение и свойства предельных высших кислот и их солей
- •1. Пробирки (3 шт.).
- •Опыт 4. Сложные эфиры органических кислот. Реакция этерификации
- •2. Термометр.
- •4. Пробирки (2шт).
- •Опыт 5. Непредельные одноосновные карбоновые кислоты Свойства олеиновой кислоты
- •1. Пробирки (2шт).
- •Лабораторная работа №4. Азотсодержащие соединения опыт 1. Образование солей анилина
- •Опыт 2. Реакции на карбонильные группы в моносахаридах
- •Опыт 3. Реакция на гидроксильные группы дисахаридов. Реакция дисахаридов с гидроксидом меди (II) в щелочном растворе
- •1. Пробирки (2шт.).
- •Опыт 4. Реакции дисахаридов по карбонильным группам (сравнение свойств восстанавливающих и невосстанавливающих дисахаридов)
- •1. Пробирки (3 шт.).
- •Лабораторная работа № 6. Качественные реакции на аминокислоты и белки
- •Лабораторные работы по вмс углеводы
Опыт 4. Свойства фенола
Необходимые реактивы и оборудование
1. Пробирки (3 шт.).
2. Фенол.
3. Гидроксид натрия, 2 н. раствор.
4. Серная кислота, 2 н. раствор.
5. Фенол, 5%-ный раствор.
6. Хлорид железа (III) FеСl3, 5%-ный раствор.
7. Бромная вода (Вг2/Н2О).
8. Перманганат калия КМnО4, 1%-ный раствор.
9. Карбонат натрия Nа2СО3, 5%-ный раствор.
Растворимость фенола
В пробирку поместить немного фенола (на кончике шпателя). (Осторожно! Фенолы вызывают ожоги кожи!). Прибавить 2-3 мл воды, перемешать. Какова растворимость фенола в воде?
Чрезвычайно легко протекающее бромирование (при комнатной температуре без катализатора), приводящее к синтезу выделяющегося в осадок 2, 4, 6-трибромфенола, является весьма чувствительной реакцией на фенол (фенол обнаруживается при концентрации 1:100000).
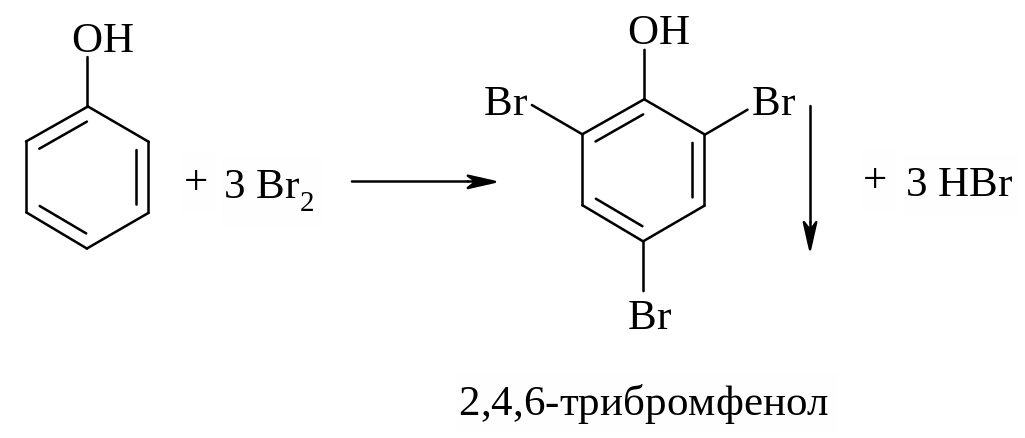
Следующая реакция также может служить для обнаружения фенола
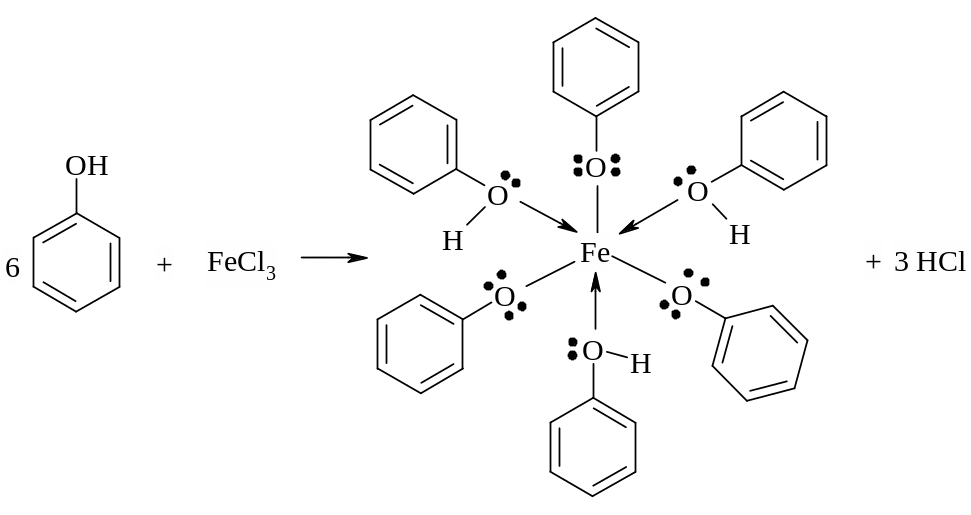
Реакция фенола с хлоридом железа (III) FeCl3
В пробирку налить 1 мл раствора фенола и прибавить 1 каплю хлорида железа (III). Появляется интенсивное фиолетовое окрашивание раствора. В растворе фенол реагирует с ионом железа (III) Fе3+, образуя комплекс фиолетового цвета.
Окисление фенола
В пробирке растворить 0,1 г фенола в растворе карбоната натрия NаСО3. Затем при взбалтывании добавлять по каплям раствор КМпО4. Раствор обесцвечивается, выпадает бурый осадок.
Объясните наблюдение изменения окраски.
Лабораторная работа №3. Альдегиды и кетоны опыт 1. Реакции окисления альдегидов
Необходимые реактивы и оборудование
1. Пробирки (2шт.).
2. Баня водяная.
3. Термометр.
4. Формальдегид, 5%-ный раствор.
5. Гидроксид натрия, 10%-ный раствор.
6. Сульфат меди CuSO4, 2%-ный раствор.
7. Нитрат серебра АgNО3, 1%-ный раствор.
8. Аммиак NН3, 5%-ный раствор (в капельнице).
Окисление формальдегида аммиачным раствором гидроксида серебра (реактивом Толленса) – реакция серебряного зеркала.
Для получения «серебряного зеркала» необходимо сначала хорошо вымыть пробирку. Для этого в пробирке прокипятить (осторожно!) в течение 1-2 мин около 5 мл 10%-ного раствора NaOH, а затем сполоснуть ее дистиллированной водой. В вымытой пробирке приготовить аммиачный раствор гидроксида серебра: к 2-3 мл 1%-ного раствора нитрата серебра прибавлять по каплям при встряхивании 5%-ный раствор аммиака до тех пор, пока образующийся сначала осадок полностью растворится. Избыток аммиака в растворе снижает чувствительность реакции.
2AgNO3 + 2NH4OH Ag2O! + 2NH4NO3 + H2O
Ag2O + 4NH4OH 2[Ag(NH3)2] OH + 3H2O
Ag2O + 4NH4OH 2[Ag(NH3)2]+ + OH– + 3H2O
К полученному бесцветному раствору прибавить несколько капель 5%-ного раствора формальдегида и опустить пробирку на несколько минут в водяную баню с температурой воды 60-70 °С. На стенках пробирки постепенно выделится слой серебра в виде зеркала, иногда серебро выделяется в виде темного осадка.
Напишите уравнение реакции окисления реактивной Толленса, содержащим комплексные ионы [Ag(NH3)2]+, формальдегида до муравьиной кислоты. Подберите коэффициенты. Вступает ли в эту реакцию ацетон (и другие кетоны)?
Окисление формальдегида гидроксидом меди (II). В пробирку налить 2 мл 5%-ного раствора формальдегида, 2 мл 10%-ного раствора NaOH и при встряхивании добавлять по каплям 2%-ный раствор сульфата меди (II) до появления неисчезающей взвеси.

Верхнюю часть жидкости нагреть до начинающегося кипения. Голубая окраска меняется на желтую (осадок),
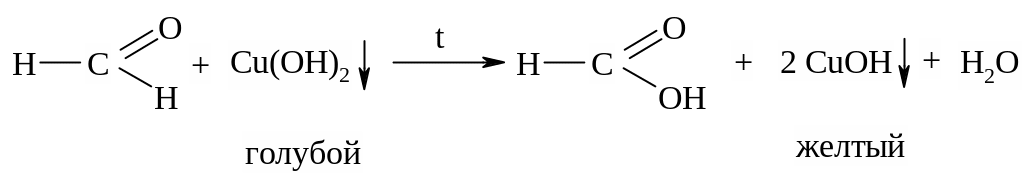
а затем на красную (осадок):
2CuOH Cu2O + H2O
краснокирпичного
цвета
Эта реакция, как и реакция серебряного зеркала, является качественной реакцией на альдегиды.
Обратите внимание, какие соединения меди имеют голубую, желтую и красную окраску.
Повторите опыт, но вместо раствора формальдегида введите ацетон. Почему при нагревании смеси гидроксида меди (II) с ацетоном образуется осадок черного цвета?
Лабораторная работа №4. КАРБОНОВЫЕ КИСЛОТЫ
И ИХ ПРОИЗВОДНЫЕ. ЖИРЫ
ОПЫТ 1. Сравнение силы карбоновых и минеральных кислот
Необходимые реактивы и оборудование
1. Универсальная индикаторная бумага со шкалой рН.
2. Пипетки.
3. Кислоты (муравьиная, уксусная, масляная, щавелевая, янтарная, соляная), 0.1 н. растворы.
На полоску индикаторной бумаги нанести по капле растворов органических кислот и соляной кислоты. С помощью шкалы определить рН этих растворов. Результаты опыта записать в тетрадь.
ОПЫТ 2. Получение и свойства уксусной кислоты и ее солей
Необходимые реактивы и оборудование
1. Пробирки (6шт.).
2. Ацетат натрия СН3СООNа, кристаллический.
3. Серная кислота Н2SO4, концентрированная.
4. Серная кислота Н2SO4, 10%-ный раствор.
5. Уксусная кислота, СН3СООН, ледяная.
6. Уксусная кислота СН3СООН, 10%-ный раствор.
7. Карбонат натрия Nа2СО3, 10%-ный раствор.
8. Магний Mg металлический.
9. Оксид меди (II) СuО.
10. Метиловый оранжевый.
11. Фенолфталеин, 1%-ный спиртовый раствор.
12. Лакмусовая бумага.
13. Газоотводная трубка.
Получение уксусной кислоты из ацетата натрия
(Тяга!) В пробирку поместить 3-4 кристалла ацетата натрия и добавить 1-2 мл концентрированной серной кислоты. Пробирку закрыть газоотводной трубкой и осторожно нагреть реакционную смесь. Выделяющуюся уксусную кислоту определяют по запаху (осторожно!) и по изменению цвета влажной синей лакмусовой бумаги, поднесенной к отверстию газоотводной трубки. Напишите уравнение реакции.
Кислотные свойства уксусной кислоты
В 3 пробирки налить по 1 мл 10%-ного раствора уксусной кислоты. В первую пробирку добавить 1 каплю метилового оранжевого, во вторую – 1 каплю 1%-ного спиртового раствора фенолфталеина, а в третью пробирку опустить кусочек ленты лакмусовой бумаги. Отметить, в каких пробирках изменилась окраска. Результаты опыта записать в тетрадь. Прилить в пробирки избыток раствора гидроксида натрия. Что происходит? Написать уравнение реакции.
Взаимодействие уксусной кислоты с карбонатом натрия
К 2-3 мл 10%-ного раствора карбоната натрия прилить 2 мл ледяной уксусной кислоты. Что вы наблюдаете? Напишите уравнение реакции. Какой вывод можно сделать о кислотных свойствах уксусной кислоты и угольной кислоты? Будет ли уксусная кислота реагировать с растворами сульфата натрия и хлорида натрия?
Взаимодействие уксусной кислоты с магнием и оксидом меди (II)
В пробирку налить 1-2 мл уксусной кислоты, добавить немного металлического магния и закрыть пробирку прямой газоотводной трубкой с оттянутым концом. Через некоторое время поджечь выделяющийся газ. Напишите уравнение реакции.
К 0,2 г оксида меди (II), помещенного в пробирку, прилить 1-2 мл уксусной кислоты, затем пробирку осторожно нагреть. Обратите внимание на цвет раствора. Напишите уравнение реакции.
