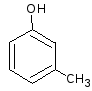
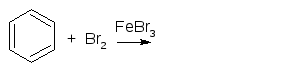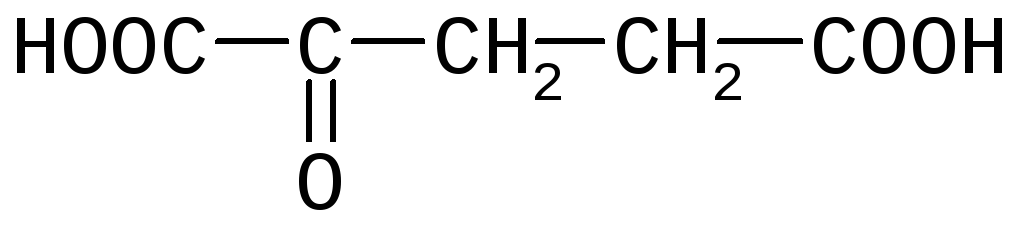- •7) Осуществить цепочку превращений и назвать вещества:
- •8) Осуществить цепочку превращений и назвать вещества:
- •9) Осуществить цепочку превращений, назвать вещества и указать биологическую роль участников реакций:
- •4. Тематика рефератов по учебно-исследовательской работе студентов (уирс).
- •1. Образование хелатного соединения глицерата меди.
- •2. Восстанавливающие свойства альдегидов.
- •3. Реакция на ацетон (йодоформная проба).
- •4.Открытие щавелевой кислоты в виде кальциевой соли.
- •5. Проба Уффельмана на молочную кислоту.
- •6. Доказательство отсутствия фенольного гидроксила в ацетилсалициловой кислоте (аспирин) и ее гидролиз.
- •1. Вопросы для обсуждения:
- •4. Задания для самостоятельного решения (выполнить письменно):
- •Лабораторная работа: «Свойства моно-, ди- и полисахаридов».
- •1. Доказать наличие нескольких гидроксильных групп в d-глюкозе.
- •2. Окисление d-глюкозы в мягких условиях(реакции на наличие альдегидной группы):
- •3. Реакция Селиванова на фруктозу.
- •4. Восстанавливающие свойства лактозы:
- •5. Отсутствие восстанавливающих свойств у сахарозы:
- •6. Качественная реакция на крахмал
- •Лабораторная работа: „Изучение свойств простых, сложных и неомыляемых липидов”
- •1. Открытие в гидролизате жира составных частей.
- •2. Качественная реакция на холестерин.
- •Лабораторная работа: «Свойства мочевой кислоты».
- •3. Выполнить тестовые задания (письменно):
- •3. Задания для самостоятельного решения (выполнить письменно):
- •1. Биуретовая реакция (проба на пептидную связь).
- •2. Нингидриновая реакция.
- •3. Ксантопротеиновая реакция.
- •4. Реакции на аминокислоты, содержащие слабосвязанную серу (Фоля) – реакция на цистеин.
- •Карбоновые кислоты, гетерофункциональные кислоты
- •Значения рКа некоторых кислот
- •Список аминокислот
- •Список рекомендуемой литературы:
СОДЕРЖАНИЕ
|
Занятие 12. |
Классификация, номенклатура, изомерия органических соединений. Взаимное влияние атомов. Сопряжение. Ароматичность. Реакционная способность углеводородов.
|
|
Занятие 13. |
Кислотность и основность органических соединений. Строение и реакционная способность гидрокси-, оксосоединений и карбоновых кислот. Механизмы химических реакций. Строение, биологическая роль и медицинское применение гетерофункциональных соединений (гидроксикислот, кетокислот, фенолокислот).
|
|
Занятие 14. |
Углеводы. Строение и химические свойства моно-, ди- и полисахаридов.
|
|
Занятие 15. |
Строение, свойства и биологическая роль простых и сложных липидов. Неомыляемые липиды.
|
|
Занятие 16. |
Классификация, строение и значение биологически важных гетероциклических соединений. Общая характеристика витаминов. Строение и биологическая роль нуклеозидов, нуклеотидов и нуклеиновых кислот.
|
|
Занятие 17. |
Строение, свойства и биологическая роль α-аминокислот. Структурная организация и физико-химические свойства белков.
|
|
Занятие 18. |
Высокомолекулярные соединения. Рубежная контрольная работа №2. |
Занятие №12 Тема: «Классификация, номенклатура, изомерия органических соединений. Взаимное влияние атомов. Сопряжение. Ароматичность. Реакционная способность углеводородов».
Вопросы для обсуждения:
|
|
Классификация органических соединений по типам и классам. Типы изомерии органических соединений. |
|
|
Номенклатура органических веществ (ИЮПАК). Таблица старшинства функциональных групп. |
|
|
Типы гибридизации атома углерода (sp, sp2, sp3-гибридизация). Типы химических связей. |
|
|
Сопряжённые системы. Энергия сопряжения. Строение, биологическая роль, применение -каротина, ретинола, ретиналя. |
|
|
Критерии ароматичности. Ароматичность гомо- и гетероциклических соединений. |
|
|
Взаимное влияние атомов и групп атомов в молекулах органических веществ. Электронные эффекты: индуктивный и мезомерный. Понятие об электронодонорах (ЭД) и электроноакцепторах (ЭА). |
|
|
Типы разрыва ковалентной связи: гомолитический, гетеролитический. Понятие о радикалах, нуклеофильных и электрофильных частицах. |
|
|
Классификация реакций в органической химии: замещения (S), присоединения (А), отщепления-элиминирования (Е). |
|
|
Алканы. Циклоалканы. Номенклатура. Строение. Изомерия. Химические свойства. Механизм радикального замещения (SR). |
|
|
Алкены. Алкадиены. Алкины. Номенклатура. Строение. Изомерия. Химические свойства. Механизм электрофильного присоединения (АЕ). |
|
|
Арены. Номенклатура. Строение. Изомерия. Химические свойства. Механизм электрофильного замещения (SE). Ориентирующее действие заместителей. |
Ситуационные задачи с эталонами решения:Пользуясь «Руководством к лабораторным занятиям по биоорганической химии» под ред. Н.А. Тюкавкиной,ознакомиться с заданиями:
а) стр. 24. Обучающая задача 1 в) стр. 36. Обучающая задача 2
б) стр. 34. Обучающая задача 1 г) стр. 69 Обучающая задача 1
Выполнить тестовые задания (письменно):
|
|
|
Назвать вещество по международной номенклатуре (IUPAС):
|
|
|
А |
3-метилбутанон-2 |
|
|
Б |
3-метилбутанол-2 |
|
|
В |
метилизопропиловый простой эфир |
|
|
Г |
изопропилацетат |
|
|
|
|
|
|
|
Назвать вещество по систематической номенклатуре (IUPAС):
|
|
|
А |
пропанол-2 |
|
|
Б |
вторичный пропиловый спирт |
|
|
В |
изопропиловый спирт |
|
|
Г |
пропанон-2 |
|
|
|
|
|
|
|
Назвать вещество по международной номенклатуре:
|
|
|
А |
бутандиовая кислота |
|
|
Б |
2-оксибутановая кислота |
|
|
В |
2-гидроксибутандиовая кислота |
|
|
Г |
2-оксобутандиовая кислота |
|
|
|
|
|
|
|
Назвать вещество по тривиальной номенклатуре:
|
|
|
А |
пара-крезол |
|
|
Б |
мета-крезол |
|
|
В |
бензиловый спирт |
|
|
Г |
мета-метилбензол |
|
|
|
|
|
|
|
Определить принадлежность вещества к классу органических соединений:
|
|
|
А |
фенол |
|
|
Б |
гетероциклическое соединение |
|
|
В |
ароматический спирт |
|
|
Г |
алифатический спирт |
|
|
|
|
|
|
|
Назвать вещество по международной номенклатуре:
|
|
|
А |
2,3-диметилгексаналь |
|
|
Б |
2-метил-3-пропилбутаналь |
|
|
В |
1,2-диметилпентаналь |
|
|
Г |
3-метилгексаналь |
|
|
|
|
|
|
|
Назвать соединение: Н3С – СН2– С = С – СН2– СН3 | | CH3 CH3 |
|
|
А |
2-метил-3-этилпентан |
|
|
Б |
3,4-диметилгексен-3 |
|
|
В |
2-этил-3-метилпентен-2 |
|
|
Г |
диметилэтилэтилен |
|
|
|
|
|
|
|
Назвать соединение: Н3С – СН – СН2– С ≡ С – СН2– СН3 | CH3 |
|
|
А |
6-метилгептин-3 |
|
|
Б |
2-метилгептин-4 |
|
|
В |
2-метилгептен-4 |
|
|
Г |
6-метилгептен-3 |
|
|
|
|
|
|
|
Выбрать примеры открытых сопряженных систем в организме человека: |
|
|
А |
изопрен, -каротин, ретинол |
|
|
Б |
-каротин, ретинол, ретиналь |
|
|
В |
ретинол, ретиналь, бутадиен-1,3 |
|
|
Г |
витамин А, ретиналь, фенантрен |
|
|
|
|
|
10. |
|
Укажите число электронов, которые принимают участие в образовании замкнутой сопряженной системы пиримидинав соответствии с правилом Хюккеля. |
|
|
А |
6 |
|
|
Б |
14 |
|
|
В |
10 |
|
|
Г |
26 |
|
|
|
|
|
11. |
|
Укажите число электронов, которые принимают участие в образовании замкнутой сопряженной системы пуринав соответствии с правилом Хюккеля. |
|
|
А |
10 |
|
|
Б |
6 |
|
|
В |
26 |
|
|
Г |
14 |
|
|
|
|
|
12. |
|
К
какому типу реакций относится реакция
взаимодействия хлора с пропаном на
свету:
|
|
|
А |
SR |
|
|
Б |
SE |
|
|
В |
AE |
|
|
Г |
AN |
|
|
|
|
|
13. |
|
К какому типу реакций относится реакция взаимодействия бутена-1 с хлороводородом: СН2=СН-СН2-CH3 + HCl |
|
|
А |
SR |
|
|
Б |
SE |
|
|
В |
AE |
|
|
Г |
AN |
|
|
|
|
|
14. |
|
Укажите название продукта реакции пропена с водой в кислой среде: CH2=CH-CH3 + Н2О |
|
|
А |
пропанол-2 |
|
|
Б |
1,2,3-пропантриол |
|
|
В |
1,2-пропандиол |
|
|
Г |
пропанол-1 |
|
|
|
|
|
15. |
|
К какому типу реакций относится реакция взаимодействия циклопропана с хлором: |
|
|
А |
SR |
|
|
Б |
SE |
|
|
В |
AE |
|
|
Г |
AN |
|
|
|
|
|
16. |
|
К какому типу реакций относится реакция взаимодействия бензола с бромом в присутствии кислоты Льюиса:
|
|
|
А |
SR |
|
|
Б |
SE |
|
|
В |
AE |
|
|
Г |
AN |
|
17. |
|
Какой продукт получится при взаимодействии фенола с азотной кислотой: С6Н5ОН + HNO3 (конц.) |
|
|
А |
2,3-динитрофенол |
|
|
Б |
нитробензол |
|
|
В |
2,4,6-тринитрофенол |
|
|
Г |
3,5-динитрофенол |
|
|
|
|
|
18. |
|
По влиянию на направление реакций электрофильного замещения в бензольном ядре, заместители делятся на орто-, пара- (Iрода) и мета- (IIрода)-ориентанты. Какой из приведённых заместителей относится к мета-ориентантам? |
|
|
А |
-N(CH3)2 |
|
|
Б |
-С2Н5 |
|
|
В |
-СНО |
|
|
Г |
-OH |
|
|
|
|
|
19. |
|
Какие электронные эффекты в молекуле анилина проявляет аминогруппа: |
|
|
А |
–I, -M |
|
|
Б |
–I, +M |
|
|
В |
Только –I |
|
|
Г |
+I, -M |
|
|
|
|
|
20. |
|
Какие электронные эффекты в п-аминосалициловой кислоте проявляет карбоксильная группа: |
|
|
А |
–I, -M |
|
|
Б |
–I, +M |
|
|
В |
Только –I |
|
|
Г |
+I, -M |
|
|
В |
Только –I |
Вспомогательный материал:
Таблица старшинства функциональных групп.
|
Группа |
Название группы |
Классы соединений |
Пример |
Название | |
|
Префикс |
Окончание | ||||
|
|
Карбоксильная |
Карбоновые кислоты |
СH3COOH этановая кислота |
Карбокси- |
-овая кислота |
|
-SO3H |
Сульфо
|
Сульфокислоты |
R-SO3H |
Сульфо- |
-сульфоновая кислота |
|
|
Карбонильная |
Альдегиды |
этаналь |
Оксо- |
-аль |
|
Кетоны |
пропанон |
Оксо- |
-он | ||
|
-OH |
Гидроксильная |
Спирты |
C2H5OH этанол |
Гидрокси- |
-ол |
|
Фенолы
|
гидроксибензол | ||||
|
-SH |
Тиольная |
Тиолы |
СН3SH метантиол |
Меркапто- |
-тиол |
|
-NH2 |
Амино
|
Амины |
СН3NH2 Метиламин |
Амино- |
-амин |
Задания для самостоятельного решения (выполнить письменно):
1)В состав гормона окситоцина входит изолейцин. Назвать по заместительной номенклатуре ИЮПАК и указать функциональные группы в молекуле изолейцина:
![]()
2)Двухосновная гидроксикарбоновая кислота, впервые выделенная из незрелых яблок, известна под тривиальным названием яблочная кислота. Назвать по заместительной номенклатуре ИЮПАК и указать функциональные группы в молекуле яблочной кислоты:
![]()
3)Аминокислота метионин входит в состав большинства белков и служит источником метильных групп в биосинтетических процессах. Название метионина по заместительной номенклатуре: 2-амино-4-метилтиобутановая кислота. Написать структурную формулу метионина.
4)В качестве подсластителя продуктов для больных сахарным диабетом используется ксилит, называемый по заместительной номенклатуре ИЮПАК пентанпентаол-1,2,3,4,5. Написать структурную формулу ксилита и определить, к какому классу соединений он относится.
5)В основе одной из групп жаропонижающих и болеутоляющих средств лежит
4-аминофенол (4-амино-1-гидроксибензол). Написать структурную формулу этого соединения и назвать функциональные группы.
6) Используя критерии доказать ароматичность следующих соединений:
а) нафталин
б) анилин
в) пиррол
7)Изобразить графически действие индуктивного эффекта заместителей в молекулах хлороформа и толуола.
8)Изобразить графически действие индуктивного и мезомерного эффектов заместителей в молекулах фенола и бензойной кислоты.
9) Написать уравнение реакции бромирования 2-метилбутана при облучении УФ-светом и назвать продукт. Указать механизм реакции. Объяснить причины региоселективности этой реакции.
10) Написать уравнения реакций пропена и 2-метилпропена с хлороводородом. Какой из этих алкенов более активен в реакциях электрофильного присоединения? Дать обоснование правилу Марковникова с учетом электронных эффектов.
11) Написать уравнение реакции изопрена (2-метилбутадиена-1,3) с одним молемBr2. Назвать продукты. Указать механизм реакции.
12) Реакция бромирования фенола используется в фармацевтическом анализе. Написать уравнения реакций бромирования бензола и фенола. Назвать продукты. Указать механизм. Сравнить условия проведения реакций.
Тематика рефератов по учебно-исследовательской работе студентов (УИРС).
|
|
Роль биоорганической химии в биохимии и медицине. |
|
|
Тетрапиррольные биологически активные молекулы: гемоглобин, витамин В12, хлорофилл – как представители ароматических систем. |
|
|
Ароматические соединения, как основа лекарственных препаратов. |
Источники информации. См. на стр. 55.
Занятие № 13 Тема: «Кислотность и основность органических соединений. Строение и реакционная способность гидрокси-, оксосоединений и карбоновых кислот. Механизмы химических реакций. Строение, биологическая роль и медицинское применение гетерофункциональных соединений (гидроксикислот, кетокислот, фенолокислот)».
Вопросы для обсуждения:
|
1. |
Кислотные и основные свойства органических соединений: протолитическая теория Бренстеда, теория кислот и оснований Льюиса. Показатель кислотности (рК). Факторы, влияющие на силу кислот и оснований (стр. 53). |
|
2. |
Строение, свойства и медико-биологическое значение одно- и многоатомных спиртов. Механизмы реакций SN. |
|
3. |
Строение и номенклатура простых эфиров, тиоспиртов (меркаптанов), аминов. |
|
4. |
Строение, свойства и медико-биологическое значение одно- и двухатомных фенолов. |
|
5. |
Строение и реакционная способность карбонильных соединений: альдегидов и кетонов. Механизм AN. Медико-биологическое значение важнейших представителей. |
|
6. |
Строение, свойства и медико-биологическое значение карбоновых кислот (стр. 51). |
|
7. |
Химические свойства карбоновых кислот. |
| |
| |
| |
|
8. |
Строение, свойства и медико-биологическое значение гетерофункциональных соединений: гидрокси-, альдегидо-, кето-, фенолокислот (стр. 52). Оптическая активность яблочной и молочной кислот. |
Выполнить тестовые задания (письменно):
|
|
|
Укажите, какие кислоты с относительно одинаковой структурой радикала являются самыми слабыми в этом ряду: |
|
|
А |
-СН-кислоты |
|
|
Б |
-NH-кислоты |
|
|
В |
-OH-кислоты |
|
|
Г |
-SH-кислоты |
|
|
|
|
|
|
|
Какое из этих веществ обладает более сильными кислотными свойствами: этанол, этиламин, хлоруксусная кислота, этановая кислота. |
|
|
А |
этанол; |
|
|
Б |
этиламин; |
|
|
В |
этановая кислота; |
|
|
Г |
хлоруксусная кислота. |
|
|
|
|
|
|
|
Расположить вещества в порядке увеличения основных свойств: аммиак, анилин, этиламин, диметиламин. |
|
|
А |
анилин, аммиак, этиламин, диметиламин |
|
|
Б |
аммиак, анилин, этиламин, диметиламин |
|
|
В |
аммиак, этиламин, диметиламин, анилин |
|
|
Г |
диметиламин, этиламин, аммиак, анилин |
|
|
|
|
|
|
|
К какому типу реакций относится реакция взаимодействия этанола с пропанолом-1. Назвать продукт. |
|
|
А |
пентан, SЕ |
|
|
Б |
пропилэтиловый эфир, SN |
|
|
В |
пропилацетат, АN |
|
|
Г |
пентанон-2, SN |
|
|
|
|
|
|
|
К какому типу относится реакция взаимодействия трет-бутилового спирта сHBr: |
|
|
А |
AN; |
|
|
Б |
SN; |
|
|
В |
SЕ; |
|
|
Г |
SR; |
|
|
|
|
|
|
|
Указать название продукта реакции
|
|
|
А |
пентаналь |
|
|
Б |
пентанон-2 |
|
|
В |
пентановая кислота |
|
|
Г |
пентанон-3 |
|
|
|
|
|
|
|
К какому типу реакций относится реакция взаимодействия этаналя с бутанолом, назвать продукт: |
|
|
А |
пропилацетат, AN |
|
|
Б |
пропилэтиловый эфир, SN |
|
|
В |
бутоксиэтанол, AN |
|
|
Г |
этилпропионат, SN |
|
|
|
|
|
|
|
Назвать продукт реакции:
|
|
|
А |
бутанол-2 |
|
|
Б |
2-метилпропанол-1 |
|
|
В |
ацетон |
|
|
Г |
2-метилпропановая кислота |
|
|
|
|
|
9. |
|
Используя значения рКа, укажите самую сильную кислоту: |
|
|
А |
рКа (пропионовой кислоты) = 4,87 |
|
|
Б |
рКа (бензойной кислоты) = 4,19 |
|
|
В |
рКа (муравьиной кислоты) = 3,75 |
|
|
Г |
рКа (щавелевой кислоты) = 1,27 |
|
|
|
|
|
10. |
|
Какая из реакций доказывает наличие в карбоксильной группе подвижного атома водорода? |
|
|
А |
реакция этерификации |
|
|
Б |
реакция нейтрализации |
|
|
В |
реакция хлорирования |
|
|
Г |
реакция гидрирования |
|
|
|
|
|
11. |
|
Назовите вещество, получаемое в результате реакции уксусной кислоты с пропанолом-1. Укажите механизм реакции. |
|
|
А |
этилпропионат, SN |
|
|
Б |
пропилформиат, SE |
|
|
В |
пропилацетат, SN |
|
|
Г |
этилбутаноат, SR |
|
|
|
|
|
12. |
|
Какая из кислот взаимодействует с газообразным хлором на свету? |
|
|
А |
угольная кислота |
|
|
Б |
уксусная кислота |
|
|
В |
щавелевая кислота |
|
|
Г |
муравьиная кислота |
|
|
|
|
|
13. |
|
Какое из веществ подвергается гидролизу? |
|
|
А |
этилацетат |
|
|
Б |
этан |
|
|
В |
этандиол |
|
|
Г |
этановая кислота |
|
|
|
|
|
14. |
|
Дайте название
кислоте по тривиальной номенклатуре:
|
|
|
А |
масляная |
|
|
Б |
адипиновая |
|
|
В |
янтарная |
|
|
Г |
глутаровая |
|
|
|
|
|
15. |
|
Как называются соли щавелевой кислоты? |
|
|
А |
формиаты |
|
|
Б |
сукцинаты |
|
|
В |
оксалаты |
|
|
Г |
ацетаты |
|
|
|
|
|
16. |
|
Дайте название карбоновой кислоте:
|
|
|
А |
п-аминобензойная кислота |
|
|
Б |
ацетилсалициловая кислота |
|
|
В |
салициловая кислота |
|
|
Г |
бензойная кислота |
|
|
|
|
|
17. |
|
Дайте название карбоновой кислоте:
|
|
|
А |
2-гидроксибутановая кислота |
|
|
Б |
α-гидроксимасляная кислота |
|
|
В |
3-гидроксибутановая кислота |
|
|
Г |
3-гидроксибутандиовая кислота |
|
|
|
|
|
18. |
|
Дайте название карбоновой кислоте:
|
|
|
А |
2-гидроксипентановая кислота |
|
|
Б |
2-оксопентандиовая кислота |
|
|
В |
4-оксопентандиовая кислота |
|
|
Г |
2-оксопентановая кислота |
|
19. |
|
Укажите название солей яблочной кислоты: |
|
|
А |
лактаты |
|
|
Б |
сукцинаты |
|
|
В |
пируваты |
|
|
Г |
малаты |
|
|
|
|
|
20. |
|
К какому типу реакций относится реакция взаимодействия ацетоуксусной кислоты с этанолом? Назвать продукт:
|
|
|
А |
SN, этилпируват |
|
|
Б |
AE, бутилацетат |
|
|
В |
SE, этилацетоацетат |
|
|
Г |
SN, этилацетоацетат |
Задания для самостоятельного решения (выполнить письменно):
1)Указать кислотные центры и расположить их в порядке уменьшения кислотности в молекулеп-аминосалициловой кислоты.
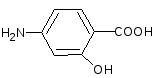
2) Сравнить кислотность двух наркотических средств – этанола и нарколана (2,2,2-трибромэтанол).
3) Фенол взаимодействует с гидроксидом натрия, а пропанол-1 – нет. Дать объяснение различию в кислотности и написать уравнение реакции.
4) Написать уравнение реакции получения полуацеталя из этилового спирта и пропионового альдегида. Назвать продукт. Указать механизм реакции.
5)Объяснить, почему карбоновые кислотыRCOOHимеют более высокие температуры кипения и плавления, чем соответствующие спиртыRCH2OH.
6)БензилбензоатC6H5-СООСH2C6H5– средство, применяемое против чесотки. Написать уравнение реакции кислотного гидролиза этого вещества. Назвать продукты реакции. Указать механизм реакции.
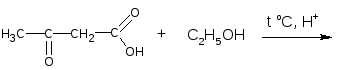
7) Осуществить цепочку превращений и назвать вещества:
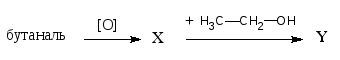
Указать механизм последней реакции.
8) Осуществить цепочку превращений и назвать вещества:

9) Осуществить цепочку превращений, назвать вещества и указать биологическую роль участников реакций:
[O] -CO2
β-гидроксимасляная кислота → X → Y
4. Тематика рефератов по учебно-исследовательской работе студентов (уирс).
|
1. |
Медико-биологическая характеристика и применение одноатомных (метанола, этанола) и многоатомных (этиленгликоля, глицерина, ксилита, сорбита) спиртов. |
|
2. |
Биогенные амины: адреналин, норадреналин, дофамин, триптамин, серотонин как гормоны и нейромедиаторы. |
|
3. |
Применение предельных монокарбоновых кислот и их производных в качестве лекарственных средств. |
|
4. |
Гетерофункциональные кислоты – участники цикла трикарбоновых кислот (цикл Кребса). |
Лабораторная работа: «Кислотно-основные свойства спиртов, фенолов, альдегидов, кетонов и карбоновых кислот».
1. Образование хелатного соединения глицерата меди.
В пробирку налить 2-3 мл раствора сульфата меди и добавить несколько капель NaOH. Появляется студенистый голубой осадок гидроксида меди.
К полученному осадку прилить 1 мл глицерина. Осадок растворяется. Раствор приобретает интенсивно синий цвет. Написать уравнения реакций.
2. Восстанавливающие свойства альдегидов.
А.Проба Толленса (реакция «серебряного зеркала»): к 0,5 мл азотнокислого серебра добавить 1 каплю раствора NaOH. Появляется бурый осадок, который растворяется при добавлении 1 мл NH4OH. К раствору добавить 1,5 мл формалина и нагреть. На стенке пробирки появляется налет серебра. Написать уравнение реакции.
Б.Проба Троммера.
К 0,5 мл 2н раствора сульфата меди добавить 1 мл 0,2 н раствора NaOH. К выпавшему осадку добавить 0,5 мл раствора формалина. Пробирку нагреть. Наблюдать изменение цвета от голубого до кирпично-красного. Написать уравнение реакции.
3. Реакция на ацетон (йодоформная проба).
К 1 мл раствора йода добавить 1 мл 2н раствора NaOH до обесцвечивания, добавить несколько капель ацетона. Наблюдать помутнение раствора (желтовато-белого цвета) с характерным запахом йодоформа.
4.Открытие щавелевой кислоты в виде кальциевой соли.
В пробирку поместить небольшое количество сухой щавелевой кислоты (1 шпатель) и прибавить по каплям дистиллированую воду до полного растворения. К полученному раствору добавить по каплям раствор хлорида кальция до выпадения осадка. Написать уравнение протекающей реакции.
5. Проба Уффельмана на молочную кислоту.
В пробирку налить 2 мл фенола и прибавить 1 каплю раствора FеСl3. Раствор окрашивается в фиолетовый цвет. Добавить к полученному раствору несколько капель молочной кислоты. Цвет раствора меняется на желто-зеленый.