
- •Тема. Титриметричні методи аналізу
- •Вибір індикатора
- •Криві титрування
- •1. Крива титрування сильної кислоти сильною основою
- •2. Крива титрування слабкої кислоти сильною основою
- •3. Крива титрування слабкої основи сильною кислотою
- •Заняття №6 Тема: Метод нейтралізації. Ацидиметрія. Алкаліметрія.
- •Заняття № Тема: Дослідження фізико-хімічних властивостей питної води. Твердість води.
- •Науково-дослідна робота студентів /ндрс/
- •Основні питання теми
3. Крива титрування слабкої основи сильною кислотою
Аналіз кривої титрування слабкої основи (водний розчин аміаку -ΝΗ3·Η2Ο) сильною кислотою показує, що точці еквівалентності, яка лежить у центрі стрибка, відповідає слабкокисле середовище (рН = 5,12). Це зумовлено гідролізом сульфату амонію. Стрибок титрування на кривій лежить в межах значень 4,0 — 6,24. І в цьому випадку, чим слабкіша основа, яку титрують, тим менший стрибок титрування. Оскільки розчини солей, утворених сильними основами та слабкими кислотами (Na2CO3, Na2B4O7 тощо), мають слабколужне середовище в зв'язку з їх гідролізом, то у випадку титрування таких солей сильними кислотами одержують аналогічні криві титрування.
Вибір індикатора для визначення кінця кислотно-основного титрування
Для правильного вибору індикатора приймають до уваги, з одного боку, стрибок титрування, з другого, - інтервал переходу індикатора. При цьому керуються тим принципом, що інтервал переходу індикатора повинен знаходитися в межах стрибка титрування. Тільки таким шляхом можна правильно встановити кінець титрування (точку еквівалентності).
Наприклад, при титруванні сильної кислоти сильною основою або навпаки (стрибок титрування - в межах рН 4 - 10) можна користуватися метиловим червоним (інтервал переходу - в межах рН 4,2 - 6,2) та фенолфталеїном (інтервал переходу - в межах рН 8 - 10). При титруванні слабкої кислоти сильною основою стрибок титрування, як правило, лежить у межах рН 8 - 10. Для даного випадку підійде фенолфталеїн (інтервал переходу - в межах рН 8 - 10). При титруванні сильною кислотою слабкої основи чи солі сильної основи і слабкої кислоти стрибок титрування, як правило, лежить в межах рН 4 — 6. У цьому випадку можна використати метиловий червоний. Титрування слабкої кислоти слабкою основою не проводяться, бо у цьому випадку практично відсутній стрибок титрування на кривій титрування.
ПЕРМАНГАНАТОМЕТРІЯ - окиснення відновників розчином перманганату калію.
Стандартний розчин – розчин перманганату калію, точна концентрація якого встановлюється за допомогою оксалату натрію. Найчастіше застосовується стандартний розчин C/1/5 КМпО4/=0,05 моль/л.
Перманганат калію застосовують для визначення багатьох неорганічних і органічних речовин. В кислих розчинах він відновлюється до йонів двовалентного мангану:
Mno-4+8H++5e Mn2++4H2O Eo=1,51 B
В слабокислих, нейтральних і слабо лужних розчинах відновлення відбувається до оксиду мангалу (ІУ):
MnO-4+2H2O+3e=MnO2+4OH- Eo=0,6 B
В сильно лужних розчинах реакція проходить з утворенням манганат-йонів.
MnO-4+e=MnO2-4 Eo=0/56 B
Найчастіше застосовують титрування КмпО4 в кислому середовищі, поскільки окисно-відновний потенціал пари Eo MnO-4/Mn2+=+1?51 B виший ніж E MnO-4/MnO2=+0,6 B. Крім того, в кислому середовищі йони MnO-4 забарвленні в червоно-фіолетовий колір, а відновлені катіони Mn2+ безбарвні. В цьому випадку КмпО4 є одночасно і індикатором реакції, бо за зміною власного забарвлення дозволяє встановити точку еквівалентності реакції.
Застосовують прямі і непрямі методи титрування.
Прямим титруванням визначають відновники, коли реакція протікає в кислому розчині при безпосередній взаємодії КМпО4 з відновником. Таким методом визначають багато неорганічних йонів в нижчих або середніх ступенях окислення, наприклад, йони: Fe2+, As3+, Sb3+, Sn2+, H2O2, VO2, Mo5+, U4+, Ti3+ і ін.
Метод оберненого титрування полягає в наступному: до досліджуваного розчину відновника доливають точно відміряний об’єм стандартного розчину відновника (взятого в надлишку), який здатний взаємодіяти з відновником і перманганатом калію. Проходить реакція взаємодії визначуваних йонів з відновником. Надлишок відновника титрують стандартним розчином перманганату калію. Знаючи всі кількості реагентів, за різницею визначають кількість окисника.
Методом зворотнього титрування визначають вміст йонів, які утворюють з відновником малорозчинні сполуки. Так можна визначити йони Ca2+, Sr2+, Ba2+, Zn2+, Co2+, La3+, Th4+, Ce3+, Ag+, Pb2+ і ін.
Багато органічних речовин окисляються перманганатом, наприклад, аліфатичні і ароматичні кислоти, оксикислоти, феноли і ін. Цей спосіб застосовують для визначення окиснюваності води і використовується для аналізу стічних вод.
Для встановлення кислого середовища при титруванні застосовують тільки розчин сульфатної кислоти. Застосувати HNO3 не можна, бо HNO3 теж сильний окисник і буде взаємодіяти з визначуваним відновником (результати будуть неточні).
Розчин HCl не використовують, тому що HCl може окислюватися розчином КмпО4 до Cl2. КМпО4 буде витрачатись не за призначенням і результати аналізу будуть неточні.
КОМПЛЕКСОНОМЕТРІЯ – це титриметричний метод аналізу, який застосовується на використанні реакцій йонів металів комплексоутворювачів з комплексонами, що супроводжується утворенням стійких малодисоційованих розчинних внутрікомплексних (клешневих) солей.
Стандартний розчин – розчин двонатрієвої солі етилендиамінтетраоцтової кислоти (ЕДТА), або інакше його називають комплексом Ш або трилон Б:
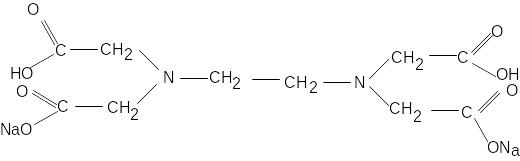
(скорочено Na2H2У)
ЕДТА утворює з багатьма катіонами металів стійкі, малодисоційовані, розчинні в воді внутрішньо комплексні солі, за рахунок здатності карбоксильних груп утворювати солі металів, підсилення ефектом виникнення координаційного (донорно-акцепторного) зв’язку між катіоном і вільною парою електронів атому азоту:
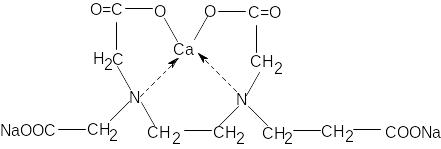
Утворені сполуки досить стійкі, відрізняються досить малими константами нестійкості комплексних йонів. Кнест.Ca+210-10, Кнест.Zn2+10-16.
Індикатори. Як індикатори при комплексонометричних титруваннях застосовують органічні барвники: кислотний хром темно-синій, кислотний хромоген чорний спеціальний (інакше називається еріохром чорний Т або хромоген спеціальний ЕТ ОО), мурексид, ксиленоловий оранжевий і ін. Їх ще називають метил-індикаторами.
Ці індикатори утворюють з йонами кальцію, магнію і інших забарвлені внутрішньо комплексні сполуки. Ці комплексні сполуки менш стійкі , ніж комплекси з ЕДТА, а тому можуть розкладатись, переходячи до більш стійкого комплексу, утворюючи вільний індикатор, який має інший, ніж комплекс, колір.
Еріохром чорний Т – це органічний азобарвник групи о,-о –диоксіазонафталіну:
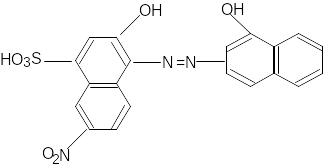 (H3Ind)
(H3Ind)
Сам індикатор забарвлений у синій колір. В нейтральному або лужному середовищі (pH-711) цей індикатор утворює з йонами металів (Ca+2, Mg+2, Zn+2, Mn+2, Al+3 і ін.) сполуки червоного кольору.
Мурексид (пурпурат амонію)
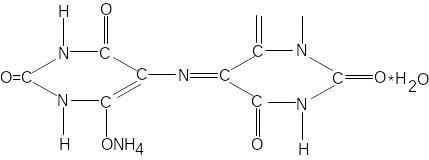
це темно-вишневий порошок. В воді має фіолетово-червоний колір, який залежить від pH середовища. З катіонами кальцію, кобальту, нікелю, міді і інших цей індикатор утворює комплексні розчинні в воді сполуки червоного або жовтого кольору.
Фіксація точки еквівалентності відбувається при застосуванні метал-індикаорів, які утворюють з катіонами визначуваних елементів розчинні в воді забарвлені комплексні сполуки. Ці комплексні сполуки менш стійкі, ніж сполуки з комплексонами, які застосовуються як стандартний розчин. Тому в процесі титрування комплексоном розчину, що містить забарвлену метал-індикатором комплексну сполуку, в точці еквівалентності спостерігається зміна кольору.
Таким чином метал-індикатор реагує на зміну концентрації катіону аналогічно як кислотно-основний індикатор реагує на зміну pH-розчину.
Умови комплексонометричного титрування:
Необхідність строгого дотримання pHрозчину.
В сильно кислих розчинах з pH3 утворюється менш стійкі кислі комплексні сполуки. В сильно лужних розчинах при pH10 утворюються комплексні оксісполуки або осади гідроксидів визначуваних катіонів.
Крім того, в процесі титрування звільнюються Йони водню і pH понижується, що приводить до зміни pH. Тому дуже важливо створювати умови, при яких pH не міняється. Це можна зробити за допомогою буферного розчину.
Титрування більшості катіонів проводять при pH=89 в аміачному буферному розчині (NH3+NH4).
