
- •Тема. Титриметричні методи аналізу
- •Вибір індикатора
- •Криві титрування
- •1. Крива титрування сильної кислоти сильною основою
- •2. Крива титрування слабкої кислоти сильною основою
- •3. Крива титрування слабкої основи сильною кислотою
- •Заняття №6 Тема: Метод нейтралізації. Ацидиметрія. Алкаліметрія.
- •Заняття № Тема: Дослідження фізико-хімічних властивостей питної води. Твердість води.
- •Науково-дослідна робота студентів /ндрс/
- •Основні питання теми
Криві титрування
У процесі кислотно-основного титрування відбувається безперервна зміна рН розчину. КРИВА ТИТРУВАННЯ - графічне зображення зміни рН розчину в процесі його титрування.
Розглянемо деякі типи кривих титрування в методі нейтралізації.
1. Крива титрування сильної кислоти сильною основою
Нехай титрують розчин сірчаної кислоти (с(Н2SО4)=0,1моль/л) розчином лугу (c(NaOH) = 0,1моль/л). У процесі титрування (нейтралізації) концентрація водневих іонів (а також рН середовища) змінюється:
До початку титрування концентрація водневих іонів у розчині сірчаної кислоти дорівнює 0,1(10-1) моль/л. Отже, рН цього розчину 1.
Коли 90% початкової кількості еквівалента цієї кислоти буде відтитровано, Н+ іонів залишиться 10% (0,1) від початкової кількості, тобто 0,1 моль/л-0,1 = 10-2моль/л, рН розчину в цей момент дорівнює 2.
При нейтралізації 99% початкової кількості еквівалента сірчаної кислоти концентрація іонів Н+ зменшиться до 0,1моль/л-0,01 = 10~"'моль/л; це відповідає значенню рН = 3.
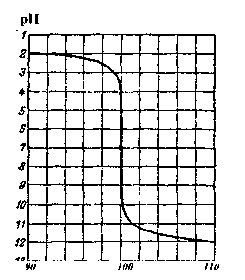
Подібним чином знаходять, що при нейтралізації 99,9% початкової кількості еквівалента кислоти у розчині залишається всього лише 0,1моль/л-0,001 = 10-4моль/л іонів водню, а рН розчину збільшується до 4. У момент повної нейтралізації H2SO4 концентрація іонів водню стає рівною 10-7 моль/л, а рН = 7. Додавання до титрованого розчину надлишку лугу веде до збільшення рН розчину. Після додавання надлишку (0,1%) розчину лугу (c(NaOH) = 0,1 моль/л) молярна концентрація іонів гідроксиду буде рівною 0,1моль/л-0,001 = 10-4моль/л (рОН = 4), а рН = 14 - 4 = 10. При додаванні надлишку (1%) розчину їдкого натру (c(NaOH) = 0,1 моль/л) концентрація іонів ОН" збільшиться в 10 разів: с(ОН~) = 0,1 моль/л·0,01 = 10^моль/л (рОН = 3), а рН = 14 - 3 = 11; і, нарешті, після додавання надлишку лугу (10%) (c(NaOH) = 0,1 моль/л) концентрація іонів ОН" збільшиться до с(ОНГ) = 0,1 моль/л-0,1 = 10~2моль/л(рОН = 2), арН = 14-2= 12.
Рис.1. Крива титрування сильної кислоти лугом.
Аналіз кривої титрування показує, що спочатку рН розчину змінюється поступово, а поблизу точки еквівалентності - дуже швидко, а потім знову поступово. Особливо різко змінюється рН в інтервалі, коли залишилось 0,1% еквівалентної кількості недо-титрованої H2SO4 (рН = 4) і коли додано 0,1% надлишку від еквівалентної кількості лугу(рН= 10).
СТРИБОК ТИТРУВАННЯ - різка зміна рН розчину, що спостерігається поблизу точки еквівалентності, тобто в кінці титрування. Стрибок рН на кривій титрування в даному випадку лежить в межах 4 - 10. Необхідно зауважити, що чим менша концентрація титрованого розчину, тим менший стрибок титрування. Така різка зміна рН розчину, що титрують, відбувається практично при додаванні однієї краплі титрованого (робочого) розчину. Точці еквівалентності у цьому випадку відповідає нейтральне середовище (рН = 7), тому що в цей момент у розчині знаходиться лише сіль Na2SO4, яка не гідролізує.
2. Крива титрування слабкої кислоти сильною основою
У цьому випадку тільки незначна частка молекул дисоціює з утворенням іонів Н+. Для обчислення рН розчинів використовують константу дисоціації відповідної слабкої кислоти.
П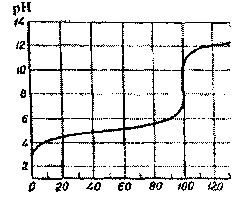 риводимо
лише аналіз кривої титрування слабкої
оцтової кислоти сильною основою.
З рис.2 витікає, що точці еквівалентності,
яка лежить у центрі стрибка титрування
розчину оцтової кислоти розчином лугу,
відповідає слабколужне середовище
(рН = 8,87). Це
зумовлено гідролізом ацетату натрію
CH3COONa,
що утворився в результаті титрування:
СН3СОО‾
+ Н2О
↔
СН3СООН
+ ОН‾. У цьому випадку стрибок титрування
лежить у межах значень рН 7,73 - 10.
Встановлено, що чим
слабкіша кислота, яку титрують, тим
менший стрибок титрування.
риводимо
лише аналіз кривої титрування слабкої
оцтової кислоти сильною основою.
З рис.2 витікає, що точці еквівалентності,
яка лежить у центрі стрибка титрування
розчину оцтової кислоти розчином лугу,
відповідає слабколужне середовище
(рН = 8,87). Це
зумовлено гідролізом ацетату натрію
CH3COONa,
що утворився в результаті титрування:
СН3СОО‾
+ Н2О
↔
СН3СООН
+ ОН‾. У цьому випадку стрибок титрування
лежить у межах значень рН 7,73 - 10.
Встановлено, що чим
слабкіша кислота, яку титрують, тим
менший стрибок титрування.
Рис.2. Крива титрування слабкої кислоти лугом.
