
- •Окисно-відновні реакції
- •Окисно-відновні реакції як процес перенесення електронів та зміни ступенів окиснення елементів
- •2. Найважливіші окисники та відновники
- •3. Класифікація окисно-відновних реакцій
- •2. Реакції диспропорціонування (самоокиснення-самовідновлення).
- •4. Методи підбору коефіцієнтів до окисно-відновних реакцій
- •5. Лабораторна робота Перманганатометричне титрування
- •Приготування стандартного розчину оксалатної кислоти (або нат-рій оксалату). Відомо, що калій перманганат взаємодіє в кислому середо-вищі з оксалатною кислотою:
- •Стандартизація розчину калій перманганату по оксалатній кислоті. Взяти чисту бюретку з краном, промити розчином калій перман-ганату і підготовити її до титрування.
- •Лабораторна робота Йодометричне титрування
- •Йодометричне визначення окисників та відновників. Титрування по заміщенню
- •Індикатор йодометричного титрування
- •Визначення вмісту Купруму(іі) у розчині. Йодометричне титрування застосовують для визначення Купруму(іі) в пестицидах, які містять мідь; за точністю воно не поступається електрохімічному визначенню.
- •6. Контрольні запитання
3. Класифікація окисно-відновних реакцій
Усі окисно-відновні реакції можна поділити на три типи.
1. Реакції міжатомного або міжмолекулярного окиснення-віднов-лення. До них належать такі реакції, в яких обмін електронами відбува-ється між різними атомами, молекулами або іонами. Наприклад:
![]() .
.
2. Реакції диспропорціонування (самоокиснення-самовідновлення).
У таких реакціях прості і складні речовини можуть виявити як окисні, так і відновні властивості. Це можливо внаслідок того, що атоми з проміжним ступенем окиснення віддають і приймають електрони. Наприклад, в реакції
![]()
N3+ відіграє роль як окисника, так і відновника.
3. Реакції внутрішньомолекулярного окиснення-відновлення. До них належать реакції, в яких і окисник і відновник входять до складу тієї ж ре-човини (молекули):
![]()
4. Методи підбору коефіцієнтів до окисно-відновних реакцій
При складанні рівнянь окисно-відновних реакцій важливо правильно дібрати коефіцієнти. При цьому застосовують два методи:
– метод електронного балансу, що ґрунтується на визначенні загальної кількості електронів, які переміщуються від відновника до окисника;
– іонно-електронний метод, при якому окремо складаються іонні рів-няння для процесу окиснення і для процесу відновлення з наступним під-сумовуванням їх – загальне іонне рівняння.
Метод електронного балансу – найпростіший метод. Розглянемо послідовність добору коефіцієнтів цим методом.
Пишемо схему реакції з участю всіх вихідних речовин і продуктів реакції:
Cu + HNO3 Cu(NO3)2 + NO + H2O.
Знаходимо ступені окиснення і пишемо їх над символами елементів, що змінюють під час реакції валентний стан:
![]()
3. Складаємо електронні рівняння:
![]()
![]()
4. Знаходимо найменше кратне для чисел 2 і 3. Воно дорівнює 6.
5. Знаходимо коефіцієнти (додаткові множники) для Сu0, Cu+2, N+5, N+2:
-
3

2
6. Підсумуємо ліві і праві частини електронних рівнянь з урахуванням додаткових множників:
-
3
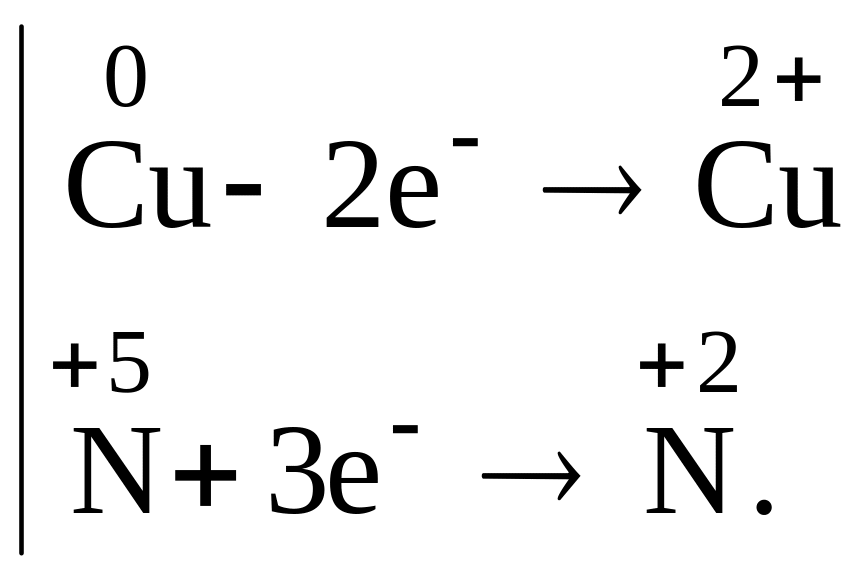
2
![]()

7. Підставляємо всі знайдені коефіцієнти в рівняння реакції:
3Cu + 8HNO3 3Cu(NO3)2 + 2NO + 4H2O.
Іонно-електронний метод. Метод електронного балансу придатний не для усіх окисно-відновних реакцій. Більш універсальним способом добору коефіцієнтів є іонно-електронний спосіб. Коефіцієнти іонно-електронних рівнянь добирають за зміною зарядності простих і складних речовин.
I. Порядок знаходження коефіцієнтів у рівняннях окисно-відновних реакцій, у лівій частині яких є молекули кислоти.
1. Записуємо схему реакції в молекулярній формі:
![]() +
KNO2
+ H2SO4
+
KNO2
+ H2SO4
![]() +
NO + K2SO4
+ H2O.
+
NO + K2SO4
+ H2O.
2. Записуємо схему реакції в іонній формі. Формули слабких електро-літів, газів, осадів пишемо в молекулярній формі:
![]()
3. Записуємо схему реакції в скороченому іонному вигляді:
![]() +
+
![]() + 2H+
+ NO + H2O.
+ 2H+
+ NO + H2O.
4. Записуємо іони, що зазнали зміни:
![]()
![]()
5. Складаємо кількісний баланс:
![]()
Складаємо якісний баланс:
![]()
При надлишку атомів Оксигену в лівій частині схеми в праву частину вводимо відповідну кількість молекул води. При цьому для утворення двох молекул води необхідно і у ліву частину схеми ввести додатково гідроген-іони, потрібні для утворення цих молекул води.
7. Складаємо баланс за зарядами іонів, додаючи потрібне число елек-тронів у лівій частині рівняння:
![]()
![]()
8. Знаходимо найменше спільне кратне для чисел 2 і 3:
3
![]()
2
![]()
9. Підсумуємо ліві і праві частини іонно-електронного балансу з ураху-ванням додаткових множників:
![]()
10. Коефіцієнти з іонного рівняння переносимо в схему реакції:
6KJ + 2KNO2 + 4H2SO4 3J2 + 2NO + 4K2SO4 + 4H2O.
II. Коефіцієнти рівнянь окисно-відновних реакцій, у лівій частині яких є молекули основ, визначають у такому самому порядку, як описано вище. Відмінність полягає лише в тому, що коли всі вихідні сполуки містять меншу кількість атомів Оксигену, ніж продукти реакції, то нестача кіль-кості їх у лужному середовищі поповнюється за рахунок іонів ОН-, в правій частині схеми утворюватиметься вода. Наприклад:
1. Записуємо схему реакції в молекулярній формі:
NaCrO2 + Br2 + NaOH Na2CrO4 + NaBr + H2O.
2. Записуємо схему реакції в іонній формі. Формули слабких електро-літів, осадів пишемо в молекулярній формі:
![]()
3. Записуємо схему реакції в скороченому іонному вигляді:
![]() .
.![]()
4.
Записуємо іони, що зазнали зміни, та
складаємо якісний і кількісний баланси.
Оскільки в лівій частині не вистачає
двох атомів Оксигену, вводять подвоєну
кількість груп
![]() ,
а в праву частину дві молекули води:
,
а в праву частину дві молекули води:
-
2
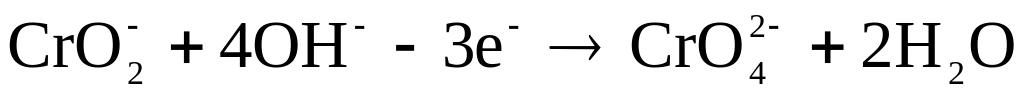

3

![]()
![]()
III. Знаходження коефіцієнтів рівнянь окисно-відновних реакцій, у лівій частині яких є молекули води. Спосіб добору коефіцієнтів залежить від того, що утворюється в результаті реакції. Якщо в продуктах реакції є кислота, то коефіцієнти добирають за способом I, якщо в результаті реакції утворюється основа, тоді – за способом II.
