
- •1. Кинематика частицы (основные понятия кинематики, прямолинейное и криволинейное движение).
- •2. Инерциальные системы отсчета. Законы Ньютона и границы их применимости. Механический принцип относительности.
- •3. Законы сохранения в нерелятивистской механике.
- •4. Закон всемирного тяготения. Гравитационное поле.
- •5. Механические колебания. Свободные, затухающие и вынужденные колебания линейного осциллятора.
- •6. Неинерциальные системы отсчета. Силы инерции в системах, движущихся поступательно и во вращающихся системах отсчета.
- •7. Мкт. Основное уравнение кинетической теории газов. Газовые законы. Уравнение Менделеева-Клапейрона.
- •8. Явления переноса в газах.
- •9.Внутренняя энергия. Теплота. Работа. Первый закон термодинамики. Второй закон термодинамики.
- •11. Равновесие фаз, фазовые переходы. Уравнения Клапейрона-Клаузиуса.
- •12. Взаимодействие неподвижных зарядов. Электростатическое поле и его характеристики.
- •13. Электрическое поле в проводниках и диэлектриках. Поляризация диэлектриков.
- •14. Постоянный электрический ток. Классическая теория электропроводности металлов.
- •15. Магнитное поле в вакууме. Взаимодействие токов. Сила Ампера. Сила Лоренца.
- •16. Магнитное поле в веществе. Диа-, пара- и ферромагнетизм
- •17. Явление электромагнитной индукции, опыты Фарадея.
7. Мкт. Основное уравнение кинетической теории газов. Газовые законы. Уравнение Менделеева-Клапейрона.
Основным уравнением кинетической теории газов называется соотношение, связывающее давление (величину, измеряемую на опыте) со скоростью или кинетической энергией молекулы идеального газа.
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Скорости частиц как по модулю, так и по направлению могут быть любыми, изменение их происходит непрерывно.
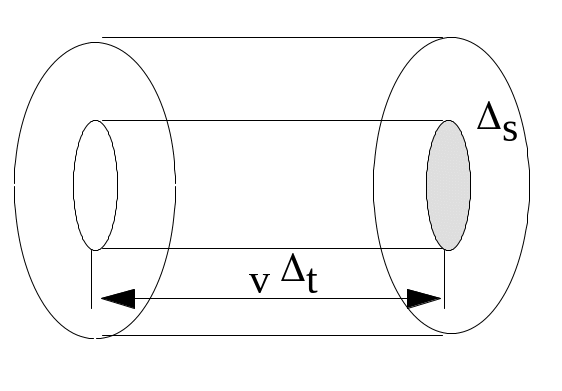
где
т0
— масса
молекулы, v –
ее скорость. За время t
площадки s
достигнут только те молекулы, которые
заключены в объеме цилиндра с основанием
s
и высотой vt.
Число этих молекул равно ns
vt,
где п –
концентрация молекул. Для упрощения
расчетов хаотическое движение молекул
заменяют движением вдоль трех взаимно
перпендикулярных направлений, так что
в любой момент времени вдоль каждого
из них движется 1/3 молекул, причем
половина из них (1/6) движется вдоль
данного направления в одну сторону,
половина – в противоположную. Тогда
число ударов молекул, движущихся в
заданном направлении, о площадку s
будет
![]() .
При столкновении с площадкой эти молекулы
передадут ей импульс:
.
При столкновении с площадкой эти молекулы
передадут ей импульс:
![]()
![]() .
.
Тогда
давление газа на стенку сосуда:![]() (1)
(1)
Если
газ в объеме V
содержит N
молекул, движущихся со скоростями v1,
v2.,
то учитывают среднюю квадратичную
скорость:
![]() (2), характеризующую всю
совокупность молекул газа. Уравнение
(1) с учетом (2) примет вид
(2), характеризующую всю
совокупность молекул газа. Уравнение
(1) с учетом (2) примет вид
![]() .
(3)
.
(3)
Данное выражение называется основным уравнением молекулярно-кинетической теории идеальных газов. Оно устанавливает связь между давлением и среднеквадратичной скоростью.
Введем
Е
![]() – среднюю кинетическую энергию
хаотического поступательного движения
одной молекулы, тогда основное уравнение
запишется как:
– среднюю кинетическую энергию
хаотического поступательного движения
одной молекулы, тогда основное уравнение
запишется как:
![]() или
или
![]() Е.
Е.
Здесь
давление связано со средней энергией
поступательного движения молекул. При
переходе к равновесию от одной части
газа к другой передается энергия.
Выравнивается не энергия всего газа
как целого, а средняя кинетическая
энергия, отнесенная к одной молекуле.
Температура газа пропорциональна
средней кинетической энергии его
молекул: Т
Е.
Средняя кинетическая энергия
поступательного движения молекулы
Е
=![]() ,
(4)
,
(4)
где k - постоянная Больцмана, : k=1,38.10-23 Дж/К, Т – температура, выраженная в кельвинах. Из формулы (4) следует, что абсолютная температура является мерой средней кинетической энергии поступательного хаотического движения молекул. Подставляя в (3) это выражение, получим, что давление идеального газа связано с температурой соотношением:
![]() .
.
Давление определяется только концентрацией (при постоянной температуре) и не зависит от сорта молекул.
Газовые законы устанавливают связь между двумя параметрами состояния при постоянном третьем параметре для данной массы газа.
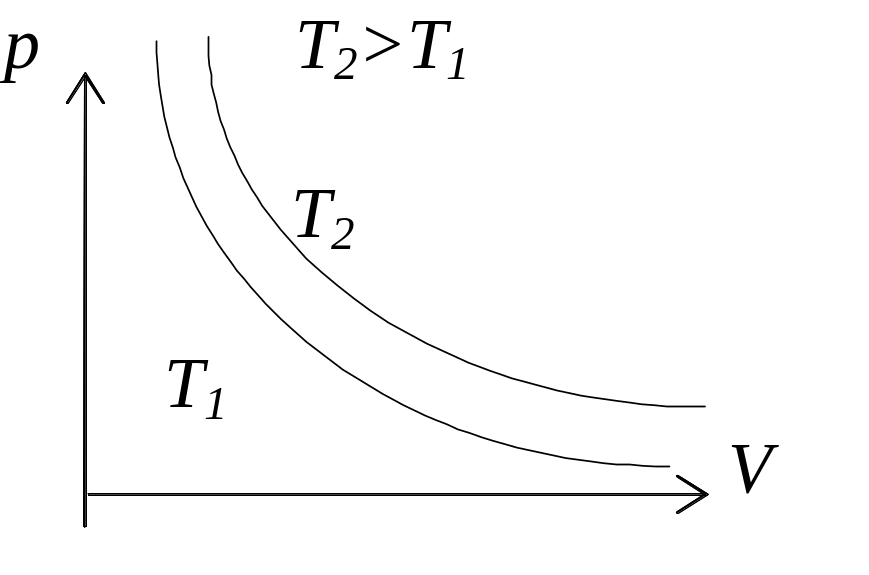
1. Изотермический процесс. pV=const – уравнение изотермы.
Чем выше изотерма, тем более высокой температуре она соответствует, T2>T1.
2.
Изобарный процесс.
![]() – уравнение изобары. Чем ниже к оси
температуры наклонена изобара, тем
большему давлению она соответствует,
р2 >
p1.
– уравнение изобары. Чем ниже к оси
температуры наклонена изобара, тем
большему давлению она соответствует,
р2 >
p1.

3.
Изохорический процесс.
![]() – уравнение изохоры. График зависимости
р
от Т
изображен на рис 7.3. Чем ниже к оси
температуры наклонена изохора, тем
большему объему она соответствует, V2
> V1.
– уравнение изохоры. График зависимости
р
от Т
изображен на рис 7.3. Чем ниже к оси
температуры наклонена изохора, тем
большему объему она соответствует, V2
> V1.
Комбинируя
выражения газовых законов, получим
уравнение, связывающее р, V,
Т (объединенный газовый закон):
![]() .
.
Постоянная
в этом уравнении определяется
экспериментально. Для количества
вещества 1 моль
газа она оказалась равной R=8,31
![]() и была названа универсальной газовой
постоянной.
и была названа универсальной газовой
постоянной.
1
моль равен
количеству вещества системы, содержащей
столько же структурных элементов,
сколько содержится атомов в углероде-12
массой 0,012 кг. Число молекул (структурных
единиц) в 1 моле
равно числу Авогадро: NA=6,02.1023моль-1.
Для R
справедливо соотношение: R=k
NA.
Итак, для одного моля:
![]() .
Для произвольного количества газа
=m/(
- молярная масса газа.):
.
Для произвольного количества газа
=m/(
- молярная масса газа.):
![]() ,
,
уравнение Менделеева-Клапейрона.
