
- •Классификация органических соединений. Сопряженные системы, электронные эффекты.
- •Классификация органических соединений.
- •Ковалентные связи.
- •Индуктивный эффект.
- •Сопряженные системы. Сопряжение.
- •Открытые сопряженные системы.
- •Типы сопряжения.
- •Замкнутые сопряженные системы.
- •Критерии ароматичности.
- •Ароматичность гетероциклов.
- •Мезомерный эффект
- •Виниловый спирт фенол
- •Электронодонорные (эд) и электроноакцепторные (эа) заместители.
Типы сопряжения.
Существуют два типа сопряжения: π,π– и р,π– сопряжение.
В π,π– сопряженной системе в сопряжении участвует две или более π – связи. π,π– сопряженная система может включать гетероатом (О, N). Бутадиен – 1,3, пропеналь – это π,π – сопряженная системы.
CH2=CH–CH=CH2 CH2=CH–CH=O
бутадиен–1,3 пропеналь
В р,π– сопряженной системе π – связь должна быть отделена одной одинарной от р-негибридной орбитали гетероатомом (О,N).
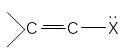
![]()
где
Р-орбиталь гетероатома сопряжена с орбиталями π-связи.
Представители р, π – сопряженных систем:
![]()
![]() виниловый эфир
виниловый эфир
 винилхлорид
винилхлорид
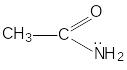
амид
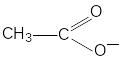
карбоксилат – ион
![]()
![]() Сопряжение
может существовать не только в нейтральных
молекулах, но в ионах и радикалах.
Сопряжение
может существовать не только в нейтральных
молекулах, но в ионах и радикалах.
радикал анион
Сопряжение – энергетически выгодный процесс, поэтому делокализация электронной плотности сопровождается выделением энергии. Система переходит на более низкий энергетический уровень и становится более устойчивой.
Энергия, которая выделяется за счет сопряжения, называется энергией сопряжения (ΔЕ).
Чем длиннее цепь сопряжения, тем больше ΔЕ, тем устойчивее система.
Вещества, содержащие большую цепь сопряжения, называются полиены. Они очень устойчивы. К полиенам, например, относится витамин А.
 Есис. Ен
– энергия идеальной, несуществующей
Есис. Ен
– энергия идеальной, несуществующей

 Ен системы.
Ен системы.
ΔЕ Ес – энергия с.с.
Ес ΔЕ = Ен – Ес

Замкнутые сопряженные системы.
К замкнутым сопряженным системам относится бензол, его производные, гетероциклические и конденсированные соединения. Рассмотрим бензол, С6Н6.
σ
|
В молекуле бензола шесть атомов С находятся в sp2-гибридизации, каждый атом С образует 3- σ–связи, лежащие в одной плоскости, поэтому молекула бензола имеет плоское строение. Шесть р-негибридных орбиталей атомов С расположены параллельно друг другу и перпендикулярно плоскости кольца. |
Каждая р-орбиталь в равной степени перекрывается с р-орбиталями соседних атомов. Наблюдается сопряжение, возникает единое замкнутое π – электронное облако, которое охватывает все шесть атомов С.
Такая замкнутая с. система называется ароматической. Вследствие выравнивания электронной плотности происходит выравнивание длин связей, в бензоле все связи С–С имеют длину 0,140 нм.
Энергия сопряжения замкнутых сопряженных систем намного больше, чем энергия сопряжения открытых сопряженных систем с тем же числом π-связей, поэтому бензол очень устойчивая система.
ΔЕбутадиена = 15 кДж/моль ΔЕс6н6 = 228 кДж/моль
Критерии ароматичности.
Система будет ароматической, если она обладает следующими признаками:
Молекула имеет циклическое строение.
Все атомы углерода находятся в sp2 –гибридизированном состоянии, из этого следует, что молекула имеет плоское строение.
Единое замкнутое π-электронное облако содержит (4n+2) π-электронов (правило Хюккеля), где n=1,2,3,4,……
Например:
n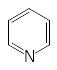
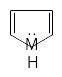
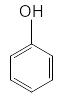 =1
Число π-электронов = 6, к таким ароматическим
соединениям относятся:
=1
Число π-электронов = 6, к таким ароматическим
соединениям относятся:
бензол пиридин пиррол фенол
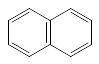 n=2
число π-электронов =10
n=2
число π-электронов =10
 нафталин
нафталин
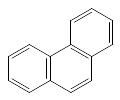
n=3 число π-электронов = 14
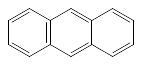
антрацен фенантрен

 σ
σ
σ
σ