
- •Механизмы реакций.
- •Механизм реакции радикального замещентия (sr)
- •Sr in vivo (в организме) пероксидное окисление липидов (пол). Липиды – компоненты клеточных мембран. В результате пол: изменения в обмене веществ, образование канцерогенных соединений. Механизм пол:
- •Механизм реакции электрофильного присоединения (ае)
- •Механизм реакции
- •Механизм реакции электрофильного замещения (sе)
- •Ориентирующее действие заместителей в бензольном ядре.
Лекция № 2.
Механизмы реакций.
Химическая реакция – процесс превращения исходных веществ в продукты реакции. Реакция проходит через несколько стадий. Механизм реакции – подробное описание этих стадий.
Классификация реакций:
I тип: по конечному продукту реакции:
Замещение – substitution (S)
A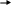 –B+C
A–C+B
–B+C
A–C+B
П


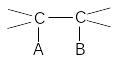 рисоединение
– addition
(А)
рисоединение
– addition
(А)
 С=С +А–В
С=С +А–В
О
 тщепление
– elimination (Е)
тщепление
– elimination (Е)
![]() +
A–B
+
A–B
II тип: по механизму
Р
 адикальные
– radical
(R)
: идут через радикальный (гомолитический)
разрыв связи
адикальные
– radical
(R)
: идут через радикальный (гомолитический)
разрыв связи
R
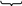 3C
X
R3C
• + •X
3C
X
R3C
• + •X
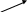

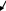
гомолиз связи радикалы – частицы с неспаренными электронами
Ионные реакции, идут через гетеролитический разрыв связи:

 Х
:У
Х+
+ :У–
Х
:У
Х+
+ :У–
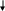
гетеролиз связи электрофил (Е+ ) нуклеофил (N–)
«любит электроны» «любит ядро»
Различают:
а) нуклеофильные – nucleophile (N) – реакции, например,
АN – нуклеофильное присоединение
SN – нуклеофильное замещение
б) электрофильные – electrophile (E) – реакции, например,
АЕ – электрофильное присоединение
SE - электрофильное замещение
Механизм реакции радикального замещентия (sr)
In vitro (вне организма) – галогенирование алканов.
Пример: хлорирование метана.
Свет (hν)
С хема
реакции : СН4
+ Сl2
СН3Cl
+ HCl
хема
реакции : СН4
+ Сl2
СН3Cl
+ HCl
хлорметан
Механизм реакции:
I стадия: инициирование, образование свободных радикалов
![]() hν
hν
C l Cl Cl • + • Cl
гомолиз связи
II. стадия: рост цепи
 H3C
H
+ • Cl
H3C
• + H
:
Cl эти
две реакции повторяются,
H3C
H
+ • Cl
H3C
• + H
:
Cl эти
две реакции повторяются,
м
 олекула
радикал радикал молекула пока
есть исходные вещества
олекула
радикал радикал молекула пока
есть исходные вещества
H 3C • + Cl Cl H3C : Cl + Cl •
радикал молекула молекула радикал
атакует следующую молекулу метана
III. обрыв цепи – встреча двух свободных радикалов:
C l • + • Cl Cl : Cl
H 3C • + • Cl H3C : Cl
H 3C • + • CH3 H3C : CH3
Sr in vivo (в организме) пероксидное окисление липидов (пол). Липиды – компоненты клеточных мембран. В результате пол: изменения в обмене веществ, образование канцерогенных соединений. Механизм пол:
первоначальное образование R •
F

 e2+
+ O2
+ H
Fe3+
+ HO
– O
•
X•
свободные радикалы
e2+
+ O2
+ H
Fe3+
+ HO
– O
•
X•
свободные радикалы
F e2+ +R–O–OH Fe3+ + HO– + RO •
инициирование
R : H + X • HX + R •
липид
рост цепи


R • + O2 R–O–O •
R –O–O + R H R–O–O–H + R •
обрыв цепи
R OO • + • R R–O–OR
Механизм реакции электрофильного присоединения (ае)
In vitro: присоединение к алкенам Hal2, HHal, H2O.
Б![]() ромирование
этилена
ромирование
этилена
Пример 1. СН2=СН2 +Br2 →
1,2–дибромэтан
Механизм реакции
I стадия. Поляризация молекулы галогена по действием π-связи алкена
 σ δ+ δ–
σ δ+ δ–
Н2С = СН2 Br → Br
π
и образование электрофила Е+
 δ+ δ–
δ+ δ–
Br → Br → Br+ + Br –
гетеролиз Е+
II стадия. Образование π-комплекса за счет вакантной орбитали электрофила и пары электронов в π-связи
С![]() Н2
СН2
Н2
СН2
Br+
I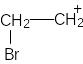 II
стадия.
Образование σ–комплекса (карбкатиона)
II
стадия.
Образование σ–комплекса (карбкатиона)
IV стадия. Присоединение Br – к карбкатиону, образование продукта реакции
![]() СН2
– СН2+
+ Br
–
→ CH2
– CH2
СН2
– СН2+
+ Br
–
→ CH2
– CH2
Присоединение HНal или H2O к несимметричным алкенам (R – CH=CH2)
идет по правилу Марковникова В.В.: Н присоединяется к наиболее, а Hal (или ОН–) к наименее гидрогенизированному атому С.
![]() R–CH=CH2
+ HHal → R–CH–CH3
R–CH=CH2
+ HHal → R–CH–CH3
![]() R–CH=CH2
+ H–ОН → R–CH–CH3
R–CH=CH2
+ H–ОН → R–CH–CH3
Пример 2. Присоединение бромоводорода к пропену
С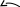 хема
реакции:
хема
реакции:
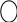
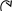
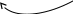 δ+ δ–
δ+ δ–
С
 Н3
→ СН=СН + Н+
→ Br
–
→ СН3–СН–СН3
Н3
→ СН=СН + Н+
→ Br
–
→ СН3–СН–СН3
2–бромпропан
С![]() Н3:
+I,
ЭД, СН3–СН2–СН2
Н3:
+I,
ЭД, СН3–СН2–СН2
↑ē плотность,
АЕ к пропену идет легче, чем с СН2=СН2
Механизм реакции (АЕ):
I стадия: Гетеролиз связи в реагенте, образование электрофила (Е+).
H → Br
→ H+
+ Br
–
→ Br
→ H+
+ Br
–
E+
II стадия: Образование π-комплекса за счет вакантной орбитали электрофила и пары электрона π-связи.
δ+ δ–
C![]() H3
→ CH CH2
H3
→ CH CH2
III стадия: Образование σ–комплекса (карбкатиона), причем новая σ–связь образуется между Е+ и атомом С с δ–.
С![]() Н3
– СН+
– СН2
Н3
– СН+
– СН2
IV стадия: Присоединение Br – к карбкатиону, образование продукта реакции
С Н3 – СН+ – СН3 + Br – → CH3 – CH – CH3
![]()
![]() Присоединение
Н2О
(гидратация) к алкенам идет с участием
кислого катализатора (Н+
кислоты играет роль Е+).
Присоединение
Н2О
(гидратация) к алкенам идет с участием
кислого катализатора (Н+
кислоты играет роль Е+).
С![]()
 Н3–СН=СН2
+ Н+
→ СН3–СН
СН2
→ СН3
– СН+
– СН2
+ →
Н3–СН=СН2
+ Н+
→ СН3–СН
СН2
→ СН3
– СН+
– СН2
+ →
катализатор
Е+ π-комплекс σ–комплекс вода
С![]()
![]() Н3
– СН – СН3
→ СН3
– СН – СН3
Н3
– СН – СН3
→ СН3
– СН – СН3
 –Н+-
регенерация
–Н+-
регенерация
катализатора
ион оксония пропанол–2, конечный продукт реакции
АЕ in vivo: гидратация непредельных соединений, идет с участием биокатализаторов (ферментов).

 фермент
фермент
Н![]()

 ООС
– СН = СН – СООН + Н – ОН → НООС
– СН2
– СН – СООН
ООС
– СН = СН – СООН + Н – ОН → НООС
– СН2
– СН – СООН
фумаровая кислота яблочная кислота
