
- •Механизмы реакций.
- •Механизм реакции радикального замещентия (sr)
- •Sr in vivo (в организме) пероксидное окисление липидов (пол). Липиды – компоненты клеточных мембран. В результате пол: изменения в обмене веществ, образование канцерогенных соединений. Механизм пол:
- •Механизм реакции электрофильного присоединения (ае)
- •Механизм реакции
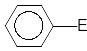
- •Механизм реакции электрофильного замещения (sе)
- •Ориентирующее действие заместителей в бензольном ядре.
Механизм реакции электрофильного замещения (sе)
SЕ in vitro: галогенирование, нитрование, сульфирование, алкилирование, ацилирование ароматических соединений (бензола, его гомологов и производных).
I стадия: Генерирование электрофильной частицы.
Е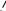

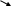 – Х → Еδ+
– Х δ–
→ Е+
+ Х–
– Х → Еδ+
– Х δ–
→ Е+
+ Х–
гетеролиз связи электрофил
I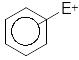 I
стадия: Образование π-комплекса: вся
система π-связей кольца взаимодействует
с электрофилом.
I
стадия: Образование π-комплекса: вся
система π-связей кольца взаимодействует
с электрофилом.
I
 II
стадия: Образование σ–комплекса:
электрофил вытягивает из 6 ē π-системы
кольца 2 электрона и образует новую
σ–связь с одним из атомов С кольца.
II
стадия: Образование σ–комплекса:
электрофил вытягивает из 6 ē π-системы
кольца 2 электрона и образует новую
σ–связь с одним из атомов С кольца.
+
в π-системе осталось 4 ē, ароматичность нарушена => σ–комплекс неустойчив.
I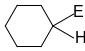
 V
стадия: Восстановление ароматичности
за счет выброса протона, образование
продукта замещения.
V
стадия: Восстановление ароматичности
за счет выброса протона, образование
продукта замещения.
 + – Н+
+ – Н+
Н+ + Х– = НХ
Таблица 1.
Образование электрофилов в реакциях SЕ.
Название реакции |
Вводимая группа |
Генерирование электрофильной частицы |
Галогенирование |
–Br, –Cl |
Br – Br + FeBr3 → Br+ + FeBr – Cl – Cl + AlCl3 → Cl+ + AlCl4– |
Нитрование |
–NO2 |
+H+ HO – NO2 → H2O + NO2+ азотная кислота |
|
–SO3H |
Серный ангидрид SO3 является Е+ благодаря поляризации связей
|
Алкилирование |
–CnH2n+1: –CH3, –C2H5, –C3H7 и т.д. |
H3C – Cl + AlCl3 → H3C+ + AlCl4– |
|
R–CO–: CH3–C–,
C2H5–C– и т.д.
|
CH3–C – Cl + AlCl3 → CH3–C+ + AlCl4– |
Таблица 2.
Ориентирующее действие заместителей в бензольном ядре.
Название субстрата |
Формула соединения |
Заместитель |
Эффекты заместителя |
Распределение ē плотности |
Характер заместителя |
Влияние на SЕ |
Положения, которые направляется входящая группа |
Формулы продуктов реакции SЕ |
Род ориентакта |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
CH3–метил |
+I |
|
ЭД, ↑ē плотность в кольце |
облегчает |
орто– пара– |
|
I |
|
|
OH–гидрокси |
–I +M
|
|
ЭД, +М > –I |
облегчает |
орто– пара– |
|
I |
|
|
NH2–амино |
–I +M
|
|
ЭД, +М > –I |
облегчает |
орто– пара– |
|
I |
|
|
Cl–хлор |
–I +M |
|
ЭА, +М < –I, ↓ē плотность в кольце |
затрудняет |
орто– пара– |
|
I |
Бром-бензол |
|
Br–бром |
–I +M |
|
ЭА, +М < –I |
затрудняет |
орто– пара– |
|
I |
|
|
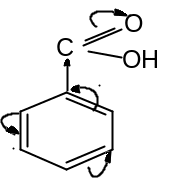
–карбоксил |
–I –M |
|
ЭА |
затрудняет |
мета– |
|
II |
|
|
Альдегидная |
–I –M |
|
ЭА |
затрудняет |
мета– |
|
II |
|
|
нитро– |
–I –M |
|
ЭА |
Затрудняет |
мета– |
|
II |
П ример
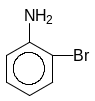
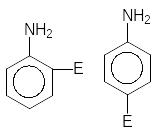
1. Бромирование анилина.
ример
1. Бромирование анилина.

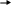
С![]()
 хема
реакции: + Br2
o-броманилин
+ HBr
хема
реакции: + Br2
o-броманилин
+ HBr
n-броманилин
М еханизм
реакции:
еханизм
реакции:
I. Образование Е+: Br – Br + FeBr3 → Br+ + FeBr4–
I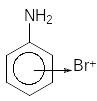 I.
Образование π-комплекса
I.
Образование π-комплекса
![]()
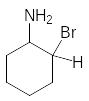
I II.
Образование σ–комплекса +
и +
II.
Образование σ–комплекса +
и +
I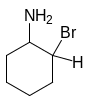
 V.
Восстановление ароматичности за счет
выброса протона, образование продукта
реакции
V.
Восстановление ароматичности за счет
выброса протона, образование продукта
реакции
 + – n+
+ – n+
![]()
![]()
 + – n+
+ – n+
 H+
+ FeBr4–
= HBr + FeBr3
H+
+ FeBr4–
= HBr + FeBr3
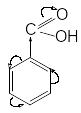
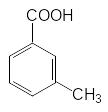
Пример 2. Метилирование бензойной кислоты.
AlCl3
Схема реакции: + CH3Cl → + HCl
катализатор
м–метил
Механизм
реакции:
I .
Образование Е+:
CH3
– Cl
+ AlCl3
→ CH3+
+ AlCl4
.
Образование Е+:
CH3
– Cl
+ AlCl3
→ CH3+
+ AlCl4
I I.
Образование π–комплекса:
I.
Образование π–комплекса:
I II. Образование σ–комплекса: +
I

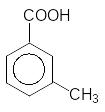 V.
Восстановление ароматичности за счет
выброса протона, образование продукта
реакции
V.
Восстановление ароматичности за счет
выброса протона, образование продукта
реакции
 +
– n+
H+
+ AlCl4–
= HCl
+ AlCl3
+
– n+
H+
+ AlCl4–
= HCl
+ AlCl3
(катализатор после реакции
выделяется в неизменном виде).
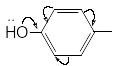
SE in vivo
Й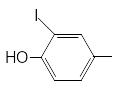 одирование
тирозина в ходе биосинтеза йодсодержащих
гормонов щитовидной железы.
одирование
тирозина в ходе биосинтеза йодсодержащих
гормонов щитовидной железы.
 +I2
+I2
+I2
+I2
![]()
![]()
 CH2
–
CH – COOH →
CH2
CH
– COOH →
фермент
фермент
CH2
–
CH – COOH →
CH2
CH
– COOH →
фермент
фермент
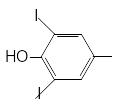
3-йодтирозин
CH2 CH – COOH
3,5-дийодтирозин

 Бензойная
кислота
Бензойная
кислота
 Нитро-бензол
Нитро-бензол