
- •1.1. Escherichia coli
- •1.2. Методи нетривалого зберігання мікроорганізмів
- •1.3. Методи тривалого зберігання мікроорганізмів
- •1.4. Типи поживних середовищ для вирощування мікроорганізмів
- •1.5. Елективні методи культивування (накопичувальні та чисті культури)
- •1.6. Ріст бактерій у бактеріальній популяції
- •1.7. Пересівання й зберігання бактерій і бактеріофагів
- •2.2. Характеристика будови клітин і життєвого циклу дріжджів
- •2.3. Метилотрофні дріжджі
- •2.4. Біологічні особливості дріжджів
- •3.2. Виділення гібридів мікроорганізмів
- •4.1. Характеристика мутагенних факторів
- •4.2. Класифікація мутацій
- •4.1. Спонтанний та індукований мутагенез
- •III. Статистичне опрацювання результатів індукованого мутагенезу.
- •8.1. Основні етапи отримання нуклеїнових кислот
- •8.2. Характеристика хімічних сполук, які використовують для виділення нуклеїнових кислот
- •Фізичні чинники, які пригнічують активність нуклеаз.
1.7. Пересівання й зберігання бактерій і бактеріофагів
У генетичних дослідженнях мікроорганізмів велике значення мають якісні показники висіваємих культур бактерій і бактеріофагів. Техніка висіву бактерій багато в чому подібна до загальноприйнятих правил. Однак є ряд істотних відмінностей:
-
одержання генетично чистої культури, тобто очищеної від супутніх мутантів і ревертантів;
-
відбір монотипових колоній за морфологічними і фізіолого-культурними ознаками після висіву бактерій на спеціальні середовища;
-
дотримання фізичних умов вирощування бактерій (температура, період культивування, доступ кисню, щільність середовища, освітленість) .
Пересівання музейних культур варто робити якомога рідше (не частіше двох разів на рік), тому що під час пересівань завжди існує небезпека потрапляння мутантів або ревертантів, що виникають у культурі, у пересіваний матеріал. У ході послідовних пересівів вони можуть поступово витісняти первісну культуру.
24
У процесі ведення музейних культур варто періодично очищати їх від можливих мутантів або ревертантів відбором матеріалу із клонів, тобто окремих колоній, що виросли з одиничних клітин, або спор одночасно з перевіркою їхніх генотипів.
Бактеріофаг вирощують на генетично чистих культурах зараженням їх на рідкому або твердому поживному середовищі із наступним відмиванням фага від субстрату й фільтрацією через мембранні мікропористі фільтри. Фаги містяться в рідкій фазі. Зберігання генетично чистих клонів бактерій і бактеріофагів – відповідальний етап генетичних досліджень. Тому і до їх вирощування, і до їх зберігання ставляться жорсткі вимоги.
Метод зберігання бактеріофага залежить від його виду. Так , бактеріофаг Т4 зберігають у стерильному бульйоні в герметично закритих пробірках або флаконах при температурі 0 – 4 °С до кількох років. Бактеріофаг P1 кс зберігають у стерильному буфері з хлористим кальцієм у холодильнику.
Фаг досить швидко втрачає активність, тому для його зберігання використовують суспензії з високим титром: 1010 – 1011 частинок/мл. Пересівають фаг P1 кс один – два рази на рік.
Багато видів бактеріофагів можна зберігати й за звичайних температурних умов у водному середовищі або середовищі фізіологічного розчину без видимих порушень генетичних ознак протягом досить тривалого періоду часу.
Поживні середовища, використовувані в генетичних дослідженнях на клітинах мікроорганізмів, в основному не відрізняються від звичайних середовищ, однак слід зважати на те, що:
-
хімічні речовини, використовувані для приготування середовищ, мають бути високого ступеня чистоти;
-
поживні середовища слід готувати тільки на дистильованій воді і з компонентів, які були попередньо роздільно простерилізовані;
-
у деяких випадках для стерилізації середовищ застосовують методи фільтрації й виморожування;
-
для приготування середовищ потрібно чітко дотримуватись дозування компонентів, температури й тривалості стерилізації;
-
всі застосовувані середовища – синтетичні;
-
багато поживних середовищ є дефіцитними по окремих компонентах живлення, тобто є диференційованими;
-
досить часто поживні середовища використовують у вигляді дво- або багатошарового субстрату; при цьому як за складом, так і за консистенцією вони можуть бути неоднакові;
-
у практиці генетичних досліджень застосовують правило підсушування поживних середовищ (видалення конденсаційної вологи), яке, в основному, стосується середовищ, розлитих у чашки Петрі; підсушування сприяє швидкому усмоктуванню мікробної суспензії; його проводять в сушильній шафі при температурі не більше 60 °С звичайно протягом 1 год.
-
Визначення титру бактерій і бактеріофагів. Визначення титру бактерій і бактеріофагів у генетичних дослідженнях необхідно для встановлення
25
генетичної взаємодії між бактеріями й фагом, активності репродукції фага, ступеня стійкості бактерій до дії фага тощо.
Для визначення титру бактерій використовують звичайні мікробіологічні методи (висів розведень на чашки Петрі). Для визначення титру бактеріофага розроблено ряд методик одержання фагових лізатів. Одна з них ґрунтується на ефекті утворення зон просвітління (бляшок), які відповідають кількості інфекційних фагових частинок, що містяться в лізаті.
В основі методу розведень лежить титрування суспензії мікроорганізмів і наступний розсів її на тверде поживне середовище. Вважають, що кожна життєздатна клітина , спора або вірусна частинка утворить окрему колонію. Підрахувавши число вирослих на чашках колоній і знаючи розведення й об'єм висіяних проб, можна обчислити кількість життєздатних одиниць в 1 мл вихідної культури (суспензії) за формулою:
N = Vdn ,
де n – середня кількість колоній на чашці (для даного розведення); d – розведення; V – об'єм висіваної проби, мл.
Зручне для підрахунку число колоній на звичайно використовуваних чашках Петрі (діаметр 90 – 100 мм) становить: для бактерій – 50...200; цвілевих грибів – 20...50; бактеріофагів – 200...600.
Успіх аналізу забезпечують:
-
точність у відборі проб і розведень;
-
разове використання піпеток;
-
гомогенність суспензії культури;
-
підсушування середовища при висіві рухливих форм мікроорганізмів (наприклад E. соli);
-
суворий контроль температури й складу розріджувача (вода, дистилят, буфер);
-
запобігання інактивації бактеріофагів і вірусів у сольових розчинах, які не містять білку або желатини при їхньому розведенні або струшуванні.
Для визначення титру використовують два методи – поверхневий і глибинний (двошаровий). За першого – на агарову пластину вносять піпеткою 0,1 мл суспензії , яку ретельно розтирають шпателем. За другого – суспензію з розведенням піпеткою вносять у розплавлений і охолоджений до температури 45
– 48 ° С напіврідкий 0,7 % агар і після перемішування виливають на поверхню більш щільного (2 % агар), попередньо підсушеного, середовища в чашці Петрі. Звичайно в 3 – 5 мл напіврідкого агару вносять 0,5 мл розведеної суспензії.
Бактеріальні клітини розводять у 0,05 М фосфатному буфері з рН – 7,0. Як повне агаризоване середовище застосовують агаризований бульйон Хоттингера. У разі висіву клітин двошаровим способом використовують напіврідке 0,7 % і щільний 2 %, при поверхневому способі – 2 % повне агаризоване середовище.
Фагову суспензію розводять вдвоє у розбавленому вдвоє бульйоні Хоттингера з 0,5 % NaCl. Штамом-хазяїном є культура E. со li. Для висіву проб з розведень використовують 0,7 % ПА і 2 % повне агаризоване середовище.
26
Завдання на виконання
І. Розведення й розсів бактеріальної культури.
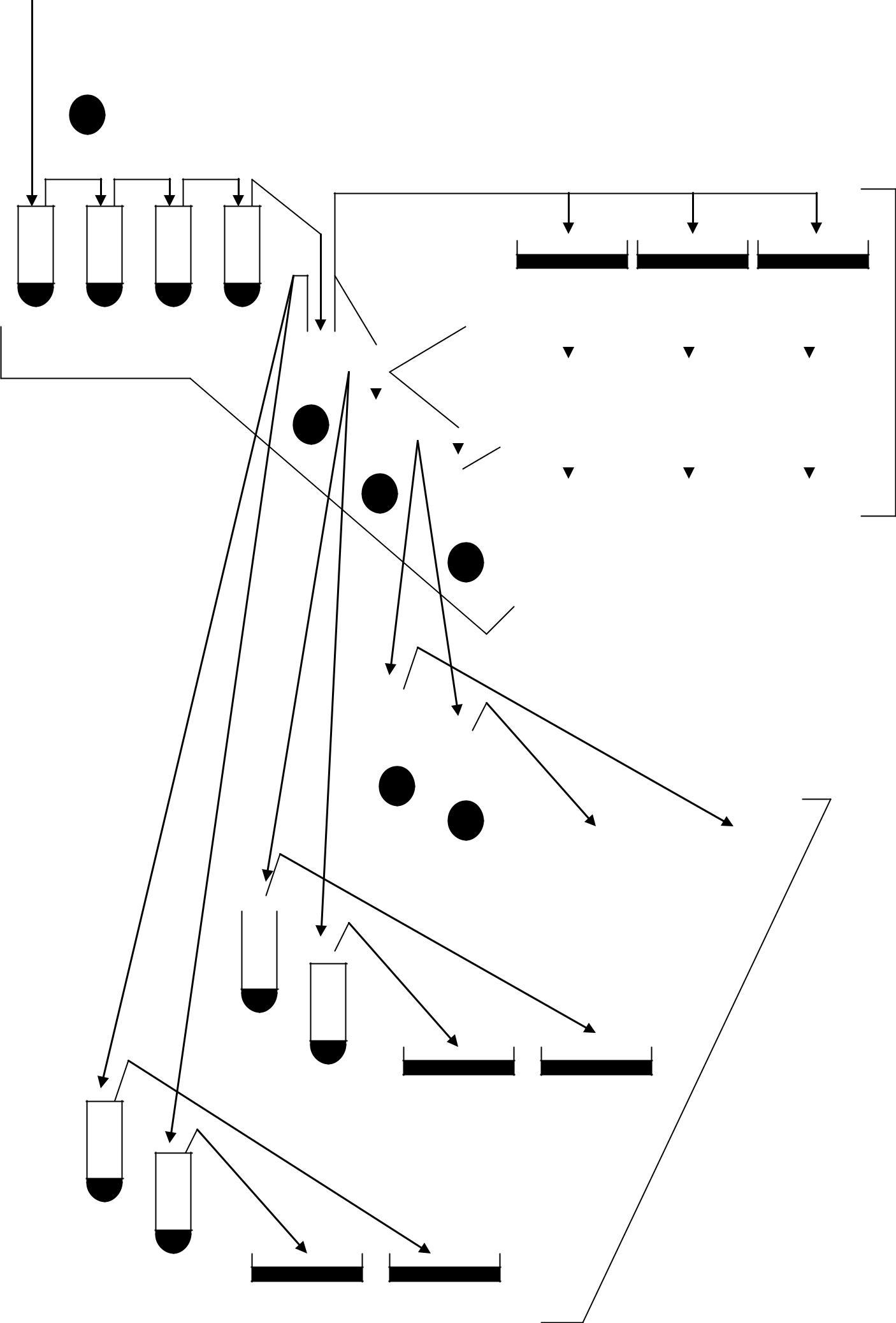
1. На занятті використовують нічну культуру, в ирощену на поживному середовищі концентрацією 109 клітин/мл. Із цієї культури готують послідовні розведення (до семи розведень), для чого в кожну пробірку вносять по 4,5 мл фосфатного буфера (рис. 1.1). З вихідної культури відбирають по 0,5 мл (перед відбором проб суспензія ретельно перемішується) і переносять у першу пробірку, не занурюючи піпетку в буфер. Культури розводять за загальноприйнятою схемою. Розсів бактеріальної культури проводять двома способами – поверхневим
-
двошаровим.
-
При поверхневому розсіві з п'ятого, шостого та сьомого розведень беруть проби по 0,1 мл і обережно, не ушкоджуючи агар, наносять на чашки з повним агаризованим середовищем. Суспензію рівномірно розтирають по всій поверхні середовища мікробіологічним шпателем. Якщо аналіз виконують на паралельних чашках, з кожного розведення розтирання суспензії проводять тим самим шпателем.
-
При двошаровому методі розсіву з пробірок 5, 6 і 7 відбирають проби по 1 мл і вносять по 0,5 мл у дві пробірки, що містять по 3 мл розплавленого напіврідкого агару (пробірки з агаром мають перебувати у водяній бані при температурі 46 °С). Суспензію в агарі швидко перемішують струшуванням і виливають на чашки із твердим поживним попередньо підсушеним середовищем. Розлите середовище треба рівномірно розподілити по поверхні агару. Процедура розсіву триває 5 – 7 с. Після застигання агару (10 – 15 хв) чашки в переверненому стані поміщають у термостат з температурою 37 °С й інкубують протягом 24 год.
ІІ. Розведення й розсів суспензії бактеріофага.
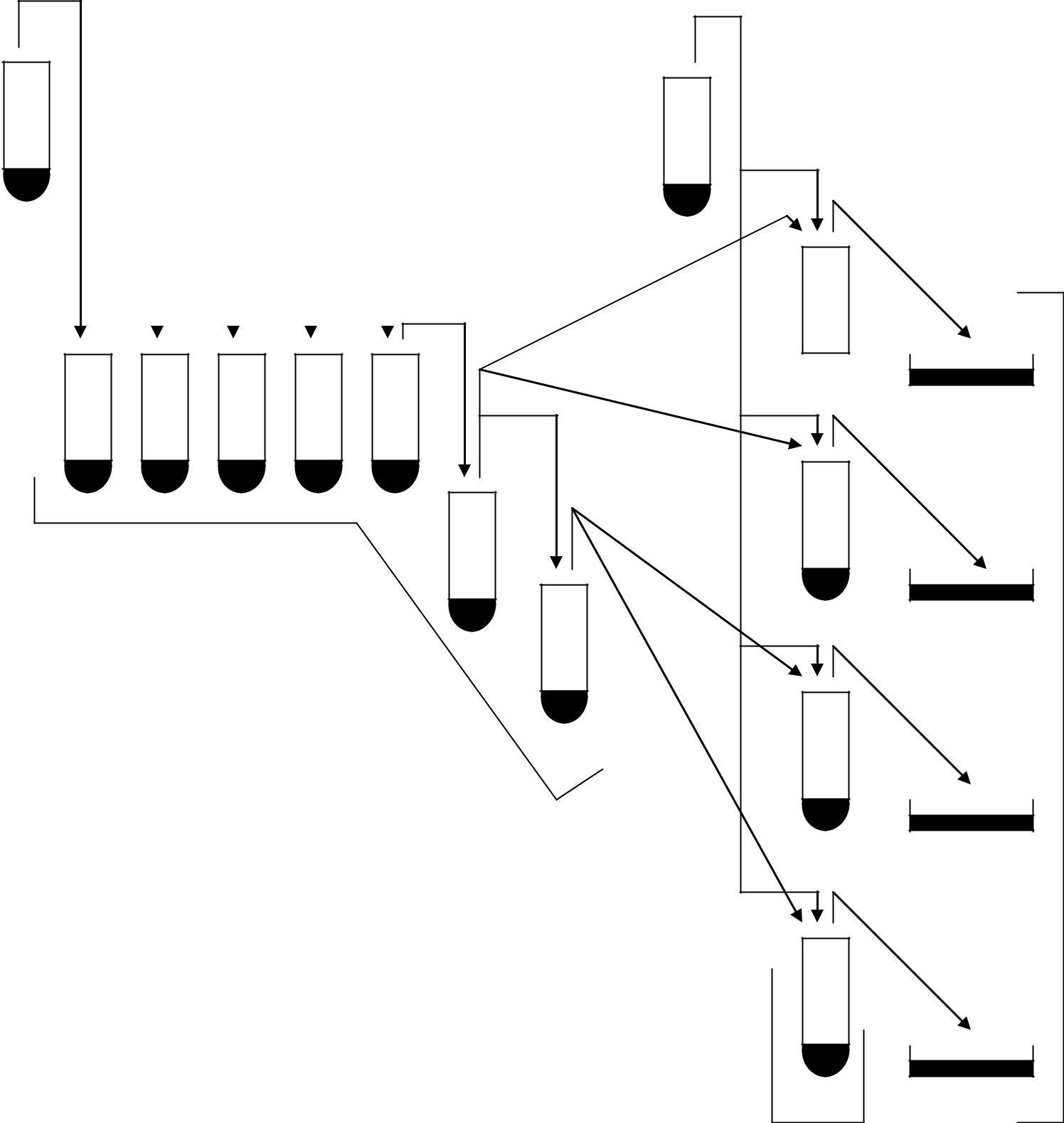
-
Використовується вихідна суспензію бактеріофага Т4В концентрацією 109 частинок/мл, приготовлену розведенням фаголізату. Розведення бактеріофага проводять у ряді з семи пробірок, які містять по 4,5 мл розведеного 0,5 % NaCl бульйону (рис. 1.2). Вихідну суспензію бактеріофагу розводять до 10–7 частинок/мл.
-
Висів бактеріофага проводять двошаровим методом. Для цього з розведення 10–6 і 10–7 відбирають проби по 1 мл і вносять по 0,5 мл у кожну з двох пробірок з 3 мл розплавленого напіврідкого агару (при температурі 46 °С). Напіврідкий агар попередньо заражають бактеріями, для чого в кожну пробірку вносять по 0,1 мл суспензії E. соli з титром 109 клітин/мл. Вміст кожної пробірки перемішують і виливають у чашку – верхній шар – на нижній шар підсушеного 1,2 % повного агаризованого середовища. Після застигання верхнього шару чашки поміщають у переверненому вигляді в термостат і витримують протягом 18 – 24 год при температурі 28 °С.
|
|
|
|
0,5 |
Вихідна бактеріальна культура |
27 |
|
|
|
|
|
|
|
з титром |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
109 кл/мл |
|
|
|
|
|
|
|
|
Поверхневий розсів |
|
|
|
|
|
|
|
|
|
0,5 |
0,5 |
0,5 |
По 0,1 мл на чашку |
|||
|
|
|
|
|
|
0,5 |
|
0,5 По 0,1 мл на чашку
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
по 4,5 мл буфера |
|
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
По 0,1 мл на чашку |
|
|
|
||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||
|
рН 7,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,1
0,1 Двошаровий розсів
-
0,1
3 мл
0,7 % ПА
0,1
0,1
0,1
-
3 мл
2 % ПА
0,7 % ПА
3 мл
0,7 % ПА
Рис.1.1. Схема титрування й розсіву суспензії E. соli (ПА – повне агаризоване середовище)
|
2 % ПА |
0,5 мл
Вихідна суспензія бактеріофага
Т4В з титром 109 частинок/мл
-
0,5
0,5
0,5
0,5
0,5
0,5
0,5
0,5
0,5
По 4,5 мл розведеного бульйону
Хотингера
0,5
По 0,1 мл
Бактеріальна культура з
титром 109 кл/мл
0,1
3 мл
0,1
![]()
3 мл
0,1
3 мл
0,1
3 мл
3 мл
0,7 % ПА
28
|
2 % ПА |
Рис.1.2. Схема титрування й розсіву суспензії бактеріофага Т4В (ПА – повне агаризоване середовище)
29
Опрацювання результатів
Аналіз отриманих результатів включає в себе підрахунок кількості колоній, що виросли на чашках, і бляшок. Результати заносять у табл. 1. 2 і 1.3. Обчислюють кількість життєздатних бактеріальних клітин і частинок бактеріофага у перерахунку на 1 мл культури E. соli і суспензії фага Т4В. Крім того, варто враховувати:
-
Чи є десятикратні розходження між розведеннями 10–5 і 10–6, 10–6 і 10–7 частинок/мл?
-
Яка розбіжність результатів між паралельними розведеннями?
-
Яка різниця між даними, отриманими двошаровим і поверхневим методами розсіву?
Таблиця 1.2
Визначення концентрації життєздатних клітин у культурі E. соli
|
Ряд |
Розведення |
Кількість колоній |
Концентрація |
||
|
клітин у культурі |
|||||
|
|
|
|
|
|
|
|
|
|
Поверхневий спосіб розсіву |
|
||
|
І |
10-5 |
|
|
|
|
|
10-6 |
|
|
|
|
|
|
|
10-7 |
|
|
|
|
|
ІІ |
10-5 |
|
|
|
|
|
10-6 |
|
|
|
|
|
|
|
10-7 |
|
|
|
|
|
ІІІ |
10-5 |
|
|
|
|
|
10-6 |
|
|
|
|
|
|
|
10-7 |
|
|
|
|
|
IV |
10-5 |
|
|
|
|
|
10-6 |
|
|
|
|
|
|
|
10-7 |
|
|
|
|
|
|
|
Двошаровий спосіб розсіву |
|
||
|
І |
10-5 |
|
|
|
|
|
10-6 |
|
|
|
|
|
|
|
10-7 |
|
|
|
|
|
ІІ |
10-5 |
|
|
|
|
|
10-6 |
|
|
|
|
|
|
|
10-7 |
|
|
|
|
|
ІІІ |
10-5 |
|
|
|
|
|
10-6 |
|
|
|
|
|
|
|
10-7 |
|
|
|
|
|
IV |
10-5 |
|
|
|
|
|
10-6 |
|
|
|
|
|
|
|
10-7 |
|
|
|
|
30
Таблиця 1.3
Визначення концентрації життєздатних частинок бактеріофага Т4В
|
|
|
Кількість бляшок на чашці |
Концентрація |
|
|
Ряд |
Розведення |
|
|
фагових частинок, |
|
1 |
2 |
|||
|
|
|
мл-1 |
||
|
І |
10-5 |
|
|
|
|
10-6 |
|
|
|
|
|
|
10-7 |
|
|
|
|
ІІ |
10-5 |
|
|
|
|
10-6 |
|
|
|
|
|
|
10-7 |
|
|
|
|
ІІІ |
10-5 |
|
|
|
|
10-6 |
|
|
|
|
|
|
10-7 |
|
|
|
|
IV |
10-5 |
|
|
|
|
10-6 |
|
|
|
|
|
|
10-7 |
|
|
|
Контрольні запитання
-
Охарактеризуйте морфолого-культуральні і фізіолого-біохімічні особливості E. coli.
-
Які ви знаєте типи поживних середовищ для культивування мікроорганізмів? У чому полягає роль поживних середовищ для одержання очікуваного результату при дослідженнях?
-
Що таке накопичувальна і чиста культура мікроорганізмів? Які загальні вимоги до ведення чистих культур мікроорганізмів?
-
Які ви знаєте методи визначення біомаси клітин?
-
Чим відрізняється робота з культурами в мікробіологічній і генетичній лабораторіях?
-
Назвіть основні вимоги, пропоновані для зберігання мікроорганізмів?
-
Охарактеризуйте методи нетривалого зберігання мікроорганізмів.
-
Які вам відомі методи тривалого зберігання мікроорганізмів?
-
Що означає мутантний або ревертантний вид мікроорганізмів?
10. Які принципові відмінності методів зберігання бактерій і бактеріофагів? 11. Як визначити титр бактерій? Що дає аналіз на титр? Що забезпечує успіх
аналізу?
12. Як визначити титр бактеріофага? В чому суть методу? Які істотні відмінності у визначенні титру бактерій і бактеріофагів?
Література: [1, 2, 3, 4, 12].
31
ЛАБОРАТОРНЕ ЗАНЯТТЯ 2
ЦИТОПЛАЗМАТИЧНА СПАДКОВІСТЬ У ДРІЖДЖІВ
Мета: вивчення біологічних особливостей дріжджів роду Saccharomyces; одержання клонів дріжджів і збереження їхньої генетичної чистоти.
Матеріали та обладнання: мікроскопи; термостат; центрифуга; предметні та накривні скельця; крапельниці з дистильованою водою; чашки Петрі з сусло-агаром; чашки Петрі з середовищем для споруляції; камера Горяєва; стерильні піпетки і пробірки; пробірки з 2, 4,5 та 9 мл стерильної дистильованої води; культури гаплоїдного й диплоїдного штамів дріжджів Saccaromyces cerevisiae.
Загальні відомості
2.1. Дріжджі
Дріжджі, як одноклітинні гриби, є важливим біотехнологічним об’єктом і водночас зручною моделлю в дослідженні еукаріотичних організмів. Цей вибір, особливо щодо пекарських дріжджів Saccharomyces cerevisiae, пояснюється такими факторами:
-
непатогенністю (для більшості видів дріжджів);
-
швидким ростом;
-
культура є популяцією окремих клітин, що полегшує виділення мутантів і маніпуляції з колоніями на чашках;
-
існуванням стабільних гаплоїдних та диплоїдних форм, що дає можливість проводити генетичний аналіз;
-
дуже активною системою гомологічної рекомбінації;
-
доступністю високоефективних систем трансформації;
-
малим розміром геному (1,21×107 п.н. для пекарських дріжджів), який тільки в 3,5 раза більший за геном E. coli;
-
повним секвенуванням геному кількох видів дріжджів;
-
розробленням нової двогібридної технології, яка дає змогу тестувати в клітинах дріжджів функціональну взаємодію певних білків різних організмів.
