
- •1.1. Escherichia coli
- •1.2. Методи нетривалого зберігання мікроорганізмів
- •1.3. Методи тривалого зберігання мікроорганізмів
- •1.4. Типи поживних середовищ для вирощування мікроорганізмів
- •1.5. Елективні методи культивування (накопичувальні та чисті культури)
- •1.6. Ріст бактерій у бактеріальній популяції
- •1.7. Пересівання й зберігання бактерій і бактеріофагів
- •2.2. Характеристика будови клітин і життєвого циклу дріжджів
- •2.3. Метилотрофні дріжджі
- •2.4. Біологічні особливості дріжджів
- •3.2. Виділення гібридів мікроорганізмів
- •4.1. Характеристика мутагенних факторів
- •4.2. Класифікація мутацій
- •4.1. Спонтанний та індукований мутагенез
- •III. Статистичне опрацювання результатів індукованого мутагенезу.
- •8.1. Основні етапи отримання нуклеїнових кислот
- •8.2. Характеристика хімічних сполук, які використовують для виділення нуклеїнових кислот
- •Фізичні чинники, які пригнічують активність нуклеаз.
III. Статистичне опрацювання результатів індукованого мутагенезу.
Для статистичного опрацювання результатів, отриманих під час опромінювання
чи дії мутагенів, досліди необхідно кілька разів повторити.
50
|
|
|
|
Розрахунок розведень вихідної суспензії клітин S. cerevisiae 15В-П4 |
Таблиця 4.1 |
|||||
|
|
|
|
|
||||||
|
|
|
після опромінення різними дозами УФ-променів (концентрація суспензії 5×106 клітин/мл) |
|||||||
|
|
|
|
Передба- |
Густота висіву суспензії |
Розведення вихідної |
Рекомендовані розведення |
|||
|
|
Доза |
|
на чашки, клітин/мл |
суспензії |
|||||
|
№ |
|
чуване |
|
|
|||||
|
опромінення, |
|
|
|
|
|
|
|
||
|
|
Для обліку |
|
Для обліку |
|
Для обліку |
||||
|
п/п |
ерг/мм2 |
|
виживання, |
Для обліку |
частоти |
Для обліку |
частоти |
Для обліку виживання |
частоти |
|
|
|
|
% |
виживання |
мутацій |
виживання |
мутацій |
|
мутацій |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
4,9 мл води + 0,1 мл |
|
|
1 |
Контроль |
|
100 |
104 |
105 |
у 500 разів |
у 50 разів |
суспензії (р. І) |
Висів з |
|
|
|
|
|
|
|
|
|
0,9 мл води + 0,1 мл |
р. І і р. ІІ |
|
|
|
|
|
|
|
|
|
з р. І (р. ІІ) |
|
|
|
|
|
|
|
|
|
|
2,4 мл води + 0,1 мл |
|
|
2 |
1200 |
|
50 |
2·104 |
2·105 |
у 250 разів |
у 25 разів |
суспензії (р. І) |
Висів з |
|
|
|
|
|
|
|
|
|
0,9 мл води + 0,1 мл |
р. І і р. ІІ |
|
|
|
|
|
|
|
|
|
з р.І (р. ІІ) |
|
|
|
|
|
|
|
|
|
|
1,6 мл води + 0,4 мл |
|
|
3 |
1800 |
|
10 |
105 |
105 |
у 50 разів |
у 5 разів |
суспензії (р. І) |
Висів з |
|
|
|
|
|
|
|
|
|
0,9 мл води + 0,1 мл |
р. І і р. ІІ |
|
|
|
|
|
|
|
|
|
з р. І (р. ІІ) |
|
|
|
|
|
|
|
|
|
Без роз- |
|
Висів без |
|
|
|
|
|
106 |
2·106 |
|
ведення по |
0,8 мл води + 0,2 мл |
|
|
4 |
2400 |
|
1 |
у 5 разів |
розведення |
||||
|
|
|
|
|
|
|
|
0,1 мл на |
суспензії (р. І) |
і з р. І |
|
|
|
|
|
|
|
|
чашку |
|
|
|
|
|
|
|
|
|
|
|
|
|
51

|
Вихідна |
|
|
|
|
|
|
|
3,4 мл |
0,5 мл |
|
|
|
КОНТРОЛЬ |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
культура |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
дріжджів, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
107 |
|
|
|
|
|
|
|
|
|
|
|
|
0,5 мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||||
|
клітин/мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,9 мл |
|
|
|
|
|
|
|
|
|
4,5 мл ф. б. |
0,1 мл |
|
|
|
|
|
|
0,1 мл |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,1 мл 0,5 М NaNO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4,5 мл ф. б. |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
0,1 мл |
ДОСЛІДИ |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
Витримка |
|
|
|
|
0,1 мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,1 мл |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
15 хв. |
|
|
|
0,9 мл ф. б. |
|
|
|
|
|
0,1 мл |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
2,9 мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
0,1 мл 0,5 М NaNO2 |
|
|
|
|
|
0,1 мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
0,1 мл |
0,9 мл ф. б. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,9 мл ф. б. |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
Витримка |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,1 мл |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
30 хв. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,1 мл |
|
|
|
|
|
|
|
|
|
0,1 мл |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,1 мл 0,5 М NaNO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
2,9 мл |
|
|
|
|
|
|
|
0,9 мл ф. б. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
0,1 мл |
|
|
|
|
|
|
|
|
0,9 мл ф. б. |
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
Витримка |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
45 хв. |
|
|
|
|
|
|
|
|
|
0,1 мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]()
![]()
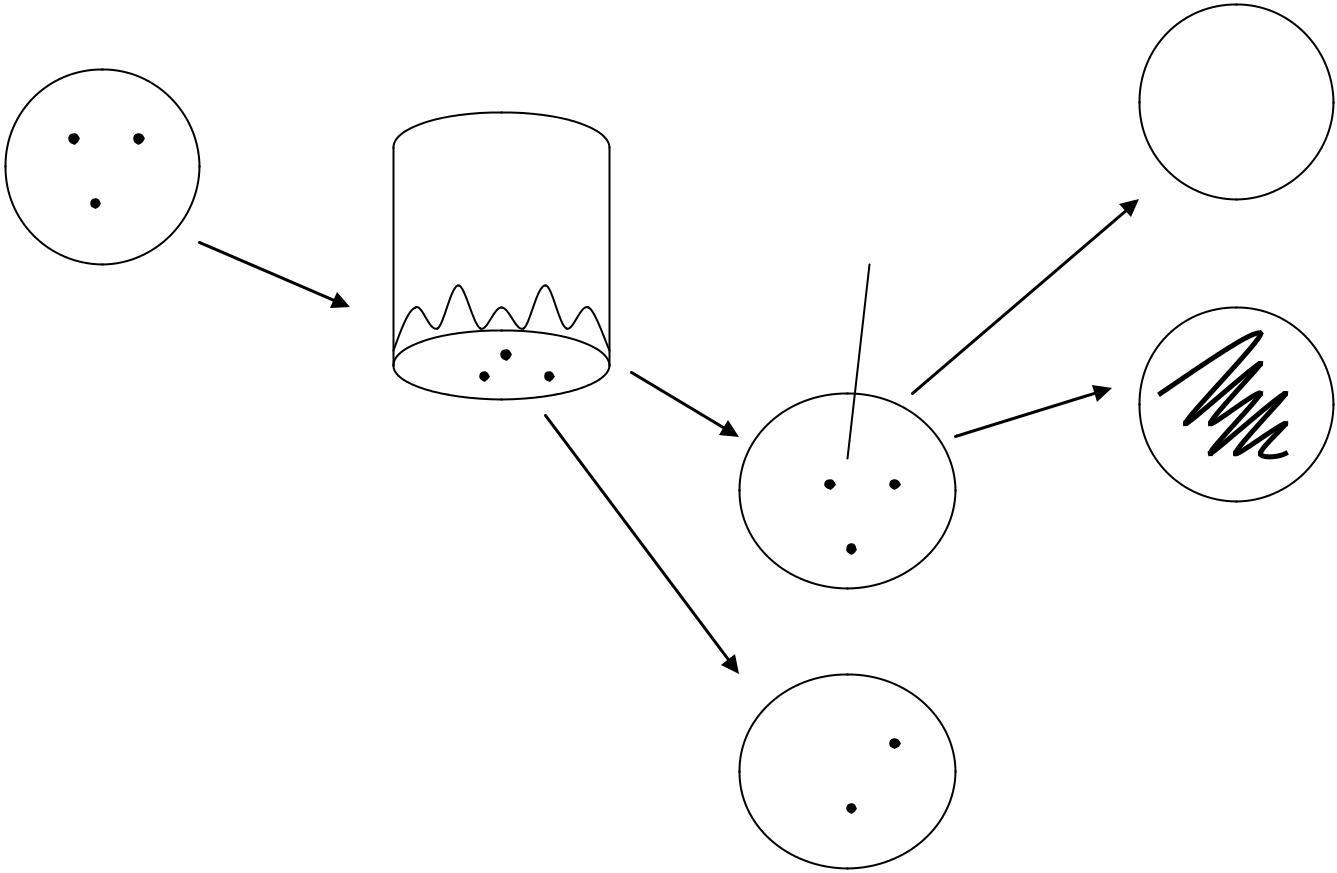
0,9 мл ф. б.





Рис.4.2. Схема оброблення клітинної суспензії дріжджів нітритом натрію (ф.б. – фосфатний буфер)
52
З кожного варіанта дослідів відбирають чашки з типовими колоніями для контролю і для кожної дози мутагену й підраховують кількість вирослих колоній (сумарно).
Обчислюють відсоток виживаності в кожній дозі мутагену для даного досліду з огляду на вихідні розведення для висівів; виживаність у контролі приймають за 100 %.
Опрацювання результатів
1. Позначимо число колоній, що виросли на трьох чашках у контролі, N, а число колоній, що виросли на трьох чашках при даній дозі – n. Для контрольних чашок здійснюють розведення вихідної суспензії в 500 разів, а опроміненої суспензії – лише в 250 разів, тобто кількість клітин, що потрапили на кожну чашку після опромінення, буде в два рази більшою. Позначимо коефіцієнт розведення контролю буквою k. Прийнявши виживаність клітин за 100 %, отримаємо виживаність при тій або іншій дозі:
|
|
|
n |
|
|
|
|
|||
|
|
|
|
|
⋅100 |
|
= 100n , % |
|||
|
S = |
|
k |
|||||||
|
|
|
|
|
N |
|||||
|
або для першої дози: |
|
|
|
|
kN |
||||
|
|
n |
|
|
|
|
||||
|
|
|
|
⋅100 |
|
50n , % |
||||
|
S1 = |
|
2 |
= |
||||||
|
|
N |
||||||||
|
|
|
|
|
|
|
N |
|||
Аналогічно розраховуємо виживаність і для інших доз мутагену.
Отримані дані щодо виживання клітин заносять у табл. 4.2 з урахуванням доз і кількості повторених дослідів, попередньо прологарифмувавши кожну величину виживаності:
xi = lg Si .
Обчислюють середнє значення виживаності для кожної дози за формулою:
|
|
|
|
|
∑xi |
, |
(1) |
|
|
|
|
|
|
n |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблиця 4.2 |
|
|
Виживаність клітин дріжджів, оброблених мутагеном |
|||||||
|
|
|
Виживання опромінених клітин у |
Середнє |
|||||
|
№ |
Доза опромінення, с |
|
різних повторах, % |
|
значення |
|||
|
п/п |
(доза мутагену, хв) |
|
|
|
|
|
|
логарифма |
|
І |
ІІ |
ІІІ |
IV |
V |
||||
|
|
|
виживання |
||||||
|
|
|
|
|
|
|
|
|
|
-
60(15)
-
90(30)
-
120(46)
Розраховують
середнє квадратичне відхилення σ,
погрішність середнього арифметичного
mx
за формулами:
-
53
m
x=σ
;
(2)
σ =
∑(
x− xi )2. (3)
n −1
n
довірчі m
xt 95%Користуючись таблицею
Стьюдента,
визначають
і![]()
![]() нтервали
середніх значень, враховуючи, що при р
повторних дослідах число ступеней
свободи дорівнює р–1.
нтервали
середніх значень, враховуючи, що при р
повторних дослідах число ступеней
свободи дорівнює р–1.
-
На міліметровому папері побудувати графік залежності виживаності опромінених клітин від дози УФ-променів або азотистої кислоти. На осі абсцис відкладають значення використаних у досліді доз мутагенів (в ергах на квадратний міліметр або в секундах), а по осі ординат – середні логарифми виживаності. На графіку вгору й униз від крапок, що відповідають середнім значенням виживаності для кожної із доз, відкладають довірчі інтервали, що показують розмах варіювання результатів у повторних дослідах.
-
Уважно розглянути вирослі на чашках колонії. Позначити тушшю всі мутантні клони, підрахувати їхню кількість і занести дані у табл. 4.3.
Таблиця 4.3
Частота аденозин-залежних мутацій у дріжджів S. cerevisiae 15В-ПЧ
|
|
Кількість |
Середня |
Загальна |
Кількість |
Частота |
|
Доза |
кількість |
кількість |
мутацій |
||
|
переглянутих |
мутантних |
||||
|
мутагену |
колоній на |
переглянутих |
аденозин- |
||
|
чашок |
клонів |
||||
|
|
чашці |
клонів |
залежності |
||
|
|
|
|
|||
|
Контроль |
|
|
|
|
|
|
І |
|
|
|
|
|
|
ІІ |
|
|
|
|
|
|
ІІІ |
|
|
|
|
|
Середню кількість колоній на чашці визначають підрахунком колоній на чашках , засіяних для обліку виживаності. Частоту індукованих мутацій для кожної дози визначають за формулою:
C = MN ,
де М – кількість мутантних клонів; N – кількість колоній на переглянутих чашках. Частота появи спонтанних аденозинзалежних мутантів при такій вибірці
близька до нуля.
Всі дані з частоти індукованих мутацій за винятком спонтанного фону зводять у таблицю за повторними дослідами, як це було зроблено під час обліку виживаності. Розраховують середнє значення частот мутацій та їхні довірчі інтервали за формулами (2) і (3). Середню частоту індукованих мутацій обчислюють за формулою:
xc
=
∑nxi
,
де xi значення частот мутацій, отримані в різних повторностях досліду для даної дози; n – кількість повторених дослідів.
54
4. За отриманими даними побудувати графік залежності виживання клітин від дози мутагену та криву доза – ефект для частоти індукованих мутацій аденозинзалежності.
Контрольні запитання
-
Що таке мутаген та мутагенез?
-
Які вам відомі мутагенні фактори? Охарактеризуйте їх.
-
Охарактеризуйте мутації залежно від причин, що їх викликали.
-
Як підрозділяють мутації залежно від клітин, в яких відбулись зміни?
-
Охарактеризуйте мутації за результатами для організму.
-
Які ви знаєте мутації за змінами генетичного матеріалу?
-
Що таке «мовчазні мутації»?
-
Охарактеризуйте зворотні мутації та реверсії.
-
Що таке індукований мутагенез? Які його механізми?
10. Яка роль мутагенів у природі й експерименті?
11. Які мутагенні фактори викликають зміни в геномі клітини? 12. Як оцінити дію мутагену?
13. На чому ґрунтується статистичне опрацювання результатів дії мутагенів? Які основні розрахунки?
Література: [1, 2, 3, 7, 8, 11].
ЛАБОРАТОРНЕ ЗАНЯТТЯ 5
ВІДБІР ТА ІДЕНТИФІКАЦІЯ БІОХІМІЧНИХ МУТАНТІВ Мета: одержання відбитків методом реплік для відбору ауксотрофних
мутантів; опанування методів ідентифікаціЇ ауксотрофних мутантів.
Обладнання та матеріали термостат; чашки Петрі з мінімальним та повним середовищами; оксамит; чашки з м'ясо-пептонним агаром, мінімальним середовищем з ростовими добавками; чашка з лунками; репліка тор; стерильні піпетки; пробірки зі стерильною дистильованою водою.
Загальні відомості
Більшість мікроорганізмів самі синтезують всі необхідні їм амінокислоти (наприклад, E. сoli ). Але деякі мікроорганізми не мають такої здатності і потребують готових амінокислот, які вносять у поживне середовище. Це так звані ауксотрофи. Отже, організми, які потребують факторів росту, називаються ауксотрофами, а організми, яким т акі фактори росту не потрібні – прототрофами. Мікроорганізми можуть бути ауксотрофами не тільки за амінокислотами, а також за вітамінами, нуклеотидами та ін.
Кількість і природа факторів росту різні для різних мікроорганізмів. Для росту молочнокислих бактерій потрібні практично всі амінокислоти, пурини та піримідини , вітаміни. Багатьом мікроорганізмам потрібні вітаміни. Так, Clostridium kluyveri росте на середовищі з біотином і параамінобензойною кислотою.
У генетиці, штам називається ауксотрофним, якщо він несе мутацію, яка робить його нездатним до синтезу однієї або декількох важливих сполук.
55
Наприклад, клітини дріжджів, в яких інактивований ген в ланцюжку синтезу урацила – урациловий ауксотроф. Ауксотрофи часто використовують у якості генетичних маркерів.
Вплив мутагенного агента на клітину призводить до зміни біохімічних процесів в організмі. Проте термін «біохімічні , або ауксотрофні мутанти» найчастіше використовують у вужчому значенні для позначення мутантів зі зміненими потребами до певних факторів росту. Такі мутанти часто використовують у біохімічних дослідженнях для встановлення шляхів біосинтезу в клітині різних сполук, а також у селекції мікроорганізмів – продуцентів таких біологічно активних речовин, як амінокислоти, антибіотики, вітаміни тощо.
Для біохімічних мутантів характерні порушення здатності до синтезу якого-небудь компонента внутрішньоклітинного обміну, у результаті чого припиняється ріст мутанта на середовищі , що не містить цього компонента (ауксотрофи). Дикі форми мікроорганізмів, що виникають у таких випадках, є прототрофами. У разі багатокомпонентної залежності розрізняють поліауксотрофність.
Існує ряд методів, що дають змогу селекціонувати мутанти за певними ознаками. До них належать метод тотального відбору на повному середовищі; метод реплік або відбитків; метод уповільненого збагачення середовища (тришарове заливання чашок середовищем різного поживного складу) і ін.
На звичайних агаризованих середовищах лише деякі мутації можна виявити безпосередньо за зміною пігменту, зміною росту колоній та іншими ознаками. Деякі ознаки виявляються, якщо добавити у середовище індикатори чи барвники. Для виділення ауксотрофних мутантів (наприклад ауксотрофних за амінокислотою гістидином) порівнюють ріст клітин на двох середовищах: з гістидином і без нього. Мутанти будуть рости тільки на середовищі з гістидином.
Як правило, частота виникнення мутацій невисока. Тому для виявлення та відбору мутантів використовують методи накопичення мутантів. Отримати накопичувальну культуру мутантів, стійких до антибіотиків, отруйних речовин і фагів досить легко: на середовищі, до якого добавлений відповідний агент, будуть рости тільки мутантні штами. Методи накопичення ауксотрофних мутантів ґрунтуються на зворотному принципі: для клітинної суспензії створюють умови, в яких мутанти не ростуть, а прототрофні клітини відсіваються або знищуються.
Ідентифікація ауксотрофних мутантів. Розроблено численні методи ідентифікації (визначення специфічних потреб) ауксотрофних мутантів, так звані методи ауксонографії, що ґрунтуються на використанні мінімального середовища з добавками певних ростових речовин. Ростові потреби ауксотрофних мутантів можуть забезпечуватися такими фізіологічно важливими речовинами, як амінокислоти, азотисті основи, вітаміни. Концентрації їх у середовищах становлять відповідно 1 – 10 мкг/мл. Розроблені методики постановки досліджень на виявлення відношення мікроорганізмів до кожної із груп ростових речовин.
До числа найефективніших належить метод Холідея (1956 р.), що дає можливість визначити потреби досліджуваних мутантів в 36 ростових факторах, використовуючи лише 12 чашок із мінімальним середовищем збагаченого ростовими факторами в такий спосіб: по 6 ростових факторів на чашку у сполученнях, представлених у табл. 5.1.
|
|
|
|
|
|
|
56 |
|
|
|
|
|
|
|
Таблиця 5.1 |
|
|
Ростові фактори для ідентифікації біохімічних мутантів* |
|||||
|
Чашк |
1 |
2 |
3 |
4 |
5 |
6 |
|
и |
||||||
|
|
|
|
|
|
|
|
|
7 |
Аденін |
(Біотин) |
Феніл- |
Аланін |
Аргінін |
Лейцин |
|
аланін |
||||||
|
|
|
|
|
|
|
|
|
8 |
Гипоксан- |
Фолієва |
Серин |
Цистеїн |
Орнітин |
Гліцин |
|
тин |
кислота |
|||||
|
|
|
|
|
|
||
|
|
|
Пантоте- |
Трипто- |
Треонін |
Аспарагі- |
|
|
9 |
Цитозин |
нова |
нова |
Ізолейцин |
||
|
фан |
||||||
|
|
|
кислота |
|
кислота |
|
|
|
|
|
|
|
|
||
|
|
|
Піридок- |
Тирозин |
Тіосуль- |
|
|
|
10 |
Гуанін |
фат |
Пролін |
Гістидин |
||
|
син |
||||||
|
|
|
|
натрію |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Парааміно- |
|
Глута- |
|
|
11 |
(Тимін) |
(Тіамін) |
бензойна |
Метіонін |
мінова |
Лізин |
|
|
|
|
кислота |
|
кислота |
|
|
12 |
Урацил |
Рибофла- |
Нікотино- |
Холін |
Інозит |
Валін |
|
він |
ва кислота |
|||||
|
|
|
|
|
|
||
*У дужках наведені речовини, що входять до складу мінімального середовища для сахароміцетів, а також незасвоювані ними.
У разі висіву 12 чашок ріст спостерігається на одній чашці по горизонталі (з ряду 1 – 6) і на одній чашці по вертикалі (з ряду 7 – 12). Так, аденінзалежний мутант ростиме на чашках № 1 і № 7, аланінзалежний – на чашках № 7 і № 4 і т.д.
Проводячи ідентифікацію специфічності ауксотрофії, аналізують вирослі колонії. З них відбирають тільки ті варіанти, які дають ріст на повному середовищі й не ростуть на мінімальному (необхідно порівняти дві чашки).
Завдання на виконання
I. Метод відбитків для відбору мутантів. За методом відбитків для відбору мутантів використовують чашки з колоніями дріжджів, що виросли після обробки УФ-променями або азотистою кислотою (нітритом натрію) (рис. 5.1).
Кожну з чашок з колоніями, що виросли з мутагенобробленої культури дріжджів 15B-ПЧ, відбивають за допомогою оксамиту на дві чашки із повним середовищем з пептоном та мінімальним середовищем.
Засіяні чашки вміщують у термостат на дві доби при температурі 30 °С. Через дві доби оглядають вирослі колонії. На повному середовищі з пептоном мають вирости всі колонії, на мінімальній – тільки прототрофи. Порівнюють ріст колоній з ростом у вихідній культурі. На мінімальному середовищі ауксотрофи утворять лише плями клітин, що не діляться. Колонії, що виросли на тих же місцях на чашках із повним середовищем з пептоном, відсівають на повне й мінімальне середовища для перевірки на наявність аксотрофних мутантів.
57
Засіяні чашки вміщують у переверненому вигляді в термостат з
|
температурою 30 °С на п’ять діб. |
|
|
|
МС |
|
ПС |
5 |
|
2 |
|
|
|
|
|
АТ |
АТ |
|
1 |
|
|
4 |
6 |
|
|
ПС |
|
|
ПС + пептон |
МС
3
Рис. 5.1. Схема постановки дослідів методом відбитків (реплік):
1 – чашка Петрі з колоніями дріжджів, що виросли після обробки мутагеном; 2 – відбиток колоній на оксамиті; 3, 4 – відбитки колоній з оксамиту на чашки з повним + пептон (ПП) і мінімальним (МС) середовищами; 5, 6 – відбір ауксотрофних мутантів із повного середовища (ПС) і МС; АТ – колонія ауксотрофа
II. Ідентифікація ауксотрофних мутантів. У порожню стерильну чашку,
попередньо марковану номером суміші факторів, вносять 0,1 мл розчину певного ростового фактора (див. табл. 5.1). Потім чашки заливають 20 мл теплого розплавленого мінімального середовища. Після застигання середовища чашки із середовищем вміщують у сушильну шафу з температурою близько 70 °С на 5 хв для підсушування середовища. Чашку з лунками протирають спиртом, обпалюють, після чого в кожну з лунок вносять стерильною піпеткою по 1 мл стерильної дистильованої води, у якій готують суспензію клітин із відібраних колоній ауксотрофних мутантів.
Для орієнтування в аналізі результатів на дні засіяних чашок з ростовими добавками , а також на контрольних чашках з повною й мінімальною дозами необхідно накреслити зліва направо стрілку, за якою буде орієнтований реплікатор.
58
-
Перед посівом реплікатор занурюють у спирт, обпалюють, охолоджують і опускають у лунки з суспензіями дріжджів, потім переносять на контрольну чашку з мінімальним середовищем. Цей висів призначений для того, щоб ще раз переконатися, що відібрані мутанти не ростуть на мінімальному середовищі.
Реплікатор знову опускають у чашку з лунками й переносять на чашку з повним середовищем, щоб упевнитись, що мутантні культури нормально ростуть на повному середовищі.
-
Після контрольних висівів аналогічно проводять висів суспензії на 12 чашках з ростовими факторами. При цьому перед кожним введенням реплікатора
-
лунки необхідно його обпалювати для того, щоб на стрижнях не залишилося середовища з попереднього висіву.
Опрацювання результатів
Після завершення роботи чашки в переверненому стані поміщають у термостат з температурою 30 ° С на сім діб . Після цього аналізують вирослі колонії і, порівнюючи отримані результати з даними табл. 5.1, визначають, які саме ростові речовини потрібні отриманим ауксотрофним мутантам. Ці результати заносять у табл. 5.2.
|
|
Характеристика ауксотрофних мутантів |
Таблиця 5.2 |
|||||
|
|
|
|
|||||
|
|
Загальна |
Кількість ауксотрофних мутантів |
|||||
|
|
кількість |
|
|
|
|
|
|
|
|
Амінокислоти |
% |
Азотисті |
% |
Вітаміни |
% |
|
|
Фактор |
колоній, |
основи |
|||||
|
|
|
|
|
|
|||
|
|
взятих для |
|
|
|
|
|
|
|
|
Кількість |
|
Кількість |
|
Кількість |
|
|
|
|
аналізу |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
УФ- |
|
|
|
|
|
|
|
|
промені |
|
|
|
|
|
|
|
|
NaNO2 |
|
|
|
|
|
|
|
Контрольні запитання
-
Які організми називають ауксо- і прототрофами?
-
Що означає термін «біохімічний мутант»? Чим такий мутант відрізняється від мутантів звичайних?
-
Які існують методи селекції мутантів? Як здійснюється ідентифікація ауксотрофних мутантів?
-
Охарактеризуйте метод накопичення мутантних мікроорганізмів.
-
Що лежить в основі методу накопичення ауксотрофних мутантів?
-
Як використовують методи відбору й ідентифікації мікроорганізмів у практичних цілях?
Література: [1, 2, 5, 9].
59
ЛАБОРАТОРНЕ ЗАНЯТТЯ 6
ФЛУКТУАЦІЙНИЙ ТЕСТ ЛУРІЯ Й ДЕЛЬБРЮКА Мета: визначення титру життєздатних клітин у вихідній і незалежній
культурах; аналіз і опрацювання результатів.
Обладнання та матеріали: термостат; пробірки з 4,5 та 10 мл фосфатного буфера; пробірки з 2 мл повного середовища; чашки Петрі з повним агаризованим середовищем; чашки Петрі з повним агаризованим середовищем зі стрептоміцином; шпателя; стерильні піпетки; культура E. coli К12 Hfr концентрацією близько 2·109 клітин/мл.
Загальні відомості
Для пояснення природи виникнення стійкості мікроорганізмів до різних негативних факторів навколишнього середовища (як і природи мінливості) довгий час використовували дві гіпотези:
-
адаптаційну, коли всі клітини рівною мірою здатні набувати стійкість до селекційного фактора; кількість стійких клітин пропорційно числу клітин у популяції;
-
мутаційну, яка припускає спонтанне виникнення стійких клітин у популяції, перш ніж вона буде піддана дії селективного агента; потомство клітини-мутанту утворить клон стійких особин.
С. Лурія вдалося розробити експериментальний метод, що дозволяє відрізнити стан індукованої резистентності від резистентності, що виникає внаслідок попередньої спонтанної мутації. Цей метод, що отримав назву «флуктуаційний тест», опис якого було опубліковано в 1943 році спільно з М. Дельбрюком, що розробив математичну модель процесу, став першим свідченням на користь мутації бактерій.
Флуктуаційний тест Лурія і Дельбрюка полягає в тому, що невеликі об’єми вихідної культури бактерій розсіюють в пробірки з рідким середовищем, а після декількох циклів поділу додають в пробірки антибіотик. Потім (без подальших поділів) на чашці Петрі з агаризованим середовищем висівають життєздатних стійких до антибіотика бактерій. Тест показав, що число стійких колоній з різних пробірок дуже мінливе – в більшості випадків воно невелике (або нульове), а в деяких випадках дуже високе. Це означає, що мутації, що викликали стійкість до антибіотика, виникали у випадкові моменти часу як до, так і після його впливу.
Для оцінки результатів флуктуаційного тесту визначають і порівнюють дисперсію σ2 кількості стійких клітин у пробах з незалежних культур і кількість стійких клітин проб з однієї культури.
Дисперсію – суму квадратів відхилень варіантів від середнього, віднесену до числа степенів вільності, визначають за формулою:
σ 2 = ∑(M − M )2 ,
n −1
де М – кількість стійких клітин в окремій пробі; M – середня кількість стійких клітин; n – число проб
60
Якщо дисперсія для проб із незалежних культур перевищує дисперсію для проб з однієї культури, це свідчить про мутаційну природу ознаки.
Тест є показовим для визначення стійкості різних видів бактерій до бактеріофага, лікарських речовин, радіації, здатності зброджувати деякі вуглеводи . Його використовують для визначення частоти спонтанних мутацій у культурах одноклітинних мікроорганізмів і культурах соматичних клітин тварин.
Темп спонтанної мутації або частота виникнення мутацій а визначається на клітину за одну генерацію. Величина а дорівнює відношенню середнього числа виявлених мутацій m до числа новоутворених клітин, які існували протягом
середнього часу в одній генерації N1 :
-
a =
m
.
N
Оскільки:
1
t =
1 − N0
N
,
N
ln 2
де N0, Nt – кількість клітин відповідно вихідна та кінцева;
-
a =
mln 2
,
Nt − N0
Використовуючи тест Лурія –Дельбрюка, можна обчислити значення m за часткою проб, у яких не відбулося жодної мутації Р0 за такою формулою:
m = −ln P0 ,
тоді:
a = − (ln P0 )(ln 2) .
Nt − N0
Під час тестування слід враховувати такі фактори:
-
вихідне число клітин, що їх висівають у незалежні культури, має бути невелике (для E. coli 10–100 клітин). Це зменшує ймовірність потрапляння в пробу висіву раніше виниклих мутантних клітин;
-
тривалість росту і об'єм незалежних культур також мають бути обмежені. Потрібно пам'ятати, що у разі використання надто численних популяцій незалежних культур розходження між ними нівелюються через нагромадження великої кількості розподілених у часі мутацій;
-
всі культури слід висівати однаковою кількістю клітин й інкубувати в ідентичних умовах.
Завдання на виконання
-
Для виконання роботи використовують культуру E. coli К12 Hfr, вирощену на повному середовищі концентрацією близько 2·109 клітин/мл (рис. 6.1). Для її одержання бактеріальні клітини висівають за 16 – 18 год на повному середовищі, інкубують при температурі 37 °С з аерацією. Кожен студент отримує 2 мл вихідної культури.
-
Для одержання незалежних культур з вихідної суспензії готують сім десятикратних розведень суспензії у фосфатному буфері. З останнього розведення відбирають пробу 0,1 мл і вносять у пробірку з 2 мл повного середовища,
-
0,5 мл
0,5
0,5
0,5
0,5
0,5
0,5

![]()
![]()
![]()
![]()
![]()
![]()
![]()
Вихідна
к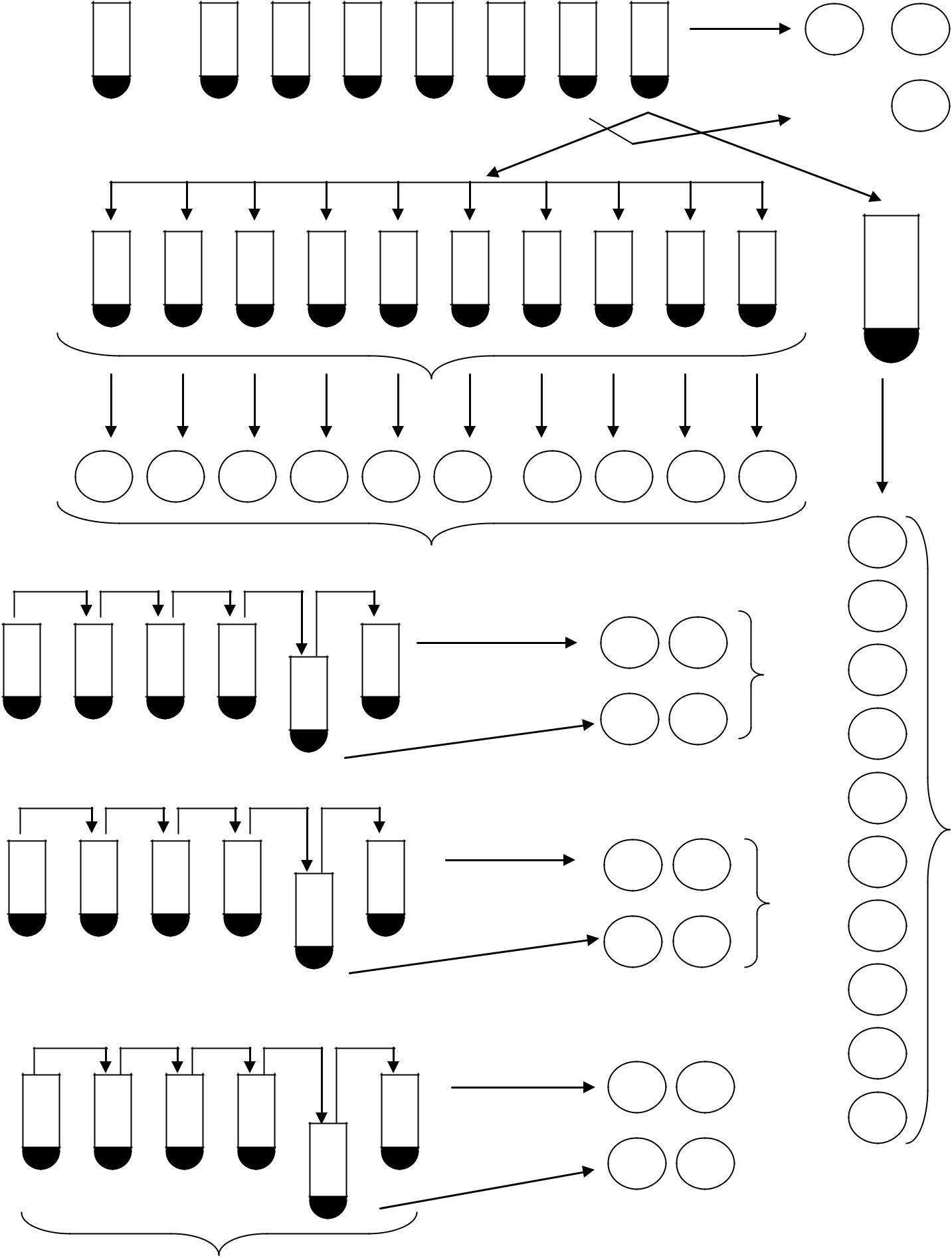 ультура
ультура
E. coli, 2·109
кл./мл
Фосфатний буфер, 4,5 мл
10 × 0,1 мл
ПС по 2 мл,
інкубація 37° С,
18-24 год
ПА +
0,5 0,5 0,5 0,5 0,5
2×0,1
2×0,1
0,5 0,5 0,5 0,5 0,5
2×0,1
2×0,1
0,5 0,5 0,5 0,5 0,5
2×0,1
2×0,1
61
2×0,1 мл
2×0,1
мл
![]()
1 мл
10 мл
-
ПА
ПА
ПА + стрептоміцин
|
|
Фосфатний буфер, 4,5 мл × 6× 3
Рис.6.1. Схема постановки флуктуаційного тесту Лурія й Дельбрюка (ПА – повне агаризоване середовище)
62
пробірки вміщують у термостат з температурою 37 °С на 18 – 24 год. Для визначення концентрації життєздатних клітин у вихідній культурі (і, отже, для визначення кількості клітин, засіяних у незалежні культури) з шостого й сьомого розведень вихідної суспензії висівають три проби по 0,1 мл на дві чашки з ПА (всього шість чашок). Засіяні чашки розміщують у термостаті з температурою 37 °С на 24 год.
-
Із пробірок, засіяних з останнього розведення вихідної культури, проводять висів на повне агаризоване середовище зі стрептоміцином для визначення вмісту стійких до антибіотика клітин. Культури в перших десяти пробірках приймають за незалежні, в одинадцятій – за окрему. З незалежних культур висівають по одній пробі по 0,1 мл (всього десять чашок повного агаризованого середовища зі стрептоміцином). З одинадцятої пробірки висівають десять проб по 0,1 мл на десять чашок з ПА зі стрептоміцином. Кожну пробу по 0,1 мл відбирають окремою мікропіпеткою з максимальною точністю й розтирають на селективному середовищі окремим шпателем.
-
Слід ще визначити концентрацію життєздатних клітин у незалежних культурах. З цією метою проводять серійні розведення (до 10–7) із трьох довільно вибраних незалежних культур. Передбачається, що у всіх незалежних культурах за час інкубації виростає приблизно однакова кількість клітин. З п’ятого й шостого розведень кожної серії висівають по дві проби пo 0,1 мл на чашки з повним агаризованим середовищем (усього 12 чашок). Чашки інкубують при температурі 37 °С протягом 24 год, чашки з повним агаризованим середовищем і стрептоміцином – 48 годин.
Опрацювання результатів
1. Після пророщення культури в чашках Петрі проводять підрахунок вирослих колоній для визначення титру вихідної культури, і результати заносять у табл. 6.1.
|
|
Концентрація клітин у вихідній і незалежній культурах |
Таблиця 6.1 |
|||||
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
Розве- |
Вихідна культура |
|
Незалежна культура |
|
|
||
|
Кількість |
Концентра- |
Номер |
Розве- |
Кількість |
|
Концен - |
|
|
дення |
колоній у |
ція клітин |
пробірки |
дення |
колоній |
|
трація |
|
|
чашках |
|
клітин |
||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Для визначення титрів незалежних культур і кількості стрептоміцинстійких клітин у пробах з незалежних і окремих культур рахують колонії, що виросли на чашках з повним агаризованим середовищем і на чашках з повним агаризованим середовищем і стрептоміцином. Результати підрахунку кількості життєздатних клітин у культурах вносять у табл. 6.2.
|
|
|
|
63 |
|
|
|
|
Таблиця 6.2 |
|
|
Аналіз стрептоміцинстійких клітин |
||
|
|
|
|
|
|
|
Кількість стійких до |
|
Кількість стійких до |
|
Номер |
Номер |
стрептоміцину клітин у |
|
|
стрептоміцину клітин у |
|||
|
проби |
культури |
пробах з незалежних |
|
|
пробах з окремої культури |
|||
|
|
|
культур |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-
Дані про кількість стійких до стрептоміцину клітин у пробах з різних культур опрацьовують статистично: обчислюють середні арифметичні й дисперсію кількості стійких до стрептоміцину клітин для проб з десяти незалежних культур і для десяти проб з окремої культури.
-
Порівнюють дисперсії кількості стійких клітин для незалежних культур і для проб з окремої культури. Далі дають відповідь на запитання, у якому випадку флуктуації між пробами можна віднести до погрішності експерименту, а в якому
– до розходжень у часі виникнення мутантів у пробах. На підставі отриманих результатів роблять висновок щодо природи виникнення ознаки стійкості до стрептоміцину.
-
За допомогою формули Лурія–Дельбрюка обчислюють частоту виникнення мутацій стрептоміцинстійкості у штама E. coli К12.
Контрольні запитання
-
Які ви знаєте гіпотези виникнення стійкості мікроорганізмів до різних негативних факторів навколишнього середовища?
-
У чому полягає суть флуктуаційного тесту Лурія і Дельбрюка?
-
Як оцінюється тест статистично?
-
Які фактори необхідно враховувати під час постановки флуктуаційного тесту?
-
Як використовують флуктуаційний тест?
Література: [2, 3, 6, 9].
64
ЛАБОРАТОРНЕ ЗАНЯТТЯ 7
ГЕНЕТИЧНЕ КАРТУВАННЯ ПРОКАРІОТ Мета: вивчення кон'югації як основи для розроблення ряду методик
генетичного аналізу: визначення частот рекомбінацій між генетичними маркерами, послідовності генетичних детермінант на хромосомі за градієнтом їхньої передачі рекомбінатам, встановлення локалізації генетичних маркерів за часом їхнього проникнення в реципієнтну клітину – картування методом переривання кон'югації; опанування названих методик.
Обладнання та матеріали: центрифуга з обертовою частотою 6000 об/хв; термостатована качалка; термостат; буфер; чашки Петрі з повним агаризованим середовищем; пробірки 22×200 мм з 2 мл повного середовища; пробірки з 4,5 мл повним середовищем; чашки Петрі з повним агаризованим середовищем, мінімальним середовищем, селективними середовищами SB,TH; SB,PH; SB,TP зі стрептоміцином, тіаміном, проліном, триптофаном і гістидином; колби Ерленмейєра на 50 мл; пробірки для розведень; стерильні піпетки; штами бактерій
Hfr та F– E. coli К12.
Загальні відомості
Кон'югація – це процес міжклітинного контакту, в якому ДНК передається від чоловічої бактерійної клітини (донора) до жіночої (реципієнта). Кон'югація, зумовлена статевим F фактором (особоливою епісомою), полягає в здійсненні контакту між клітинами штаму E. coli , що розрізняються за статтю (донор і реципієнт). Цей процес може супроводжуватися переданням бактеріальної хромосоми й утворенням генетичних рекомбінатів.
Перенесення хромосоми від донора до реципієнта характеризується:
-
суворою орієнтованістю, зв'язаною зі структурою бактеріальної хромосоми, лінійністю перенесеної хромосоми й наявністю специфічного локусу О, інтегрованого до хромосоми статевого фактора;
-
сталістю швидкості перенесення генетичних детермінантів при схрещуванні;
-
частковістю у зв’язку із спонтанним розривом хромосоми, що пов'язано зі збільшенням відстані від початкової точки О.
Однак будь-який генетичний маркер донора має рівні можливості для інтеграції в хромосому реципієнта. Внаслідок цього по довжині хромосоми утворюється безперервний градієнт передання рекомбінантам спадкоємних ознак донора, що відображає градієнт перенесення відповідних генетичних детермінантів (рис. 7.1.).
Кон'югація послужила основою для розроблення ряду методик генетичного аналізу:
-
визначення частот рекомбінацій між генетичними маркерами; але через ряд генетичних особливостей цей метод не придатний для картування довгих сегментів, але досить ефективний при аналізі тісно зчеплених локусів і при внутрішньогенному картуванні (маркери відстоять один від одного не далі 2 хв);
65
-
визначення послідовності генетичних детермінант у хромосомі за градієнтом їхнього передання рекомбінатам;
-
локалізації генетичних маркерів за часом їхнього проникнення в реципієнтну клітину – картування методом переривання кон'югації.
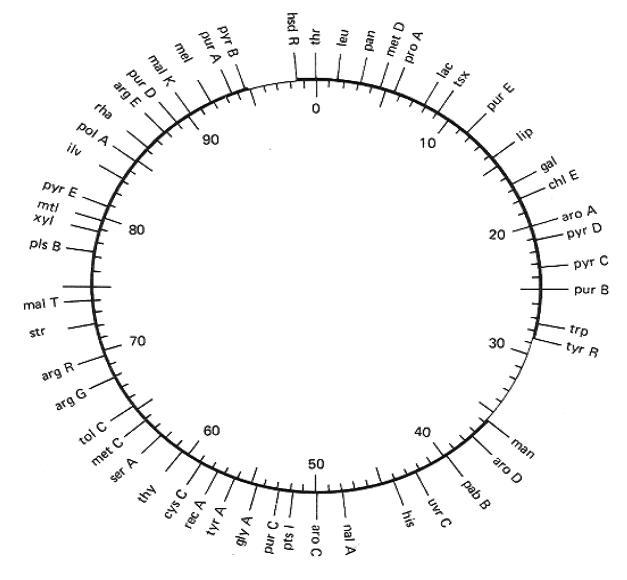
Рис. 7.1. Генетична карта E. coli
Результати, одержані двома останніми методами, визначаються особливостями перенесення і не являють собою функцію частот рекомбінації . Ці методи використовують для картування довгих фрагментів хромосом, тобто під час аналізу маркерів, що відстоять один від одного на відстані більше двох хвилин переносу.
Рекомбінанти можна, у свою чергу, визначати двома способами:
-
Висів з кон’югаційної суміші на селективне середовище для відбору рекомбінантів за одним, найближчому до початкової точки О хромосоми, маркером донора (селективний маркер). Кількість рекомбінантів, що успадкували неселективний маркер, виражається у відсотках від загального числа рекомбінантів за проксимальним маркером.
66
-
Проби з кон’югаційної суміші відразу розсівають на різні селективні середовища. Кількість рекомбінантів за кожним маркером донора виражається у відсотках від числа клітин штаму Hfr у кон’югаційній суміші.
Процес кон ’югації у бактерій Escherihia coli був відкритий у 1946 р. Дж. Ледербергом і Е. Тейтумом. У бактерій E. coli клітина-донор (чоловіча клітина) має продовгувату форму, а клітина-реципієнт (жіноча клітина) – заокруглену. Клітина-донор утворює статеві ворсинки (пілі), які притягують її до клітини-реципієнта і створюють цитоплазматичний канал, через який ДНК із клітини-донора переходить у клітину-реципієнт.
Існує три типи клітин-донорів: F+ (еф–плюс), Hfr (ейч–еф–а) и F′ (еф– прім). Клітини F+ мають у цитоплазмі статевий фактор – специфічну F-плазміду (фактор фертильності, фактор переносу або F-фактор). Клітини Hfr – мають інтегровану у бактеріальну хромосому F-плазміду. F′-клітини мають F-плазміду, яка містить частину хромосомних генів.
Клітина-реципієнт не містить F-плазміди і її позначають як F–-клітина. F– плазміда має довжину біля 100 т.п.н. На даний момент вивчено більше 60 генів F– плазміди, зокрема таких , які відповідають за її автономну реплікацію (гени rep), здатність забезпечувати перенесення генетичного матеріалу в процесі кон’югації (гени rep), несумісність з іншими плазмідами (гени inc) та ін.
Одна із основних властивостей F-плазміди полягає у тому, що вона забезпечує бактеріальні клітини здатністю бути донорами генетичного матеріалу (кон’югативність), тобто можливість вступати у кон’югацію з безплазмідними (реципієнтними) клітинами і передавати їм певну генетичну інформацію. Ця властивість F-плазміди детермінується генетичною областю tra (від англійського transfer – перенесення), яка містить більше 20 tra-генів. В залежності від контролюємих ними функцій tra-гени F-плазміди класифікують на кілька груп.
Гени однієї tra-групи кодують білки , що необхідні для синтезу на поверхні клітини E.coli специфічних ниткоподібних структур – статевих пілей (1 – 3 пілі на клітину). Статеві пілі забезпечують формування первинного кон’югаційного контакта клітини-донора і клітини-реципієнта.
Інші гени tra-області детермінують синтез білків, що забезпечують метаболізм самого процесу кон’югації і переносуДНК. До них відносяться ферменти ендонуклеази, які розрізають кільцеву молекулу плазмідної ДНК, перетворюючи її у лінійну структуру, що є обов’язковою умовою для перенесення такої молекули із клітини-донора до реципієнтної клітини.
Завдання на виконання
1. Визначаючи порядок розташування локусів pro, trp, his у хромосомі E. coli К12 за градієнтом їхньої передачі рекомбінантам, батьківські штами попередньо пересівають із розсівів на чашках з повним агаризованим середовищем в пробірки 22x200 мм з 2 мл повного середовища (рис. 7.1 ). Бажано, щоб концентрація бактерій в інокуляті була близька до 105 клітин/мл. Пробірки розміщують на ніч у термостаті з температурою 37 °С. Перед використанням у дослідах нічні культури підрощують у свіжому повному середовищі, для чого
|
|
|
|
Нічна культура E. coli |
|
|
67 |
||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
Hfr |
|
|
|
|
F– |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
ПС 2 мл |
|
|
|
|
ПС 2 мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
0,5 мл |
|
8 мл ПС |
||||||||||||
|
|
2 мл |
|
|
|||||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 мл ПС |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ресуспендування |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
4,5 мл ПС, |
|
|
37 °C, 1,5 год |
, |
||||||
|
|
|
|
37 °C, 1,5 год |
|
|
|
|
|
|
|
37°C |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]()
0,5 мл
0,5 0,5
|
Селективнісередовища |
|
|
|
|
0,5 |
0,5 |
0,5 |
0,5 |
1 мл
Hfr
|
|
2 мл
F–
Центрифугування, 6000 об/хв.,10 хв.
Злив надосадової рідини
Колба, 50 мл
~ 30 об/хв.,
37 °C
Фосфатний буфер,
4,5 мл × 7
-
0,5
0,5
0,5
0,5
0,5
-
ПА
Фосфатний буфер,
4,5 мл × 5
Селективнісередовища
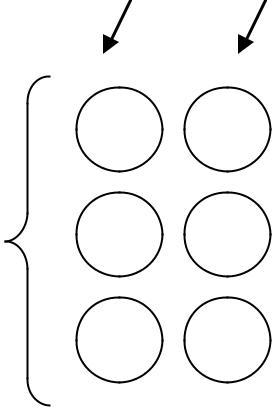
Рис. 7.1. Схема проведення кон’югаційного схрещування E. coli (картування за градієнтом передання маркерів, ПА – повне агаризоване, ПС – повне середовище)
68
нічну культуру штаму F– розбавляють в п’ять разів додаванням 8 мл підігрітого до температури 37 °С повного середовища. Суспензію штаму Hfr розбавляють в десять разів: 0,5 мл культури вносять до 4,5 мл підігрітого повного середовища в пробірці 22×200 мм. Пробірки маркують, вміщують на качалку й інкубують при температурі 37 °С упродовж 1,5 години.
-
Культуру відразу переносять у стерильну центрифужну пробірку. Бактерії осаджують центрифугуванням при обертовій частоті 6000 об/хв упродовж 10 хв і ресуспендують у 2 мл свіжого підігрітого повного середовища. Така підготовка культур потрібна, оскільки для схрещування можуть бути використані тільки молоді бактеріальні культури, які активно ростуть. При цьому концентрація клітин F– у кон’югаційній суміші має значно перевищувати концентрацію клітин
Hfr.
-
Для схрещування в колбу Ерленмейєра місткістю 50 мл вносять 2 мл згущеної суспензії клітин F– і 1 мл суспензії Hfr. Колбу вміщують на термостатовану качалку, що м'яко (n = 30–33 обертів або коливань за хвилину) перемішує суспензію. Схрещування проводять протягом 1,5 год при температурі
37 °С.
-
Під час схрещування визначають концентрацію життєздатних клітин у суспензії Hfr. Для цього із пробірки з суспензією Hfr проводять десятикратну серію розведень у буфері, і три проби по 0,1 мл з останнього розведення висівають на чашки з повним агаризованим середовищем. Чашки вміщують у термостат з температурою 37 °С на 24 години.
-
Під час схрещування перевіряють батьківські штами: слід переконатися у нездатності клітин обох штамів утворювати колонії на селективних середовищах SB,TH; SB,PH; SB,TP. Можна перевірити й генотипи батьківських штамів. Для цього, крім перерахованих, потрібні ще два середовища: мінімальне середовище із тіаміном (без стрептоміцину) і SB,TH зі стрептоміцином, тіаміном, проліном, триптофаном і гістидином. У цьому разі клітини Hfr відмивають від повного середовища.
-
Клітини F– попередньо відмивають від повного середовища: 10 мл культури центрифугують при обертовій частоті 6000 об/хв, і отриманий осад ресуспендують в тому ж об'ємі мінімального середовища або буфера. Отриману суспензію можна використовувати всією групою. Клітини Hfr відмивати від повного середовища не обов'язково. Із суспензій обох штамів відбирають проби по 0,1 мл і висівають без розведення на чашки із селективним середовищем (по одній чашці кожного середовища на культуру).
-
Після закінчення схрещування проводять десятикратні серійні розведення кон’югаційної суміші в буфері до розведення 10–4. По три проби по 0,1 мл з розведень 10–3 і 10–4 висівають на чашки із селективними середовищами (по три чашки на кожне розведення): SB,TH; SB,PH; SB,TP. Засіяні чашки поміщають у термостат з температурою 37 °С на 40 – 48 годин.
69
Опрацювання результатів
Через дві доби чашки із селективними середовищами, засіяними на попередньому занятті вихідними штамами Hfr і F–, переглядають на відсутність росту цих штамів.
Проводять підрахунок колоній рекомбінатів на чашках із селективними середовищами й колоній Hfr на чашках c повним агаризованим середовищем. Розраховують концентрації клітин Hfr і рекомбінантів pro+str–r, trp+str–r, his+str–r у кон’югаційній суміші. Частоту утворення рекомбінантів виражають у відсотках від числа клітин Hfr введених у схрещування. Результати вносять у табл. 7.1.
Таблиця 7.1
Частота утворення рекомбінантних клітин E. coli
|
|
|
Розведення, |
Кількість |
Концентрація |
Вміст |
|
Середо- |
Відібрані |
клітин у |
рекомбінантів |
||
|
що |
колоній на |
||||
|
вище |
рекомбінанти |
кон’югованій |
на 100 клітин |
||
|
висівають |
чашці |
||||
|
|
|
суміші |
Hfr |
||
|
|
|
|
|
||
|
SB, TH |
|
|
|
|
|
|
SB, PH |
|
|
|
|
|
|
SB, TP |
|
|
|
|
|
|
ПА |
Штам Hfr |
|
|
|
|
На підставі отриманих даних визначають порядок розташування аналізованих маркерів на хромосомі E. coli К12 Hfr str–s × F– pro+, trp+, his+, str–r за градієнтом передання маркерів донора рекомбінантам.
Контрольні запитання
-
Що таке кон’югація? Чим вона обумовлена?
-
Чим характеризується перенесення ДНК від донорної до реципієнтної клітини?
-
Які ви знаєте типи клітин-донорів, здатних до кон’югації?
-
Охарактеризуйте методики генетичного аналізу, в основі яких лежить процес кон’югації.
-
Як ви уявляєте собі генетичну карту мікроорганізмів? Що вона відображає? Якими методами вивчають генетичну карту мікроорганізмів?
-
Які основні принципи побудови генетичної карти?
-
Що означає поняття "локус"? Що означає поняття "рекомбінація"?
-
Яким способом можна визначити рекомбінантну клітини?
-
Які основні принципи постановки дослідів з кон'югації мікроорганізмів?
10. Як здійснюють облік і аналіз кон’югантів?
Література: [1, 2, 3, 8, 10, 11, 12].
70
ЛАБОРАТОРНЕ ЗАНЯТТЯ 8
МЕТОДИ ВИДІЛЕННЯ ДНК ІЗ КЛІТИН МІКРООРГАНІЗМІВ Мета: ознайомлення з методами підготовки і руйнування бактеріальних
клітин для виділення нуклеїнових кислот; опанування методу виділення плазмідної ДНК.
Обладнання та матеріали: центрифуга з частотою обертів 6000 та 10000 об/хв; качалка; буферний розчин 0,01 M тріс-HCl, 0,15 М NaCl, 0,1 М ЕДТА (БР І, рН 8,0); буферний розчин 0,01 M тріс-HCl, 2 М NaCl, 0,1 М ЕДТА (БР ІІ, рН 8,0); БР І, що містить лізоцим у концентрації 2 мг/мл; розчин з 0,15 М NaCl і 0,015 М цитрату натрію (стандартний сольовий розчин – ССР); 5% розчин додецилсульфату натрію (ДСН); суміш хлороформ – октиловий спирт, ХОС (9:1) або суміш хлороформ – ізоаміловий спирт, ХІС (24:1); хлороформ–ССР (1:10); розчин панкреатичної РНКази (0,4 мг/мл); 96 % і 70 % етанол; хімічна склянка на 50 – 100 мл; стерильні піпетки; пробірки із притертою пробкою; штам Bacillus subtilis 23, вирощений на глюкозо-сольовому середовищі (або середовищі Спіцайзена) з доданням бульйону Хоттингера (10 %).
Загальні відомості
Останнім часом зростає попит на високоякісні препарати нуклеїнових кислот. Це зумовлено насамперед розширенням сфери їхнього застосування у різних галузях:
-
у фундаментальних дослідженнях: біологія, космобіологія, молекулярна медицина, фармакологія тощо;
-
у сільському господарстві: створення генетично модифікованих рослин і тварин;
-
у новітніх галузях біо- та нанотехнології: генетична інженерія, біосенсори, виробництво напівпровідників (нові матеріали) та засобів біоінформатики тощо. Отримання нативних (недеградованих) та високоочищених препаратів ДНК і РНК є попереднім дуже важливим етапом молекулярного клонування.
При виділенні ДНК і РНК з різних біологічних об'єктів виникає проблема отримання максимальної кількості високоякісних молекул нуклеїнових кислот за мінімальних витрат часу, коштів і вихідного матеріалу. Зрозуміло, що досягнути цього дуже складно. Зумовлено це, насамперед, значними труднощами отримання інтактних препаратів нуклеїнових кислот з клітин про- і еукаріотів. Клітини багатьох мікро- і макроорганізмів характеризуються низьким сумарним вмістом нуклеїнових кислот та високою нуклеазною активністю, наявністю великої кількості білків, полісахаридів, танінів, пігментів, позбутися яких часто буває дуже складно. Наявність таких забруднень у препаратах нуклеїнових кислот значно обмежує, а іноді й унеможливлює їх подальше використання.
Нині розроблено багато методів одержання якісних препаратів нуклеїнових кислот, проте жоден з них не може претендувати на універсальність. Саме це спонукає дослідників модифікувати існуючі методи або розробляти нові підходи
71
до виділення якісних препаратів нуклеїнових кислот з певного біологічного об'єкту.
Якісними препаратами нуклеїнових кислот вважають достатньо очищені та високополімерні молекули ДНК і РНК. Ступінь деградації цих біополімерів залежить переважно від трьох основних чинників: дії клітинних нуклеаз, механічної руйнації нуклеїнових кислот у процесі виділення та біологічного віку вихідного біоматеріалу. Онтогенез (розвиток) будь-якого організму супроводжується неминучим процесом його старіння, внаслідок чого в клітинах відбувається поступова фрагментація ДНК, що спричиняє значне зниження кількості отриманої високополімерної нуклеїнової кислоти. Це слід ураховувати, обираючи джерело отримання нуклеїнових кислот.

 Селективнісередовища
Селективнісередовища