
Подгруппа кобальта
К обальт
Со, родий Rh
и иридий Ir
— полные электронные аналоги.
обальт
Со, родий Rh
и иридий Ir
— полные электронные аналоги.
По сравнению с элементами подгруппы железа и кобальта и его аналогов происходит дальнейшее спаривание (n—1)d-электронов и стабилизация (n—1)d-подслоя. Поэтому высшая степень окисления кобальта и его аналогов оказывается ниже, чем у рутения и осмия, для кобальта наиболее типичны степени окисления +2 и +3, а для иридия степени окисления +3 и +4 примерно- равноценны, Получены также соединения родия (VI) и иридия (VI). для элементов подгруппы устойчивы координационные числа 6 и 4.
На Земле кобальт и родий встречаются в виде одного, а иридий — двух стабильных изотопов. Получено большое число их искусственных радиоактивных изотопов. Из последних важнейший 60Со (период полураспада 5,24 года), получаемый по реакции 59Со(n, )60Сo
Изотоп 60Со получал широкое применение в медицине в борьбе с раком («кобальтовая пушка»).
Чисто кобальтовые руды встречаются редко. Относительно более распространен минерал кобальтин (кобальтовый блеск СоАsS). Кобальт содержится в некоторых медных, никелевых, серебряных, железных, марганцевых и полиметаллических рудах, в животных и растительных организмах.
Иридий чаще всего встречается в виде сплава с осмием (осмистый иридий), а также, как и родий, в самородной платине и в медно-никелевых полиметаллических рудах.
П ростые
вещества. В
виде простых веществ кобальт, родий и
иридий — блестящие белые металлы: Со с
сероватым, Rh
и Ir
с серебристым оттенком. По сравнению с
железом кобальт более тверд и хрупок.
Особо высокой твердостью отличаются
родий и иридий. Основные константы Со,
Rh
и Ir.
приведены ниже:
ростые
вещества. В
виде простых веществ кобальт, родий и
иридий — блестящие белые металлы: Со с
сероватым, Rh
и Ir
с серебристым оттенком. По сравнению с
железом кобальт более тверд и хрупок.
Особо высокой твердостью отличаются
родий и иридий. Основные константы Со,
Rh
и Ir.
приведены ниже:
Кобальт имеет две аллотропные модификации. До 417 °С устойчив -Со (гексагональная решетка); выше 417 °С — -Со (гранецентрированная кубическая решетка). Родий и иридий кристаллизуются в гранецентрированной кубической решетке.
По химической активности кобальт несколько уступает железу. В обычных условиях он довольно устойчив, например кислородом начинает окисляться лишь при 300 °С. При нагревании взаимодействует почти со всеми неметаллами, образуя, как и железо, от соединений солеподобных (СоНаl2) до соединений металлического типа (Со3С, Со2В, Со2N), а также твердые растворы (с Н, В, О). По отношению к кислотам кобальт также несколько устойчивее железа. С щелочами практически не взаимодействует.
Р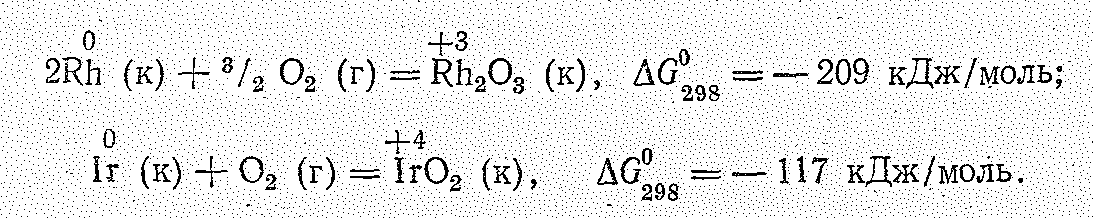 одий
и особенно иридий отличаются высокой
химической устойчивостью. С неметаллами
они взаимодействуют в мелкораздробленном
состоянии при температуре красного
каления. Так, на воздухе Rh
начинает окисляться лишь при 600 °С, а Ir
– выше 1000 °С:
одий
и особенно иридий отличаются высокой
химической устойчивостью. С неметаллами
они взаимодействуют в мелкораздробленном
состоянии при температуре красного
каления. Так, на воздухе Rh
начинает окисляться лишь при 600 °С, а Ir
– выше 1000 °С:
В отличие от других благородных металлов компактные Rh и Ir практически не растворяются ни в одной из кислот и их смесей. Условия для перевода Rh и Ir в растворимые в воде производные хлорокомплексов создаются хлорированием при температуре красного каления смеси мелкораздробленного металла и NаСl:
Ir0 + 2Cl2 + 2NаСl = Nа2[Ir+4Сl6]
С соответствующими металлами кобальт, родий и иридий образуют твердые растворы и интерметаллические соединения, что определяет физико-химические и механические свойства их сплавов. Особо широко используются кобальтовые сплавы. Многие из них жаропрочны и жаростойки. Например, сплав виталлиум (65% Со, 28% Сr, 3% Ni и 4% Мо), применяемый для изготовления деталей реактивных двигателей и газовых турбин, сохраняет высокую прочность и практически не подвергается газовой коррозии вплоть до 800—900 °С. Имеются также кислотоупорные сплавы, не уступающие платине. Кобальтовые сплавы типа алнико (например, 50% Fе, 24% Со, 14% Ni, 9% Аl и 3% Сu) применяются для изготовления постоянных магнитов. Для изготовления режущего инструмента важное значение имеют так называемые сверхтвердые сплавы, представляющие собой сцементированные кобальтом карбиды вольфрама (сплавы ВК) и титана (сплавы ТК). Большое значение имеет кобальт как легирующая добавка к сталям.
Кобальт обычно получают переработкой полиметаллических руд. Рядом последовательных пирометаллургических операций выделяют Со3О4, который затем восстанавливают углем, водородом, иногда методом алюмотермии. Особо чистый кобальт получают электролитическим рафинированием, а также термическим разложением некоторых его соединений. Основная масса производимого кобальта используется для получения сплавов; его применяют для электролитического покрытия металлических деталей.
Области применения родин и иридия определяют их большая коррозионная стойкость и высокая твердость. Из них изготавливают ответственные детали контрольно-измерительных приборов. Родий, обладающий высокой отражательной способностью, используется в зеркалах и рефлекторах. Платино-родиевые сплавы применяются в качестве катализаторов окисления аммиака в производстве азотной кислоты.
