
билеты 19
.pdf
3.Энтропийный фактор, как и первые два относится к термодинамическим. Он дополняет первые два фактора и действует в системах, в которых частицы или их поверхностные слои участвуют в тепловом движении.
4.Структурно-механический фактор является кинетическим. Его действие обусловлено тем, что на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью, разрушение которых требует затраты энергии и времени.
5.Гидродинамический фактор снижает скорость коагуляции благодаря изменению вязкости среды и плотности дисперсной фазы и дисперсионной среды.
6.Смешанные факторы наиболее характерны для реальных систем. Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно.
Коагуляция протекает в термодинамически неустойчивых (лиофобных) дисперсных системах, и об агрегативной устойчивости таких систем судят по скорости коагуляции.
Коагуляция может происходить как без внешнего воздействия на систему, так и при повышении температуры, межаническом, электрическом или другом воздействии, а в случае золей – при ведении коагулянтов, например электролитов.
Принято считать, что типичные лиофобные системы агрегатнвно устойчивы благодаря проявлению электростатического фактора стабилизации и коагулируют при введении в
систему сравнительно небольших количеств любых электролитов. Наименьшая концентрация электролита см, при которой начинается коагуляция (медленная), называется
порогом коагуляции. Для осуществления быстрой коагуляции требуется такая концентрация электролита сб, после увеличения которой скорость коагуляции остается постоянной (когда фактор устойчивости W=1, или потенциальный барьер E = 0).
Зависимость скорости коагуляции от концентрации электролита показана на рисунке. Из этого рисунка следует, что введение электролита в дисперсную систему снижает потенциальный барьер, который при быстрой коагуляции (максимальной скорости) становится равным нулю. Порог коагуляции существенно зависит от момента его фиксирования, от метода наблюдения за коагуляцией (изменение интенсивности рассеяния света, реологических свойств и др.) и от концентрации золя, поэтому необходимо всегда подробно указывать условия определения этой величины.
В соответствии с теорией ДЛФО введение электролита в дисперсную систему вызывает сжатие двойного электрического слоя на поверхности частиц, вследствие чего они могут подойти друг к другу на расстояния, на которых преобладают силы притяжения. Уменьшение толщины двойного слоя сопровождается обменом противоионов этого слоя на вызывающие коагуляцию ионы электролита.
Закон Дерягина: J
При высоких потенциалах порог быстрой коагуляции по теории ДЛФО не зависит от потенциала и обратно пропорционален заряду противоиона в шестой степени, что хорошо обосновывает известное эмпирическое правило Шульце — Гарди. По правилу Шульце — Гарди значения порогов коагуляции для электролитов с зарядами противоионов 1, 2, 3 находятся в соотношении 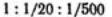 .
.

Чтобы обеспечить агрегативную устойчивость дисперсных систем, частицы которых имеют лиофобную поверхность, применяют стабилизаторы, способствующие увеличению межфазного взаимодействия. В качестве таких стабилизаторов широко применяют ПАВ и ВМС (имеющие неполярные и полярные части молекул), лиофилизируюшие поверхность частиц дисперсной фазы.
Стабилизацию лиофобных дисперсных систем с помощью лнофильных коллоидов (в первую очередь, ВМС) называют защитным действием стабилизаторов — коллоидной защитой.
3.Определите удельную поверхность (м2/г) монодисперсного порошка оксида алюминия, если известно, что его частицы сферической формы оседают в водной среде с высоты 20 см за 1600 секунд. Плотность оксида алюминия равна 4 г/см3, плотность и вязкость воды составляют 1 г/см3 и 10-3 Па·с, соотвстственно.
Билет 17
1.Количественные характеристики пористых материалов: пористость, удельная поверхность, размер пор. Пористые тела корпускулярной, кристаллической и губчатой структуры, методы их получения. Классификации пор по Дубинину и теория адсорбции.
Пористые тела — это твердые тела, внутри которых имеются поры, обусловливающие наличие внутренней межфазной поверхности. Поры могут быть заполнены газом или жидкостью.
Высокодисперсные пористые неорганические материалы, в частности, адсорбенты и катализаторы, получают в основном двумя методами. Один из них заключается в синтезе гидрозоля с последующей его коагуляцией для образования геля; гель высушивают. Частицы дисперсной фазы (корпускулы) в результате этих операций срастаются с образованием твердого каркаса. Так как частицы золя высокодисперсны, то получаемый пористый материал имеет большую удельную поверхность. Таким методом получают адсорбенты корпускулярной структуры.
Второй метод получения высокодисперсных пористых адсорбентов и катализаторов заключается в обработке крупнопористых материалов агрессивными газами или жидкостями. При такой обработке получаются пористые тела губчатой структуры.
Наибольшее распространение получила классификация пористых тел, предложенная M. M. Дубининым. По этой классификации за основу приняты размеры пор и механизм
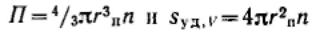
протекающих в них адсорбционных процессов. По классификации M. M. Дубинина пористые тела делятся на макропористые, переходнопористые, микропористые в
зависимости от линейного размера, под которым понимают полуширину для щелевидной поры или радиус для сферической или цилиндрической поры.
Макропористые тела имеют поры радиусом больше 100,0 — 200,0 нм, удельная поверхность макропористых тел находится в пределах 0,5 — 2 м2/г. В связи с тем, что такие поры намного больше адсорбируемых молекул, то их стенки по сравнению с молекулами можно рассматривать как ровные поверхности, поэтому для макропористых тел применима обобщенная теория адсорбции Ленгмюра.
Переходнопористые тела (или капиллярно-пористые, или мезопористые) имеют размеры пор в пределах от 1,5 до 100,0 — 200,0 нм их удельная поверхность составляет от 10 до 500 м2/г. Ha стенках этих пор при малых давлениях происходит полимолекулярная адсорбция паров, которая с увеличением давления заканчивается капиллярной конденсацией.
Микропористые тела обладают порами, соизмеримыми с размерами адсорбируемых молекул. Радиусы пор лежат в пределах от 0,5 до 1,5 нм. Удельная поверхность таких тел 500
— 1000 м2/г и выше. Отличительной чертой микропор является настолько близкое расположение противоположных стенок, что их поля поверхностных сил перекрываются и они действуют во всем объеме микропор.
Одной из основных характеристик пористой структуры тела является пористость —
отношение объема пор Vп к общему объему тела Vобщ: 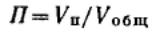
Если принять, что поры в пористых телах и порошках имеют правильную форму, то их размеры можно оценить, зная пористость и удельную поверхность:
Для определения пористости и удельной поверхности пористых тел широко используются адсорбционные методы.
2.Лиофобные дисперсные системы. Факторы агреативной устойчивости лиофобных систем. Быстрая и медленная коагуляция. Кинетика коагуляций по Смолуховскому (вывод уравнения). Определение константы скорости и времени половинной коагуляции. Зависимость числа частиц разного порядка от времени.
Все дисперсные системы в зависимости от механизма процесса их образования по классификации П. А. Ребиндера подразделяют на лиофильные, которые получаются при самопроизвольном диспергировании одной из фаз (самопроизвольное образование гетерогенной свободнодисперсной системы), и лиофобные, получающиеся в результате диспергирования и конденсации с пересыщением (принудительное образование гетерогенной свободноднсперсной системы).
Различают следующие термодинамические и кинетические факторы устойчивости дисперсных систем:
1.Электростатический фактор заключается в уменьшении межфазного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц в соответствии с уравнением Липпмана.
2.Адсорбционно-сольватный фактор состоит в уменьшении межфазного натяжения при взаимодействии частиц дисперсной фазы со средой (благодаря адсорбции и сольватации)
3.Энтропийный фактор, как и первые два относится к термодинамическим. Он дополняет первые два фактора и действует в системах, в которых частицы или их поверхностные слои участвуют в тепловом движении.

4.Структурно-механический фактор является кинетическим. Его действие обусловлено тем, что на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью, разрушение которых требует затраты энергии и времени.
5.Гидродинамический фактор снижает скорость коагуляции благодаря изменению вязкости среды и плотности дисперсной фазы и дисперсионной среды.
6.Смешанные факторы наиболее характерны для реальных систем. Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно.
Коагуляция протекает в термодинамически неустойчивых (лиофобных) дисперсных системах, и об агрегативной устойчивости таких систем судят по скорости коагуляции. Смолуховским была рассмотрена кинетика коагуляции монодисперсных золей со сферическими частицами, которые сталкиваются между собой в результате броуновского движения. Критическое расстояние, на котором осуществляется взаимодействие между частицами, принято приблизительно равным сумме радиусов частиц, что соответствует непосредственному их контакту. Согласно представлениям Смолуховского при коагуляции происходят взаимодействия только между двумя частицами, так как вероятность одновременного столкновения большого числа частиц очень мала. Таким образом, сталкиваются частицы одиночные, образуя двойные, одиночные с двойными, двойные друг с другом, тройные с одиночными и т. д. Такое представление процесса коагуляции позволяет формально применить к нему теорию бимолекулярных химических реакций. Относительное смещение двух частиц. n— m с коэффициентом относительной диффузии Dnm связано законом Эйнштейна — Смолуховского:
В соответствии с первым законом Фика поток через сферическую поверхность s выражается уравнением
Интегрируя уравнение данное после разделения переменных в пределах от Rnm до ∞ и соответственно от 0 до νn, получим:
Данное уравнение отражает также число столкновении на данной стадии процесса коагуляции, т. е. число частиц, сталкивающихся в единицу времени с одной центральной частицей. Общее число столкновений между частицами в системе в единицу времени в данный момент составляет .
Чтобы рассчитать скорость уменьшения числа частиц в результате коагуляции, т. е. скорость коагуляции, необходимо принять, что все столкновения приводят к агрегации. Необходимо учесть стерический множитель P, учитывающий благоприятные пространственные расположения частиц при столкновении, их форму, размеры. Тогда скорость коагуляции в данный момент времени составит:

Сравнение с уравнением для скорости бимолекулярной реакции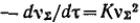 , показывает, что константа скорости коагуляции выражается следующим соотношением:
, показывает, что константа скорости коагуляции выражается следующим соотношением:
Общее число частиц в результате коагуляции уменьшается. Чтобы определить, каким оно будет через время τ, необходимо провести интегрирование в пределах от ν∑ = ν0 при τ = 0 до ν∑ при τ:
Константу скорости коагуляции теоретически определить трудно, поэтому Смолуховский ввел понятие времени (периода) половинной коагуляции θ — времени коагуляции, в течение которого общая концентрация частиц уменьшается до половины от начальной концентрации первичных (единичных) частиц. Из уравнения общего числа частиц следует: и .
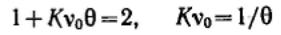 и
и 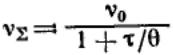
Общее число частиц ν∑ в единице объема системы представляет собой уменьшающуюся в процессе коагуляции сумму частиц всех порядков:
Этот ряд является суммой геометрической прогрессии со знаменателем
Отсюда легко определить число частиц каждого порядка (m-мерных):
Согласно теории кинетики коагуляции различают быструю и медленную коагуляцию. Для такого разделения можно воспользоваться уравнением константы скорости коагуляции. При быстрой коагуляции все столкновения частиц эффективны, т. е. приводят к слипанию частиц. При медленной коагуляции это утверждение не соблюдается.
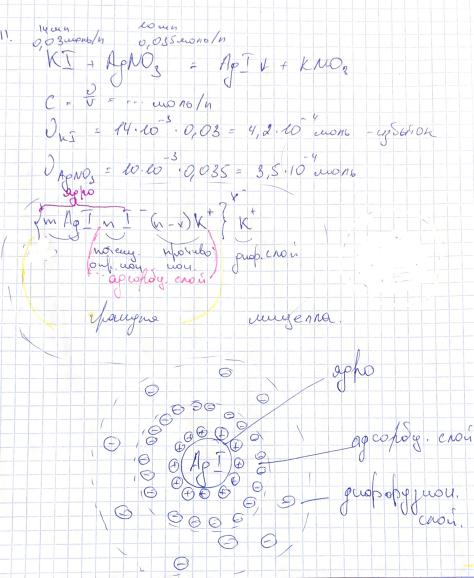
3.Гидрозоль AgI получен добавлением 14 мл КI с концентрацией 0,03 моль/л к 10 мл
раствора AgNO3 с концентрацией 0,035 моль/л. Напишите формулу мицеллы образовавшегося золя и объясните строение ДЭС.
Билет 20
1.Классификация механизмов адсорбции. Природа адсорбционных сил и их особенности при физической адсорбции. Вывод уравнения для энергии дисперсионного взаимодействия атома адсорбата с адсорбентом. Изотерма, изостера, изопикна адсорбции.
Процессы адсорбции классифицируют в соответствии с типом взаимодействия адсорбата с адсорбентом. Физико-химическая классификация основывается на том положении, что перераспределение компонентов между объемной фазой и поверхностным слоем может происходить под действием физических сил или в результате химической реакции между адсорбатом и адсорбентом. Химическую реакцию в этом случае можно представить либо как химическое присоединение атомов (молекул), либо как ионообменное взаимодействие. Таким образом, согласно физико-химической классификации различают физическую (молекулярную) адсорбцию, хемосорбцию (химическое присоединение атома, молекулы) и ионный обмен.
При физической адсорбции взаимодействие адсорбента и адсорбата осуществляется за счет сил Ван-дер-Ваальса и водородных связей. Эти адсорбционные силы обеспечивают притяжение атомов (молекул); на очень близком расстоянии проявляются короткодействующие силы отталкивания.
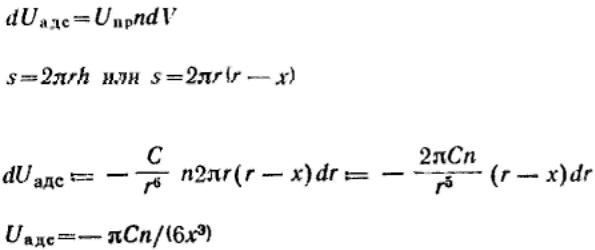
При химической адсорбции между адсорбатом и адсорбентом образуется химическая связь, и они теряют индивидуальность.
Для молекул с небольшими дипольными моментами основной вклад в энергию взаимодействия вносят дисперсионные силы. Характерно, что для всех трех составляющих сил Ван-дер-Ваальса выполняется один и тот же закон изменения энергии притяжения от
расстояния:  .
.
Так как общая энергия взаимодействия при адсорбции Uадс определяется суммой энергии взаимодействия адсорбированного атома со всеми атомами в объеме адсорбента, то
Величину dV можно определить через поверхность шарового сегмента:
Тогда 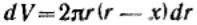 Подставляя, получим:
Подставляя, получим:
Проведем интегрирование в пределах расстояния от r = х до r = ∞ и окончательно получим:
Зависимость величины адсорбции от концентрации (или парциального давления) вещества при постоянной температуре называется изотермой адсорбции.
Зависимость величины адсорбции от температуры прв постоянной концентрации (или парциальном давлении) вещества называется изопикной (или изобарой) адсорбции. Зависимость концентрации (или парциального давления) вещества в объеме от температуры при постоянной величине адсорбции называется изостерой адсорбции.
2.Два вида устойчивых дисперсных систем. Лиофильные и лиофобные системы. Критерий лиофильности по Ребиндеру-Щукину. Факторы агрегативной устойчивости дисперсных систем. Пример лиофольных и лиофобных дисперсных систем.
По предложению Н. П. Пескова устойчивость дисперсных систем подразделяют на два вида: устойчивость к осаждению дисперсной фазы и устойчивость к агрегации ее частиц. Первый вид устойчивости характеризует способность дисперсной системы сохранять равномерное распределение частиц дисперсной фазы по объему дисперсионной среды, или ее устойчивость к разделению фаз - седиментационная устойчивость. Второй вид устойчивости - агрегативная устойчивость (устойчивость к слипанию) дисперсных систем.
Все дисперсные системы в зависимости от механизма процесса их образования по классификации П. А. Ребиндера подразделяют на лиофильные, которые получаются при самопроизвольном диспергировании одной из фаз (самопроизвольное образование гетерогенной свободнодисперсной системы), и лиофобные, получающиеся в результате диспергирования и конденсации с пересыщением (принудительное образование гетерогенной свободноднсперсной системы).
Различают термодинамические и кинетические факторы агрегатнвной устойчивости дисперсных систем. Так как движущей силой коагуляции является избыточная поверхностная энергия, то основными факторами, обеспечивающими устойчивость дисперсных систем (при сохранении размера поверхности), будут те, которые снижают поверхностное натяжение. Эти факторы относят к термодинамическим. Они уменьшают
вероятность эффективных соударений между частицами, создают потенциальные барьеры, замедляющие или даже исключающие процесс коагуляции.
Кинетические факторы, снижающие скорость коагуляции, связаны в основном с гидродинамическими свойствами среды: с замедлением сближения частиц, вытекания и разрушения прослоек среды между ними.
Различают следующие термодинамические и кинетические факторы устойчивости дисперсных систем:
1.Электростатический фактор заключается в уменьшении межфазного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц в соответствии с уравнением Липпмана.
2.Адсорбционно-сольватный фактор состоит в уменьшении межфазного натяжения при взаимодействии частиц дисперсной фазы со средой (благодаря адсорбции и сольватации)
3.Энтропийный фактор, как и первые два относится к термодинамическим. Он дополняет первые два фактора и действует в системах, в которых частицы или их поверхностные слои участвуют в тепловом движении.
4.Структурно-механический фактор является кинетическим. Его действие обусловлено тем, что на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью, разрушение которых требует затраты энергии и времени.
5.Гидродинамический фактор снижает скорость коагуляции благодаря изменению вязкости среды и плотности дисперсной фазы и дисперсионной среды.
6.Смешанные факторы наиболее характерны для реальных систем. Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно.
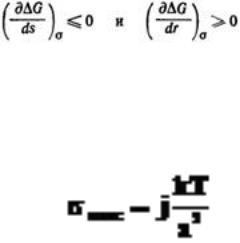
Условие термодинамической агрегатнвной устойчивости дисперсной системы можно записать так:
Это означает, что энергия Гиббса не должна увеличиваться с ростом межфазной поверхности (при постоянном межфазном натяжении) или с уменьшением размеров частиц. Межфазная поверхность может самопроизвольно возрастать, только если поверхностная энергия будет компенсироваться увеличением энтропии системы. Такое явление получило название самопроизвольного диспергирования.
Из этих положений следует уравнение самопроизвольного диспергирования Ребиндера-
Щукина: J |
. |
3.Используя гипсометрический закон, рассчитайте для золя SiO2 высоту, на которой концентрация частиц уменьшится в е раз. Принять, что форма частиц сферическая,
удельная поверхность дисперсной фазы 108 м-1, плотность SiO2 2,2 г/cм3, плотность дисперсионной среды 1 г/cм3, температура 20 ºС.

P
Билет 21
1.Методы получения дисперсных систем: диспергирование и конденсация. Уравнение Ребиндера для работы диспергирования. Адсорбционное понижение прочности (эффект Ребиндера). Конденсация физическая и химическая. Энергия Гиббса образования зародыша новой фазы при гомогенной конденсации; роль пересыщения.
Диспергирование и конденсация — методы получения свободно-дисперсных систем: порошков, суспензий, золей, в том числе аэрозолей, эмульсий и т. д. Под диспергированием понимают дробление и измельчение вещества, под конденсацией — образование гетерогенной дисперсной системы из гомогенной в результате ассоциации молекул, атомов или ионов в агрегаты.
Работа упругого и пластического деформирования пропорциональна объему тела:
Работа образования новой поверхности при диспергировании пропорциональна приращению
поверхности: 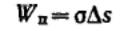
Полная работа, затрачиваемая на диспергирование, выражается уравнением Ребиндера:
Разрушение материалов может быть облегчено при использовании эффекта Ребиндера — адсорбционного понижения прочности твердых тел. Этот эффект заключается в уменьшении поверхностной энергии с помощью поверхностно-активных веществ, в результате чего облегчается деформирование и разрушение твердого тела.
Процесс конденсации предполагает образование новой фазы на уже имеющихся поверхностях (стенках сосуда, частицах посторонних веществ — ядрах конденсации) или на поверхности зародышей, возникающих самопроизвольно в результате флуктуации плотности и концентраций вещества в системе. В первом случае конденсация называется гетерогенной, во втором — гомогенной.
Чтобы сконденсированное вещество не возвращалось в первоначальную фазу и конденсация продолжалась, исходная система должна быть пересыщенной. В противном случае конденсация не может происходить, исчезают и зародыши конденсации (путем их испарения, растворения, плавления).
При гомогенной конденсации происходит самопроизвольное образование зародышей; энергия поверхности выступает в качестве потенциального барьера конденсации. Энергию Гиббса образования зародышей выражают (в соответствии с объединенным уравнением
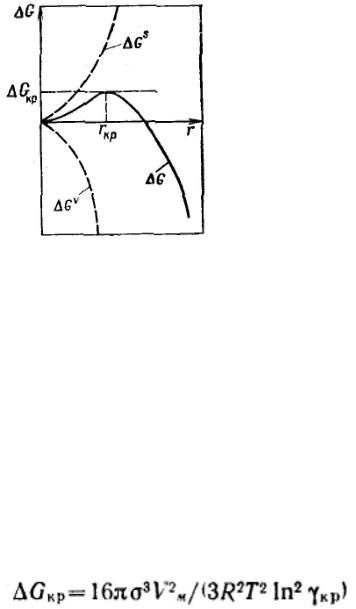
первого и второго начал термодинамики) в виде четырех составляющих: энтропийной, механической, поверхностной и химической.
Для жидких и газообразных фаз можно ограничиться двумя первыми составляющими энергии Гиббса образования зародышей.
Если степень пересыщения меньше критической, то возникающие зародыши самопроизвольно испаряются (растворяются). Их размеры меньше критического, поэтому энергия Гиббса понижается с уменьшением размера зародыша. Пересыщенный раствор или пар в этих условиях иногда удобно представить как гетерогенно-дисперсную систему, в которой присутствует множество постоянно образующихся и исчезающих зародышей новой фазы. В критической точке неустойчивость равновесия проявляется в том, что существует равная вероятность возникновения и исчезновения зародышей конденсации.
Если степень пересыщения больше критической величины, то возникающие зародыши будут самопроизвольно расти.
Критическая энергия Гиббса образования зародышей конденсации соответствует
критической точке — максимуму функции G = f(r): 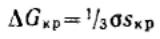
Таким образом, энергия Гиббса образования зародышей при гомогенной конденсации равна одной трети поверхностной энергии зародыша. Если найти радиус зародыша в критической точке, приравняв к нулю первую производную от энергии Гиббса и подставить его в данное выражение, то получим:
Из этого соотношения следует, что энергия образования зародыша конденсации зависит от степени пересыщения, от нее же зависит и размер критического радиуса зародыша. Чем выше степень пересыщения, тем ниже энергия Гиббса образования зародышей и тем меньше размеры образующихся зародышей, способных к дальнейшему росту.
2.Седиментационно-диффузное равновесие. Вывод уравнения(гипсометрический закон Лапласа). Мера седиментационной устойчивости. Факторы, влияющие на седиментационную устойчивость дисперсных систем.
В золях через определенное, иногда очень длительное, время оседания частиц может наступить момент, когда диффузионный поток станет равным седиментационному iдиф = iсед, т.е. наступит диффузионно-седцментационное равновесие. Так как такое равновесие наступает при определенном градиенте концентраций, в системе должно установиться соответствующее распределение дисперсной фазы по высоте. Чтобы определить закон этого
