
- •660025, Г. Красноярск, ул. Вавилова, 66 а
- •1.1.Распространение в природе и получение
- •1.2 Физические свойства
- •Химические свойства
- •Соединения s – металлов
- •1.6.Применение
- •Элементы іііа – группы
- •Распространение в природе и получение
- •Физические свойства
- •Химические свойства
- •Соединения металлов
- •2.1.4. Применение
- •Глава 3. Химия переходных металлов
- •В периоде с ростом z восстановительные свойства металлов уменьшаются, достигая минимума у элементов iв группы (табл.3.1.). Тяжелые металлы viiiв и iв групп за свою инертность названы благородными.
- •3.1. Элементы 1в группы
- •3.1.1. Распространение в природе и получение
- •3.1.2.Физические свойства
- •3.1.3. Химические свойства
- •3.1.4. Соединения металлов
- •3.1.5.Применение
- •3.2. Элементы подгруппы II a
- •3.2.1.Распространение в природе и получение
- •3.2.2.Физические свойства
- •3.2.3. Химические свойства По химическим свойствам Zn и его аналоги менее активны, чем подгруппа Са. В ряду от Zn к Hg-химическая активность металлов уменьшается (см. Табл.3.3.).
- •3.2.4. Соединения металлов
- •3.2.5. Применение
- •3.3. Элементы подгруппы iiia
- •3.3.1. Способы получения
- •3.3.2.Физические и химические свойства
- •3.3.3. Соединения металлов
- •3.3.4. Применение
- •3.4. Элементы подгруппы ivb
- •3.4.1.Распространение в природе и получение
- •3.4.2.Физические свойства
- •3.4.3. Химические свойства
- •3.4.4. Соединения металлов
- •3.4.5. Применение
- •3.5. Элементы подгруппы vb
- •3.5.1.Распространение в природе и получение
- •3.5.1.Физические свойства
- •3.5.2. Химические свойства
- •3.5.4. Cоединения металлов
- •3.5.5.Применение
- •3.6. Элементы подгруппы viв
- •3.6.1. Распространение в природе и получение
- •В промышленности чистый хром получают из хромистого железняка:
- •Вольфрам, молибден получают из соответствующих оксидов, например:
- •3.6.2.Физические свойства
- •3.6.3. Химические свойства
- •3.6.4. Соединения металлов
- •3.6.5. Применение
- •3.8. Элементы подгруппы VII b
- •3.8.1. Распространение в природе и получение
- •3.8.2.Физические свойства
- •3.8.4. Химические свойства
- •3.8.5.Соединения металлов
- •3.8.6. Применение
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5. Применение
- •3.9. Элементы VIII в группы (платиновые металлы)
- •3.9.1. Распространение в природе и получение
- •В виде соединений находятся в Си- Ni сульфидных рудах.
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5.Применение
- •Глава 4. Лантаноиды и актиноиды
- •4.1. Электронные конфигурации атомов лантаноидов и актиноидов и их свойства.
- •4. 1.1.Монотонно изменяющиеся
- •4.1.2.Периодически изменяющиеся свойства
- •4.2.Распространение f - элементов в природе и получение
- •4.3.Разделение смеси соединений лантаноидов (актиноидов)
- •4.3.1.Ионообменная хроматография
- •4. 3.2.Жидкостная экстракция
- •4.3.3.Разделение по изменению степени окисления
- •4.4.Физические свойства
- •4.5.Химические свойства
- •4.6.Соединения f-металлов
- •4.7.Применение
3.6.4. Соединения металлов
Для хрома известны соединения со степенью окисления +2,+3 и +6, молибдена +4,+5 и +6, вольфрама +4 и +6. В ряду хром-молибден-вольфрам возрастает устойчивость соединений в высшей степени окисления.
Оксиды. При нагревании металлов на воздухе в атмосфере О2 образуются оксиды МоО3 и WO3 . Оксид CrO3 кристаллизуется в виде ярко-красных игл при, действии на раствор хроматов или бихроматов концентрированной серной кислоты, например:
K2Cr2O7 + H2SO4(конц) = 2CrO3 + K2SO4 + H2O
Все оксиды - кристаллические вещества, обладающие амфотерными свойствами. В ряду оксидов:
CrO3 МоО3 WO3
крас. бел. желт.
увеличение основных свойств

увеличение устойчивости оксидов
уменьшение окислительных свойств
кислотные свойства уменьшаются. Они растворяются в щелочах, образуя соли хроматы, вольфроматы, молибдаты:
МоО3 + 2КОН = К2МоО4 + Н2О
Оксид
хрома CrO3-
неустойчив и при нагревании разлагается
с выделением кислорода: 4CrO3
![]() 2
Cr2O3
+ 3О2,
а оксиды МоО3
и WO3
при нагревании переходят без разложения
в газовую фазу.
2
Cr2O3
+ 3О2,
а оксиды МоО3
и WO3
при нагревании переходят без разложения
в газовую фазу.
В воде хорошо растворим CrO3 в отличие от МоО3 и WO3, с образованием хромовых кислот:
CrO3 + H2O = H2СrO4 или 2CrO3 + H2O = H2Сr2O7
Хром образует еще два оксиды: CrO (черный) - Cr2О3(темно-зеленый). В ряду оксидов
CrO Cr2О3 CrO3 происходит
усиление кислотных свойств

CrO – основной оксид. Взаимодействует с кислотами с образованием солей хрома (II). При небольшом нагревании диспропорционирует:
3CrO![]() Cr2O3
+ Cr
Cr2O3
+ Cr
Cr2О3 тугоплавкий, твердый химически инертный темно-зеленого цвета порошок, не растворяющийся в воде, растворах кислот и щелочей. Амфотерность проявляет при сплавнении:
Cr2О3 + 2NaOH = 2NaCrO2 + H2O
метахромит натрия
Удобным лабораторным способом получения Cr2О3 является термическое разложение дихромата аммония:
(NH4)2Cr2O7 Сr2O3 + N2 + 4H2O
Горение хрома в кислороде: 4Cr + 3O2 2Сr2O3, также сопровождается образованием оксида хрома (+3).
Гидроксиды. Оксидам подгруппы хрома в высшей степени окисления соответствуют кислотные гидроксиды, общей формулой H2ЭO4 .
Кислоты хрома образуются при взаимодействии СrO3 с водой. Молибденовая (H2МоO4) и вольфрамовая (Н2WO4) кислоты, как плохо растворимые в воде, получают действуя на соли сильными кислотами:
К2МоO4 + H2SO4 = H2МоO4 + K2SO4
Хромовая
кислота (H2СrO4)
средней силы (![]() 2101),
дихромовая кислота (H2Сr2O7)–
сильная, а остальные кислоты слабые,
так для H2МоO4
102.
Для молибденовой кислоты определена
константа диссоциации и по основному
типу:
2101),
дихромовая кислота (H2Сr2O7)–
сильная, а остальные кислоты слабые,
так для H2МоO4
102.
Для молибденовой кислоты определена
константа диссоциации и по основному
типу:
H2МоO4
МоО22+
+ 2ОН,
![]()
Это амфотерные соединения. В ряду гидроксидов:
H2СrO4 H2МоO4 H2WO4
уменьшение кислотных свойств

сила кислот уменьшается, а основные свойства увеличиваются, поэтому две последние кислоты реагируют с кислотами, с образованием оксосолей, например:
H2МоO4 + H2SO4 = МоO2SO4 + Н2О
 диоксосульфаты
диоксосульфаты
МоО2(ОН)2
Одной из характерных особенностей элементов этой подгруппы в высшей степени окисления является способность к образованию полисоединений. Так в разбавленном водном растворе для хрома характерно образование ионов CrO42, а при повышении концентрации раствора - Cr2O72, затем Cr3O102 и тетрахромат Cr4O132. Общая формула полихромат-ионов CrnO3n+1 2. Сами изополикислоты известны только в растворах и в свободном состоянии не выделены. Наибольшее значение имеют дихроматы: лучше растворимы в воде и их растворы имеют кислую среду, что объясняется их взаимодействием с водой:
Н2О + Cr2O72 2Н+ + 2CrO42
Отсюда следует, что в кислой среде равновесие сильно смещено влево, в при разбавлении или в щелочной среде вправо. Таким образом можно осуществлять взаимные превращения хроматов и дихроматов в соответствии с уравнениями:
2Na2СrO4 + H2SO4 = Na2SO4 + Na2Сr2O7 +H2O
желтого оранжевого
Na2Сr2O7 + 2NaOH = 2Na2СrO4 + H2O
Хромат - ион (CrO4)2 - устойчив в щелочной среде, а дихромат (Cr2O7)2- в кислой.
Оксидам хрома соответствуют гидроксиды:
Cr(OH)2 Cr(OH)3 H2CrО4
желтый темно-зеленый желтая
осн. амфот. кислот.
Cr(OH)2, обладающий основными свойствами и легко растворяется в кислотах с образованием соответствующих солей Cr (+2). При хранение он постепенно разлагает воду с выделением водорода:
2Cr(OH)2 + 2H2O =2Cr(OH)3 + H2
Оксиду Cr2O3 соответствует серо-синий малорастворимый в воде гидроксид: Cr(OH)3 = Cr2O3 n H2O, обладающий амфотерными свойствами, который растворяется в растворах кислот и щелочей:
Cr(OH)3 + 3НС1 = CrС13 + 3H2O
Cr(OH)3 + NaOH = NaCr(ОН)4 или Na3Cr(ОН)6
зеленого цвета
Соли. Степень окисления (+2) для хрома неустойчива, поэтому все производные являются сильные восстановителями. Так, они легко окисляются кислородом воздуха, а ион Cr2+, подобно активным металлам, способен восстанавливать водород из воды, переходя в производные Cr3+
4CrO + O2 +12HCI = 4CrCI3 + 6H2O
2CrCI2 + 2 H2O = 2CrOHCI2 +H2
Соединения хрома (+3) –устойчивые соединения. Соли Cr3+ гидратированы, например: Сr2(SO4)318H2O; Cr(NO3)39H2O, CrBr36H2O и имеют сине-фиолетовое окрашивание. В водном растворе они гидролизованы:
Сr2(SO4)3 + 2H2O = 2СrОНSO4 + H2SO4
или
NaCrO2 +2H2O = NaOH + Cr(OH)3
Пероксидные соединения. Для соединений хрома (+6) характерно взаимодействии в щелочной среде с пероксидом водорода. При этом образуется пероксид СrO5 синего цвета:
H2СrO4 + 2H2O2 = СrO5 + 3H2O
синий
Пероксид хрома имеет строение:
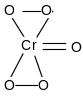
При действии пероксида водорода на бихроматы образуется пероксокислоты хрома H2Сr2O12 и H3СrO8 :
H2Сr2O7 + 3H2O2 = H2Сr2O12 + 3H2O
Строение H2Сr2O12 можно представить так:

Все они неустойчивы, являются сильнейшими окислителями. В ряду Сr – Мо – W устойчивость пероксосоединений (H3ЭOn ,где n=5-8) заметно возрастает.
Комплексные соединения. Химия хрома (+2) в определенном смысле подобна химии железа (+2). Так для них изветны ацидо- , родано- и амминокомплексы, типа Cr(NH3)62+, K4Cr(SCN)6, K4Cr(CN)6.
Хром (+3) образует как анионные Cr(OH)4; Cr(OH)63; так и катионные Cr(H2O)63+ комплексы.
Для металлов подгруппы хрома отмечено образование карбонилов типа Ме(СО)6, в котором степень окисления металла формально равна нулю.
Окислительно-восстановительные свойства соединений. В окислительно-восстановительных реакциях соединения Cr3+ выступают как восстановители:
![]() ,
,
![]()
![]() ,
,
![]()
Например:
CrCI3 + 3H2O2+10NaOH = Na2CrО4 +6 NaCI + 8H2O
метахромат натрия
или
Cr2О3 +3KNO3 + 2Na2CO3 = 2 Na2CrO4 + 3KNO2 +2CO2
Соединения в степени окисления (VI) сильные окислители, особенно хроматы и дихроматы в кислой среде, восстанавливаясь до соединений хрома (+3). Так, на холоду они окисляют HJ, H2S, H2SO3, при нагревании HBr и даже HCI (см. ПРИЛОЖ. табл. .), например:
К2Сr2O7 + 6KJ + 7H2SO4 = Cr2(SO4)3 +3J2 + 4K2SO4 +H2O
Окислительная способность в ряду: H2СrO4H2МоO4Н2WO4 уменьшается.
Сильными окислительными свойствами обладает хромовая смесь: К2Сr2O7 + H2SO4.
