
- •Введение
- •Химическое равновесие
- •Тема 1*
- •1. Выпишем из справочника /2, с. 72-89/ теплоты образования
- •2. Тепловые эффекты реакции при постоянном давлении и постоянном объеме связаны соотношением
- •3 Киломолей аммиака от 273 до 473 к при постоянном давлении.
- •Зависимость константы равновесия реакции от температуры
Зависимость константы равновесия реакции от температуры
Как записать уравнение Гиббса - Гельмгольца? Как найти изменение энергии Гиббса в ходе реакции (уравнение изотермы)? Как зависит энергия Гиббса реакции от температуры (производная уравнения изотермы по температуре)? Как получить уравнение зависимости константы равновесия от температуры при постоянном давлении (уравнение изобары) и при постоянном объеме (уравнение изохоры)? В каком случае с ростом температуры константа равновесия возрастает, в каком - убывает, в каком - не изменяется? Как найти константу равновесия из уравнения изобары (аналитический и графический методы)? Какое приближение при этом используется? Можно ли обойтись без этого приближения? Как можно определить тепловой эффект реакции, измерив константу равновесия при различных температурах? Какой метод - аналитический или графический - точнее и почему?
Примеры решения задач
Пример 5. Вычислите константу равновесия реакции
S2 + 4 CO2 = 2 SO2 + 4 CO
при 700 К в первом приближении Улича, а также методом
Темкина - Шварцмана. Сделайте вывод об обратимости данной реакции.
Р е ш е н и е. Из справочника /2/ выписываем теплоты об-
разования, коэффициенты теплоемкости веществ, энтропию и коэффициенты Mn в табл. 4 и 5.
Таблица 4
Вещество |
ν |
∆Н°f, 298 кДж/моль |
с0р = a + bТ + сТ2 + с' Т-2 Дж∙моль-1∙ К |
||||
a |
b∙103 |
с ∙b 6 |
с'∙10-5 |
S0298 |
|||
SO2 (г.) |
2 |
-296,90 |
46,19 |
7,87 |
|
-7,70 |
248,07 |
CO (г.) |
4 |
-110,53 |
28,41 |
4,10 |
|
-,46 |
197,55 |
∑ по кон. в-вам |
|
-1035,92 |
206,02 |
32,14 |
|
-17,24 |
1286,34 |
S2 (г.) |
1 |
128,37 |
36,11 |
1,09 |
|
-3,51 |
228,03 |
CO2(г.) |
4 |
-393,51 |
44,14 |
9,04 |
|
-8,54 |
213,66 |
∑ по исх. в-вам |
|
-1445,67 |
212,67 |
37,25 |
|
-37,67 |
1082,67 |
∆ |
|
409,75 |
-6,65 |
-5,11 |
|
20,43 |
203,67 |
Таблица 5
Т |
М0 |
М1∙10-3 |
М2∙10-6 |
М -2∙105 |
700 |
0,2794 |
0,1153 |
0,0498 |
0,1853 |
В первом приближении Улиха
∆G0т
= ∆Н°
298
– Т∆S0298
; К0т
= ехр![]() .
.
Подставляем значения:
∆G0700 = 409750 – 700 ∙ 203,67 = 267181 Дж ;
К0
= ехр![]() = ехр(-45,93) = 10 -
45,93 / 2,3
= 10 -19,97
=
= ехр(-45,93) = 10 -
45,93 / 2,3
= 10 -19,97
=
= 10 -0,97 ∙ 10 -19 = 0,107 ∙ 10 -19 = 1,07 ∙ 10 -20
По методу Темкина – Шварцмана
∆G0т = ∆Н° 298 – Т∆S0298 – T(∆a ∙ М0 +∆b ∙ М1 + ∆с ∙ М2 + ∆с'∙ М -2) .
Подставляем значения:
∆G0700 = 409750 – 700 ∙ 203,67 – 700 ∙ (-6,65 ∙ 0,2794 – 5,11 ∙ 10-3
0,1153 ∙ 103 + 20,43 ∙ 105 ∙ 0,1853 ∙ 10-5) = 267181 – 936,94 = 266244 Дж.
Константа равновесия
К0
= ехр![]() = ехр(-45,77) = 10 -
45,77 / 2,3
= 10 -19,90
=
= ехр(-45,77) = 10 -
45,77 / 2,3
= 10 -19,90
=
= 10 -0,90 ∙ 10 -19 = 0,126 ∙ 10 -19 = 1,26 ∙ 10 -20 .
Вывод: согласно закону действующих масс
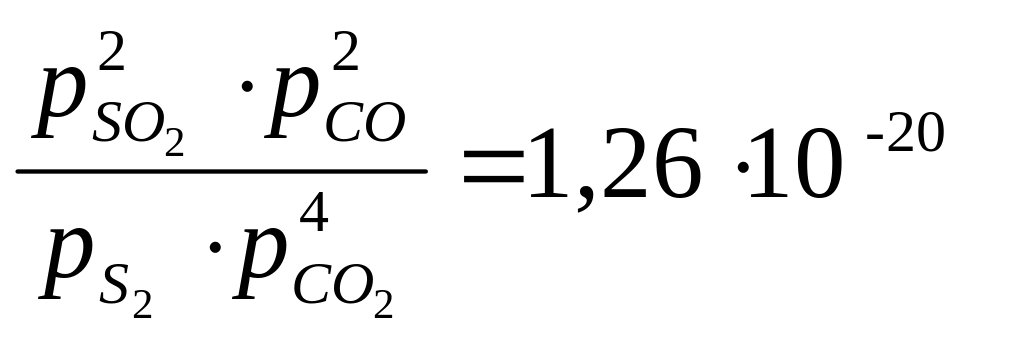 << 1 .
<< 1 .
следовательно, в равновесном состоянии продуктов реакции намного меньше, чем исходных веществ. Реакция практически необратима, равновесие сдвинуто в сторону исходных веществ.
И н д и в и д у а л ь н о е р а с ч е т н о е з а д а н и е
№ 5 приведено в работе /3, с. 275, № 8/.
Примец б. Определите константу равновесия
CH3Cl + 2Cl2 = CHCl3 + 2HCl
при температуре 800 К с помощью приведенной энергии Гиббса.
Р ш е н и е: из справочника /2, с. 102-106/ выписываем приведенную энергию Гиббса и теплоту образования при 0К конечных и исходных веществ в табл. б.
Таблица 6
Вещество |
ν |
Фт, Дж∙ К-1∙моль-1 |
∆Н° f,0 кДж/моль-1 |
CHCl3 |
1 |
305, 28 |
-98,22 |
НСl |
2 |
186,52 |
-92,13 |
∑ по кон. в-вам |
|
678,32 |
-282,48 |
СН3Cl |
1 |
239,65 |
-72,85 |
Сl2 |
2 |
224,22 |
0 |
∑ по исх. в-вам |
|
688,09 |
-72,85 |
∆
|
|
-9 |
-209,63 |
Расчет ведем по формуле
lnKα
=
![]() (∆Фт
–
(∆Фт
–
![]() )
.
)
.
Подставляем значения:
lnKα
=
![]() (-9.77
–
(-9.77
–
![]() )
= 30.357 ;
)
= 30.357 ;
Kα = ехр(30,357) =10 30,357 / 2,303 = 10 13,1839 = 10 0,1839 ∙ 10 13 = 1,53 ∙1013
Вывод: согласно закону действующих масс
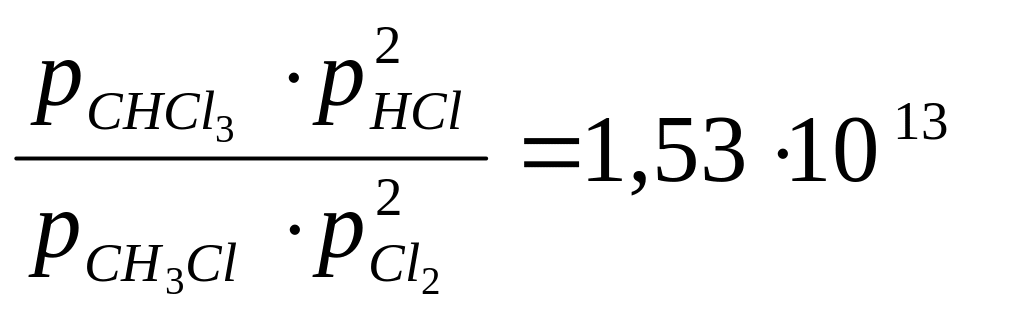 >>
1
>>
1
следовательно, в равновесном состоянии продуктов реакции намного больше, чем исходных веществ.
Реакция практически необратима, равновесие смещено в сторону продуктов реакции.
И н д и в и д у а л ь н о е р а с ч е т н о е з а д а н и е
№ 6 приведено в работе /3, с. 274, № 6/.
Пример 7. Для реакции
2NO + O2 = 2NO2 ,
.
протекающей в закрытой системе при 800 К, рассчитайте стандартную константу равновесия по константам атомизации веществ, а также равновесный состав системы, если в исходном состоянии вещества смешаны в следующих количествах:
![]() моль,
моль,
![]() моль,
моль,
![]() моль
моль
а общее давление в равновесном состоянии Р = 1 атм.
Р е ш е н и е. Из табл. 7 выписываем логарифмы констант
атомизации исходных и конечных веществ при 800 К:
Вещество ν lg K0ат
NO 2 -35.5415
O2 1 -26.2006
NO2 2 -48.4746
Таблица 7*
Вещество |
lg K0ат при Т, К |
||
400 |
600 |
800 |
|
СH4 CH3Cl CH2Cl2 CHCl3 CCl4 NO O2 NO2 HCl Cl2 NOCl H2O |
-194.5904 -182.7947 -171.1440 -158.2743 -142.7980 -76.9124 -58.9425 -110.0051 -51.4812 -26.0614 -91.8083 -110.4666 |
-121.6746 -113.8176 -105.8830 -97.0118 -86.1589 -49.3636 -37.1452 -69.0355 -32.5793 -15.4226 -57.2569 -69.8811 |
-84.9861 -79.1270 -73.0909 -66.2844 -57.7815 -35.5415 -26.2006 -48.4746 -23.0665 -10.0630 -39.9183 -49.4706 |
Константу равновесия данной реакции рассчитываем по формуле
lgK0
= 2lg![]() +
lg
+
lg![]() –
2lg
–
2lg![]()
Подставляем значения:
lgK0 = 2 (-35.5415) + (-26.2006) – 2 (-48.4746) = -0.3344
K0 = 10 -0.3344 = 0.46302
Константа равновесия реакции близка к 1, следовательно, реакция обратимая.
Для расчета равновесного состава обозначим X - количество кислорода, прореагировавшего до наступления равновесия. Тогда согласно стехиометрии реакции количества веществ (в молях) в равновесном состоянии будут следующими
_________________________
* Термодинамические свойства индивидуальных веществ/Л.В.ТУрвич и др. M.: Наука. 1978. Т. I, кн. 2. 328 с.
![]() (0,7
– 2X),
(0,7
– 2X),
![]() (0,2
– X) ,
(0,2
– X) ,
![]() (0,1
+ 2X),
(0,1
+ 2X),
![]()
![]()
![]() (1-X)
.
(1-X)
.
Равновесные парциальные давления веществ (атм)
![]()
![]()
![]()
Для состояния равновесия справедлив закон действующих масс

Подставим значения:
![]()
После сокращения получаем:
![]()
Для нахождения неизвестного X это уравнение можно привести к уравнению 3-й степени и решить на ЭВМ с использованием стандартных подпрограмм. Можно воспользоваться также методом подбора. Для этого обозначим левую часть равенства
![]()
и подберем такое значение X ,при котором f(X) = 0,46302, причем
0< Х<0,2. Рекомендуется для нахождения функции использовать
программируемый калькулятор МК-46.
Порядок записи программы для расчета f(X) (для данной зада-
чи) на МК-46:
В/О Р ПРГ
F2 ↑ 2 0,1 + FX2 Pg 1 ↑ F2 -Р8
F2 ↑ 2 /-/ 0,7 + FX2 P7 0,2 ↑ F2 -P6
F9
↑ F8
↑
F7
![]() ↑ F6
СП
↑ F6
СП
Р АВТ
Порядок расчета по программе
(X) Р2 В/О СП
Результаты заносим в табл. 8.
Таблица 8
X |
f(X) |
X |
f(X) |
0,1 0,01 0,05 0,04 0,03
|
3,24 0,160 0,704 0,506 0,357
|
0,035 0,037 0,038 0,0375
|
0,426 0,456 0,472 0,464 0,4628
|
Находим равновесные парциальные давления (равновесный состав):
![]() атм
= 0,6494 атм .
атм
= 0,6494 атм .
![]() атм = 0,1689 атм .
атм = 0,1689 атм .
![]() атм = 0,1816 атм .
атм = 0,1816 атм .
Проверка:
![]()
![]()
![]()
![]() 0,6494
+ 0,1689 + 0,1816 = 0,9999 атм.
0,6494
+ 0,1689 + 0,1816 = 0,9999 атм.
![]()
И н д и в и д у а л ь н о е р а с ч е т н о е з а д ан и е № 7 : для заданной реакции (табл. 9) при температуре Т рассчитайте стандартную константу равновесия по константам атомизации веществ, а также равновесный состав системы, если в исходном состоянии вещества смешаны в следующих количествах :
N'1= 0,6 моля, N'2=0,4 моля, N'3= N'4= 0 ,
а общее давление в равновесном состоянии Р = 1атм.
Таблица 9
Номер Варианта |
Реакция |
Т, К |
1 |
CH4 + CH2Cl2 = 2 CH3Cl |
400 |
2 |
|
600 |
3 |
——— // ——— |
800 |
4 |
CH4 + CCl4 = 2 CH2Cl2 |
400 |
5 |
——— // ——— |
600 |
6 |
——— // ——— |
800 |
7 |
CH2Cl2 + CCl4 = 2 CHCl3 |
400 |
8 |
——— // ——— |
600 |
9 |
——— // ——— |
800 |
10 |
CH4 + CHCl3 = CH2Cl2 + CH3Cl |
400 |
11 |
——— // ——— |
600 |
12 |
——— // ——— |
800 |
13 |
CH3Cl + CHCl3 = 2 CH2Cl2 |
400 |
14 |
——— // ——— |
600 |
15 |
——— // ——— |
800 |
16 |
CH4 + CCl4 = CH3Cl + CHCl3 |
400 |
17 |
——— // ——— |
600 |
18 |
——— // ——— |
800 |
19 |
CH3Cl + CCl4 = CH2Cl2 + CHCl3 |
400 |
20 |
——— // ——— |
600 |
21 |
——— // ——— |
800 |
22 |
4 HCl + O2 = 2 Cl2 + 2 H2O |
400 |
23 |
——— // ——— |
600 |
24 |
——— // ——— |
800 |
25 |
4 HCl + 2 NO2 = 2 NOCl + 2 H2O |
400 |
26 |
|
600 |
27 |
|
800 |
РЕКОМЕНДУЕМЫЙ БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Обязательный
1. Киреев В.А. Курс физической химии. М.: Химия, 1975. 776 с.
2. Краткий справочник физико-химических величин/ Под ред.
А.А.Равделя и А.М.Пономаревой. Л.: Химия, 1983. 232 с.
3. Киселева Е.В., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. М.: Высшая школа, 1983. 456 с.
Дополнительный
4. Стромберг А.Г., Семченко Д.П. Физическая химия. М.: Высшая школа, 1988. 496 с.
5. Физическая химия/Под ред. К.С.Краснова. М.: Высшая школа,
1982. 687 с.
6. Герасимов Я.И. и др. Курс физической химии. М.: Химия,1970.
Т. 1. 592 с.
7. Карапетьянц М.Х. Химическая термодинамика. М.: Химия,
1975. 584 с.
Составитель В.И. СКУДАЕВ
Корректор К.Ю. ЕУКУС
Формат 60х84I/16. Объем 1,5 п.л.
Тираж 250. Заказ 103. Бесплатно.
_____________________________________
Редакционно-издательский отдел и ротаприн
Пермского политехнического института
