
2. Ізотерми Ван-дер-Ваальса
Рівняння
ізотерми можна отримати, якщо в (6)
покласти
![]() .
Його можна привести до виразу
.
Його можна привести до виразу
![]() .
.
Я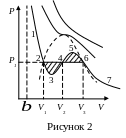 кщо
температура велика, то останній доданок
можна не враховувати. Ізотерма буде
мати вигляд гіперболи із асимптотами
кщо
температура велика, то останній доданок
можна не враховувати. Ізотерма буде
мати вигляд гіперболи із асимптотами
![]() (ізобара) і
(ізобара) і
![]() (ізохора).
(ізохора).
Для дослідження ізотерм для кожного значення температури перетворимо рівняння (6):
![]()
![]() .
(7)
.
(7)
Це рівняння третьої степені відносно об’єму V і воно має три кореня. Тобто при фіксованих значеннях T і Р речовина може мати три значення об’єму, або, що те ж саме, три значення густини. В окремому випадку, при відповідних значеннях коефіцієнтів в рівнянні (7), всі три кореня будуть рівні. При цьому ліва частина виразу (7) стає точним кубом (V-V0)3.
З’ясуємо зміст коренів рівняння Ван-дер-Ваальса. Уявні корені нас не будуть цікавити, оскільки вони не мають фізичного змісту.
На
рис. 2 представлені ізотерми Ван-дер-Ваальса
і для порівняння приведена ізотерма
Ендрюса.
0
6
Ділянка
3-5
відрізняється від інших тим, що на ній
із збільшенням об’єму тиск не спадає,
а зростає:
 .
В природі не існує речовин, у яких при
зростанні тиску збільшується об’єм,
тобто зменшується густина. Можна уявити
собі, що такий стан все ж таки реалізувався.
Тоді локальне зростання тиску, яке
обов’язково буде мати місце в статистичній
системі, призведе до зростання об’єму,
що в свою чергу призведе до додаткового
збільшення тиску, і т.д. поки система не
перейде в точку 5, від якої вже починається
„нормальна” поведінка системи. З тих
же причин будь-яке випадкове мале
зменшення тиску призведе до самовільного
переходу речовини в стан, що відповідає
точці 3. Тобто такий стан абсолютно
нестійкий і тому реалізуватись не може.
.
В природі не існує речовин, у яких при
зростанні тиску збільшується об’єм,
тобто зменшується густина. Можна уявити
собі, що такий стан все ж таки реалізувався.
Тоді локальне зростання тиску, яке
обов’язково буде мати місце в статистичній
системі, призведе до зростання об’єму,
що в свою чергу призведе до додаткового
збільшення тиску, і т.д. поки система не
перейде в точку 5, від якої вже починається
„нормальна” поведінка системи. З тих
же причин будь-яке випадкове мале
зменшення тиску призведе до самовільного
переходу речовини в стан, що відповідає
точці 3. Тобто такий стан абсолютно
нестійкий і тому реалізуватись не може.
На
ділянках 2-3 і 5-6 з підвищенням тиску
об’єм зменшується, і необхідна умова
термодинамічної стійкості стану
![]() виконана, що, в принципі, припускає
можливість реалізації цих станів. За
особливих умов ці стани і справді можуть
бути реалізованими. Їх називають
метастабільними.
Ділянка 5-6 зображає пересичену
пару,
а ділянка 2-3 – перегріту
рідину.
Ці фази можуть існувати до моменту
торкання із іншою більш стійкою за даних
умов фазою. Пересичена пара переходить
в насичену, якщо з’являється крапля
води. Перегріта вода почне інтенсивно
кипіти, при попаданні в неї бульбашки
повітря.
виконана, що, в принципі, припускає
можливість реалізації цих станів. За
особливих умов ці стани і справді можуть
бути реалізованими. Їх називають
метастабільними.
Ділянка 5-6 зображає пересичену
пару,
а ділянка 2-3 – перегріту
рідину.
Ці фази можуть існувати до моменту
торкання із іншою більш стійкою за даних
умов фазою. Пересичена пара переходить
в насичену, якщо з’являється крапля
води. Перегріта вода почне інтенсивно
кипіти, при попаданні в неї бульбашки
повітря.
Експериментально стан пересиченої пари можна реалізувати при швидкому охолодженні закритої посудини з повітрям, що містить водяну пару. Необхідно лише попередньо очистити повітря від слідів пилу і електричних зарядів - центрів конденсації. При цьому після різкого охолодження, а значить, після зменшення пружності насиченої пари, вона все ж таки довгий час не конденсується, залишаючись пересиченою, тобто кількість її молекул більша, ніж це потрібно для насичення.
Стан перегрітої рідини реалізується ще важче. Рідину очищають від домішок і мікроскопічних бульбашок повітря. Останнє досягається в результаті довгого кип’ятіння рідини. Якщо тепер таку рідину нагріти, то вона навіть в умовах переходу з рідкого стану в газоподібний, залишиться рідиною.
Отже, речовина не може перейти з газоподібного стану в рідкий через абсолютно нестійку проміжну область 3-4-5. Дослід показує, що перехід цей здійснюється через двофазний стан, пряма 2-4-5. Тобто кореню V2 за даної температури лише при тиску, що дорівнює тиску насиченої пари, відповідає стабільний стан.
Рівноважне значення цього тиску безпосередньо з рівняння Ван-дер-Ваальса не можна знайти. Але його можна визначити з загальних термодинамічних міркувань. Як було показано Максвелом, робота не повинна залежати від того, чи відбувається перехід з рідкого стану до газоподібного по теоретичній ізотермі однорідної речовини 2-3-4-5-6, чи по ізотермі двохфазного стану 2-4-6,
![]()
Звідки випливає, що пряму 2-4-6 необхідно провести так, щоб були рівні площі областей під кривою 2-3-4-5-6 і прямою 2-4-6 або, що рівносильно, заштриховані площі на рис. 2.
Значення рівняння Ван-дер-Ваальса полягає, перш за все, в тому, що воно описує факт існування у речовини двох фаз – рідкої і газоподібної. Окрім того, як ми побачимо нижче, з рівняння Ван-дер-Ваальса випливає такий важливий факт, як існування критичної температури і критичного стану взагалі..
