
Лекція 7 теплоємність. Класична теорія теплоємності газів
Поняття теплоємності. Теплоємність при різних процесах.
Внутрішня енергія ідеального газу.
Рівняння Майєра.
Політропічні процеси.
Класична теорія теплоємності газів.
Література: [1] стор. 132-147, [2] стор. 103-130, [7] стор. 67-87
Викладіть основні положення класичної та квантової теорії теплоємностей газів.
З яких фізичних міркувань випливає, що теплоємність ідеального газу при постійному тиску більша, ніж при постійному об’ємі?
Чи залежить в загальному випадку теплоємність від потенціальної енергії взаємодії молекул?
Поняття теплоємності. Теплоємність при різних процесах
Досить довго в свідомості вчених існувало поняття про теплород і жила уява про «закон збереження кількості теплоти». Такий стан речей підтримувався завдяки тому, що всі калориметричні досліди проводились або при постійному об’ємі, або при постійному тиску. Справді, якщо об’єм не змінюється, то робота А рівна нулеві і перший закон термодинаміки приймає форму
![]() .
.
Якщо
постійний тиск, то
![]() і перший закон термодинаміки
і перший закон термодинаміки
![]() .
.
Величина
![]() - функція стану, оскільки U,
p
і V
є функціями стану. І
називають ентальпією
або тепловою
функцією.
Таким чином, якщо
- функція стану, оскільки U,
p
і V
є функціями стану. І
називають ентальпією
або тепловою
функцією.
Таким чином, якщо
![]() ,
то приріст кількості теплоти
,
то приріст кількості теплоти
![]() дорівнює зміні внутрішньої енергії, а
при
дорівнює зміні внутрішньої енергії, а
при
![]() - приросту ентальпії.
- приросту ентальпії.
Тому
на основі виконаних дослідів при сталих
p
або V
склалось враження, що
![]() - функція стану, тобто
є характеристикою стану тіла і не
залежить від шляху, за яким тіло
переводиться із стану 1 в стан 2. Перші
досліди виконувались із твердими тілами
або рідинами, у яких коефіцієнт об’ємного
розширення незначний, і тому відмінність
природи
(при
під
треба розуміти U,
при
під
треба розуміти І)
залишалась непоміченою. Остаточно
- функція процесу.
- функція стану, тобто
є характеристикою стану тіла і не
залежить від шляху, за яким тіло
переводиться із стану 1 в стан 2. Перші
досліди виконувались із твердими тілами
або рідинами, у яких коефіцієнт об’ємного
розширення незначний, і тому відмінність
природи
(при
під
треба розуміти U,
при
під
треба розуміти І)
залишалась непоміченою. Остаточно
- функція процесу.
Теплоємність
Однієї з важливих фізичних величин, що характеризують термодинамічну систему, є теплоємність.
Теплоємність визначає кількість теплоти, що необхідна для зміни температури системи 1 К
![]() .
.
Ч им
більше тіло, тим більшу кількість теплоти
необхідно надати, щоб збільшити його
температуру на 1 К. Щоб теплоємність
характеризувала не тіло, а речовину,
використовують теплоємність віднесену
до одиниці маси речовини – питому
теплоємність
им
більше тіло, тим більшу кількість теплоти
необхідно надати, щоб збільшити його
температуру на 1 К. Щоб теплоємність
характеризувала не тіло, а речовину,
використовують теплоємність віднесену
до одиниці маси речовини – питому
теплоємність
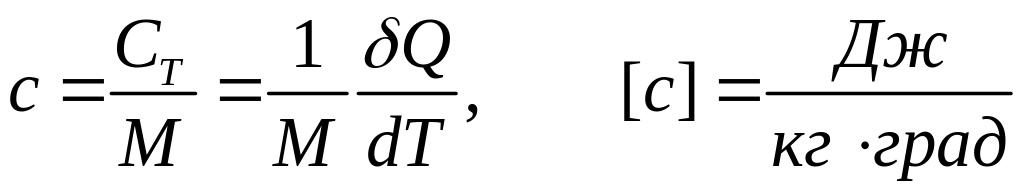 .
(1)
.
(1)
А налогічно визначається фізичний зміст молярної теплоємності
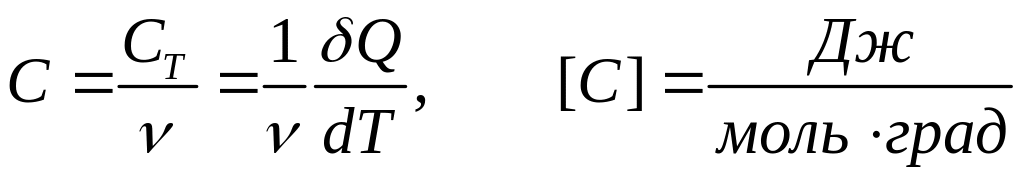 .
(2)
.
(2)
Молярною теплоємністю називають таку кількість теплоти, яку треба надати 1 молю речовини або відняти у нього, щоб змінити його температуру на 1 градус.
В більшості випадків вважають, що нагріванню або охолодженню підлягає 1 моль речовини, і вираз для молярної теплоємності пишуть у вигляді
![]() .
(3)
.
(3)
Виходячи із (1) і (2), запишемо зв'язок між молярною і питомою теплоємностями
![]() ,
,
де
![]() молярна
маса речовини.
молярна
маса речовини.
Оскільки
кількість теплоти
,
що необхідна для зміни температури
системи на
![]() ,
залежить від характеру процесу, то і
теплоємність
,
залежить від характеру процесу, то і
теплоємність
![]() системи також залежить від умов, при
яких визначається
системи також залежить від умов, при
яких визначається
![]() .
.
![]() функція
процесу: одна і та ж система в залежності
від процесу, що відбувається в ней, має
різні теплоємності. Обмежень на її
значення не накладається, тобто на
практиці значення теплоємності пробігають
від
функція
процесу: одна і та ж система в залежності
від процесу, що відбувається в ней, має
різні теплоємності. Обмежень на її
значення не накладається, тобто на
практиці значення теплоємності пробігають
від
![]() до
до
![]() .
.
Перший початок термодинаміки дозволяє знайти значення теплоємностей для різних процесів, а також встановити зв'язок між ними, якщо відомі рівняння стану.
Розглянемо
термодинамічну систему, яка характеризується
трьома мікроскопічними параметрами p,
V,
T.
Оберемо незалежними параметрами V
і
T.
Тоді внутрішня енергія U,
як і третій параметр
![]() ,
буде залежати від них
,
буде залежати від них
![]() .
.
Повний диференціал функції U
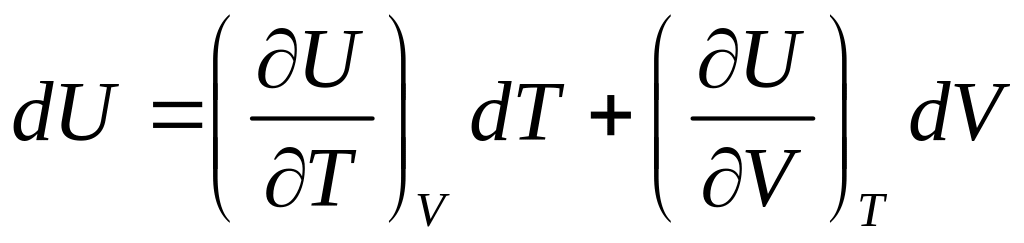 (4)
(4)
Підставивши
це значення у перший закон термодинаміки
![]() ,
отримаємо
,
отримаємо
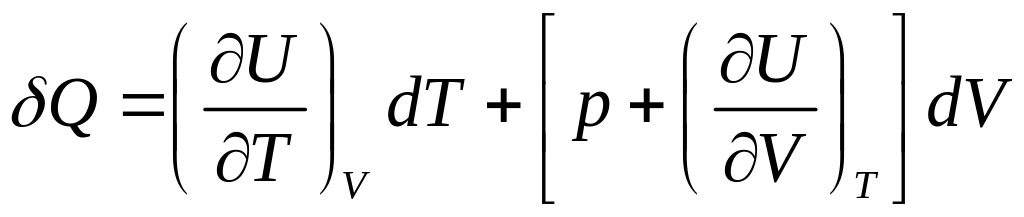 .
(5)
.
(5)
Тоді формула (3) для молярної теплоємності запишеться
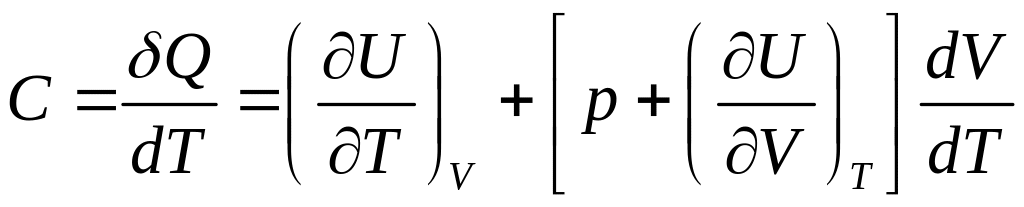 .
(6)
.
(6)
Використаємо формулу (6) для різних ізопроцесів
Ізохорний процес. При сталому об’ємі
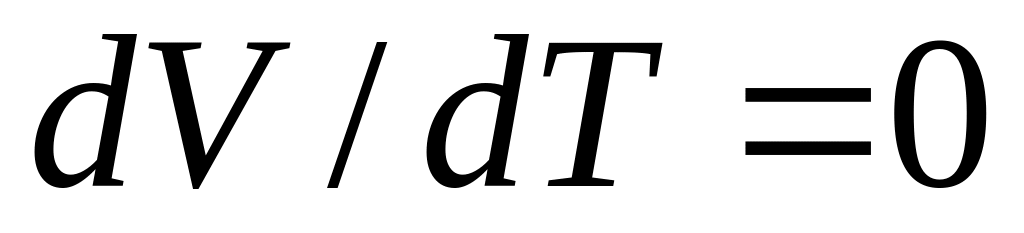 ,
і формула (6) набуває вигляду
,
і формула (6) набуває вигляду
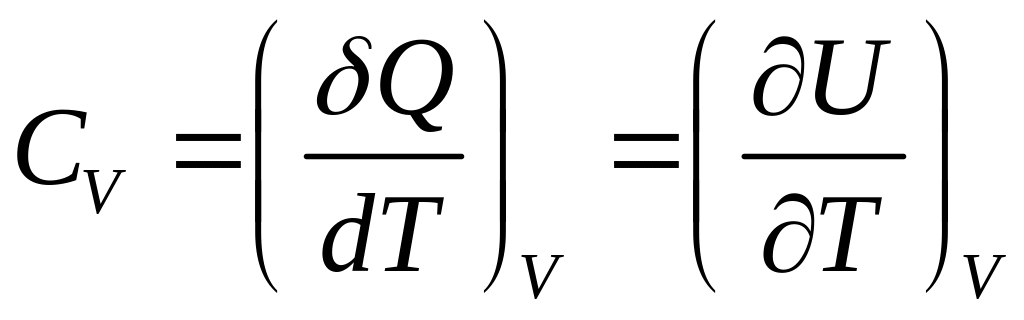 .
(7)
.
(7)
Тобто,
щоб знайти
![]() необхідно мати калоричне
рівняння
необхідно мати калоричне
рівняння
![]() .
Навпаки, якщо відома теплоємність
можна із (4) знайти внутрішню енергію
.
Навпаки, якщо відома теплоємність
можна із (4) знайти внутрішню енергію
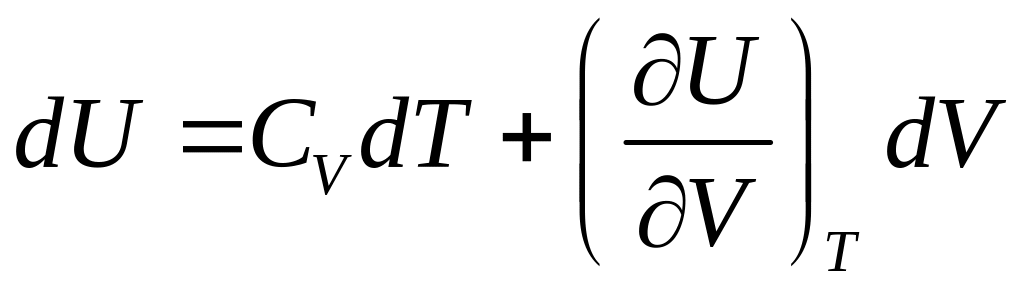
Ізобарний процес. Якщо , то відношення
 являє собою часткову похідну
являє собою часткову похідну
 ,
і співвідношення (6) необхідно переписати
,
і співвідношення (6) необхідно переписати
 .
(8)
.
(8)
З відси
випливає співвідношення для
і
відси
випливає співвідношення для
і
![]() для одного моля будь-якої речовини
для одного моля будь-якої речовини
 (9)
(9)
З
(8) і (9) видно, що для знаходження
та
![]() необхідно мати окрім калоричного ще і
термічне
рівняння (таке, що зв’язує
необхідно мати окрім калоричного ще і
термічне
рівняння (таке, що зв’язує
![]() ,
зовнішні параметри і внутрішній
параметр).
,
зовнішні параметри і внутрішній
параметр).
Ізотермічний процес. При сталій температури
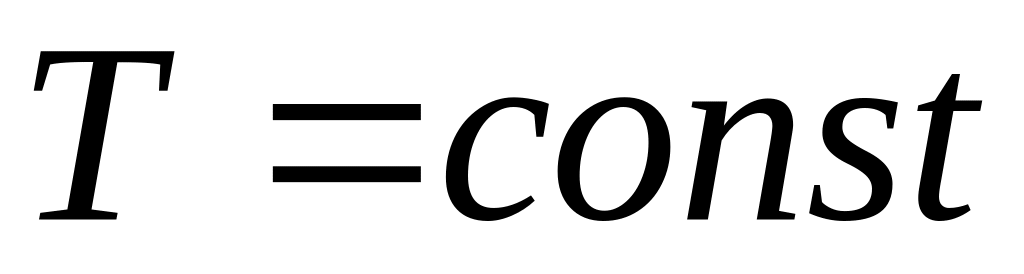 ,
,
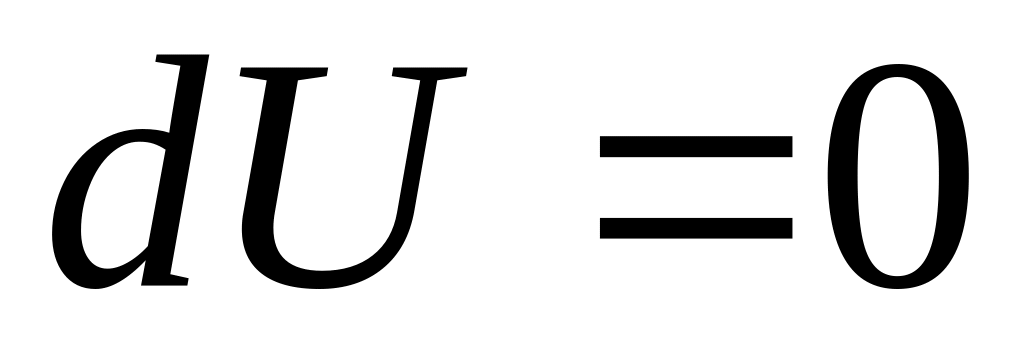 і, отже,
і, отже,
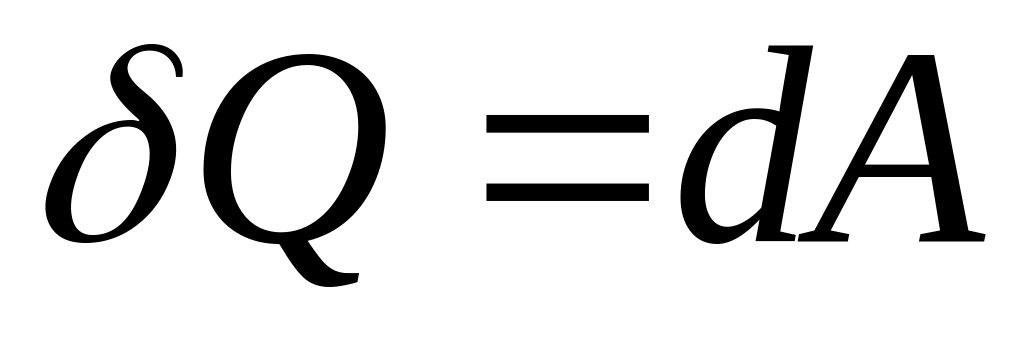 ,
тобто теплоємність дорівнює нескінченості
,
тобто теплоємність дорівнює нескінченості
![]() .
.
