
- •Лекція 10 гази з міжмолекулярною взаємодією
- •Відхилення властивостей газів від властивостей ідеальних газів
- •Сили міжмолекулярної взаємодії. Потенціальна енергія взаємодії молекул. Потенціал Леонарда-Джонса
- •Ізотерми реального газу. Перехід від рідкого в газоподібний стан. Критичний стан речовини
- •1. Відхилення властивостей газів від властивостей ідеальних газів
- •2. Сили міжмолекулярної взаємодії
- •3. Ізотерми реального газу. Перехід з рідкого в газоподібний стан. Критичний стан речовини
Лекція 10 гази з міжмолекулярною взаємодією
Відхилення властивостей газів від властивостей ідеальних газів
Сили міжмолекулярної взаємодії. Потенціальна енергія взаємодії молекул. Потенціал Леонарда-Джонса
Ізотерми реального газу. Перехід від рідкого в газоподібний стан. Критичний стан речовини
![]() Література:
[1]
стор. 216-233, [2]
стор. 208-220, [7]
стор. 371-374
Література:
[1]
стор. 216-233, [2]
стор. 208-220, [7]
стор. 371-374
Чим відрізняються реальні гази від ідеальних? Намалюйте криву, що виражає характер залежності сил взаємодії і потенціальної енергії двох молекул від відстані між ними?
Чи існують універсальні закони, що описують міжмолекулярну взаємодію?
В чому складається природа динамічної рівноваги в двофазній системі?
1. Відхилення властивостей газів від властивостей ідеальних газів
Раніше ми вивчили
ряд законів, що описують властивості
ідеального газу. А саме, рівняння стану
ідеального газу
![]() і основне рівняння кінетичної теорії
ідеального газу
і основне рівняння кінетичної теорії
ідеального газу![]() ,
а також їхні наслідки: закон Бойля-Маріотта
рV=cons;
закон Гей-Люссака
,
а також їхні наслідки: закон Бойля-Маріотта
рV=cons;
закон Гей-Люссака
![]() ;
закон Шарля
;
закон Шарля
![]() ;
закон Дальтона pсм
= p1
+ p2
+ p3
+…; закон
Авогадро.
;
закон Дальтона pсм
= p1
+ p2
+ p3
+…; закон
Авогадро.
Досліди
показують, що закони ідеального газу є
наближеними. Вони добре описують
властивості реальних газів лише при
малій їх густині, тобто при порівняно
малих тисках і досить високих температурах
(оскільки
![]() ).
Відхилення
мають, по-перше, кількісний характер.
Так рівняння Клапейрона для реальних
газів виконується лише наближено.
По-друге, виходячи з цього закону, не
можливо нічого сказати про перехід від
газоподібного до рідкого та твердого
станів.
).
Відхилення
мають, по-перше, кількісний характер.
Так рівняння Клапейрона для реальних
газів виконується лише наближено.
По-друге, виходячи з цього закону, не
можливо нічого сказати про перехід від
газоподібного до рідкого та твердого
станів.
Ізотерми Амага
Зокрема,
закон Бойля-Маріотта задовільно описує
поведінку цілого ряду реальних газів
лише в обмежених інтервалах тисків (![]() )
і при певному значенні температури -
температури Бойля ТБ.
При T
>
TБ,
T
<
TБ
для більшості багатоатомних газів, як
показують експерименти, навіть в області
малих тисків добуток pV
залежить від тиску (pV=f(p)).
)
і при певному значенні температури -
температури Бойля ТБ.
При T
>
TБ,
T
<
TБ
для більшості багатоатомних газів, як
показують експерименти, навіть в області
малих тисків добуток pV
залежить від тиску (pV=f(p)).
Н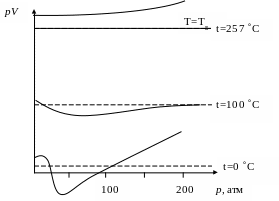 а
рис.1 показані експериментально отримані
ізотерми для вуглекислого газу в
координатах pV
і р
при T=const
- такі ізотерми називають ізотермами
Амага.
а
рис.1 показані експериментально отримані
ізотерми для вуглекислого газу в
координатах pV
і р
при T=const
- такі ізотерми називають ізотермами
Амага.
Рисунок 1 - Ізотерми Амага для вуглекислого газу
Для більшості багатоатомних газів в області малих тисків (від 0 до 20-30 атм) pV зменшується зі зростанням р, а далі зростає з підвищенням р.
Проте, якщо температура реального газу дорівнюватиме певному значенню Т = ТБ (для кожного газу температура Бойля ТБ має своє значення: для водню ТБ = 673 К, для вуглекислого газу ТБ = 530 К), то ізотерми Амага будуть співпадати з ізотермами Бойля-Маріотта в деякому інтервалі тисків і не залежатимуть від тиску. При температурах Т > TБ, як правило, для багатьох газів добуток pV зі зростанням р збільшується.
Залежність
![]() = f(p)
для реального газу
= f(p)
для реального газу
Коефіцієнт
ізотермічної стисливості
для ідеального газу
![]() повинен змінюватися обернено пропорційно
тиску. Експерименти ж показують, що для
реальних газів при великих тисках
спадає з підвищенням тиску швидше, ніж
обернено пропорційно до тиску; при малих
же тисках навпаки газ легше стискається.
повинен змінюватися обернено пропорційно
тиску. Експерименти ж показують, що для
реальних газів при великих тисках
спадає з підвищенням тиску швидше, ніж
обернено пропорційно до тиску; при малих
же тисках навпаки газ легше стискається.
Немає нічого дивного в тому, що реальні гази значно відрізняються за властивостями від ідеальних газів. Пригадати припущення, які ми зробили для виведення рівнянь ідеальних газів: взаємодія між молекулами газу відсутня, власний об’єм молекул не враховувався.
Дослід показує, що ці обидва припущення, покладені в основу теорії ідеального газу, є наближеними. Якщо за нормальних умов (Т=273К, р=105Па) вони ще виправдані, то при тисках р>100атм сили міжмолекулярної взаємодії і об’єм самих молекул повинні враховуватися в рівняннях, що описують поведінку газу.
Приклад.
Радіус молекули r
~
10-10м
![]() її об’єм V
~
10-30
м3.
За нормальних умов в 1м3
знаходиться n
≈
2.7∙1025
молекул. Отже, за цих самих умов власний
об’єм всіх молекул в 1м3
дорівнює
її об’єм V
~
10-30
м3.
За нормальних умов в 1м3
знаходиться n
≈
2.7∙1025
молекул. Отже, за цих самих умов власний
об’єм всіх молекул в 1м3
дорівнює
V0 ~ 10-30∙2.7∙1025 = 2.7∙10-5(м3)
Тобто
![]() ,
,
об’єм молекул становить 0.01% всього об’єму. Тому ми можемо знехтувати як розмірами частинок, так і силами взаємодії між ними, якщо сили взаємодії швидко убувають із збільшенням відстані між молекулами. При р ~ 105 атм власний об’єм молекул матиме той самий порядок, що й об’єм, зайнятий газом, тобто відстань між частинками буде того самого порядку, що й самі розміри молекул, а сили взаємодії будуть помітно проявляти себе не тільки в момент зіткнень.
