
- •Лекція 10 гази з міжмолекулярною взаємодією
- •Відхилення властивостей газів від властивостей ідеальних газів
- •Сили міжмолекулярної взаємодії. Потенціальна енергія взаємодії молекул. Потенціал Леонарда-Джонса
- •Ізотерми реального газу. Перехід від рідкого в газоподібний стан. Критичний стан речовини
- •1. Відхилення властивостей газів від властивостей ідеальних газів
- •2. Сили міжмолекулярної взаємодії
- •3. Ізотерми реального газу. Перехід з рідкого в газоподібний стан. Критичний стан речовини
3. Ізотерми реального газу. Перехід з рідкого в газоподібний стан. Критичний стан речовини
Експериментальні ізотерми реальних газів
Пригадаємо, що фазами системи (тіла) називаються її фізично однорідні частини, які існують одночасно в рівновазі одна з іншою і розділені між собою границею розділу. Якщо дві або більше фаз речовини за даної температури і тиску існують одночасно, торкаючись одна одної, і якщо маса однієї фази не зростає за рахунок іншої, то кажуть про фазову рівновагу. Перехід речовини з одного стану (фази) в інший називають фазовим переходом.
Експерименти підтверджують теоретичні висновки про поведінку системи молекул, які сформульовані вище на базі аналізу міжмолекулярної взаємодії.
Р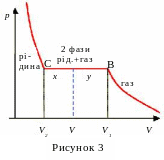 озглянемо
детальніше процес стиснення газу,
наприклад, при температурі Т1
нижче деякого критичного значення. При
стискування газу до об’єму V1
його тиск підвищується до р1.
При подальшому зменшенні об’єму (в
інтервалі від V1
до
V2)
газ поступово перетворюється в рідину
при сталому тиску р
=
р1.
На ділянці ізотерми від В
до С
в посудині одночасно знаходяться дві
фази: рідина і газ, який в даному випадку
називають насиченою парою. У точці С,
що відповідає об’єму V2,
весь газ перетворюється в рідину. Далі
відбувається стиснення рідини при
збільшені тиску. Коефіцієнт ізотермічного
стиснення для рідини значно менший,
ніж для газу.
озглянемо
детальніше процес стиснення газу,
наприклад, при температурі Т1
нижче деякого критичного значення. При
стискування газу до об’єму V1
його тиск підвищується до р1.
При подальшому зменшенні об’єму (в
інтервалі від V1
до
V2)
газ поступово перетворюється в рідину
при сталому тиску р
=
р1.
На ділянці ізотерми від В
до С
в посудині одночасно знаходяться дві
фази: рідина і газ, який в даному випадку
називають насиченою парою. У точці С,
що відповідає об’єму V2,
весь газ перетворюється в рідину. Далі
відбувається стиснення рідини при
збільшені тиску. Коефіцієнт ізотермічного
стиснення для рідини значно менший,
ніж для газу.
Критичний стан речовини
Систематично процес ізотермічного стиснення був досліджений англійським фізиком Томасом Ендрюсом, який досліджував хід ізотерм для вуглекислого газу і на основі цих досліджень ввів поняття критичної температури. Вуглекислий газ було обрано через те, що він має критичну температуру близьку до кімнатної (31 оС) і достатньо невисокий критичний тиск (72,9 атм). Ізотерми Ендрюса представлено на рис. 4.
Я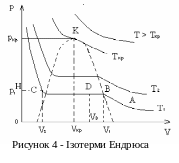 к
бачимо з експериментальних кривих
Ендрюса, при зростанні температури,
ділянка ізотерми ВС,
яка відповідає двофазній системі,
зменшується і при деякій Т
=
Ткр
увесь цей відрізок перетворюється в
точку К.
Цій точці відповідають певні значення
ркр,
Vкр,
Ткр
– критичні параметри речовини. В точці
К
зникає різниця між рідиною і газом,
тобто вони мають однакові фізичні
властивості. Такий стан речовини, в
якому рідина і газ не відрізняються за
своїми фізичними властивостями,
називається критичним.
к
бачимо з експериментальних кривих
Ендрюса, при зростанні температури,
ділянка ізотерми ВС,
яка відповідає двофазній системі,
зменшується і при деякій Т
=
Ткр
увесь цей відрізок перетворюється в
точку К.
Цій точці відповідають певні значення
ркр,
Vкр,
Ткр
– критичні параметри речовини. В точці
К
зникає різниця між рідиною і газом,
тобто вони мають однакові фізичні
властивості. Такий стан речовини, в
якому рідина і газ не відрізняються за
своїми фізичними властивостями,
називається критичним.
Різні речовини мають різні значення критичних параметрів. Наприклад для води Ткр = 647.25К, ркр = 217.72бар, Vкр = 2,5·103 м3кг-1 – питомий критичний об’єм.
Нарешті, при температурах Т>Ткр газ не може бути перетворений в рідину ні при якому тиску.
Газ і рідина на плоскій ділянці увесь час знаходяться в рівновазі і при даній температурі мають певне значення тиску. Тиск на ділянці ВС р1 називається пружністю насиченої пари. Із збільшенням температури тиск насиченої пари зростає. Пара називається насиченою тому, що не можна ще більше збільшити її густину. При спробі збільшення тиску, частина насиченої пари перетвориться в рідину.
Правило відрізків
З
молекулярної точки зору термодинамічна
рівновага - це динамічна
рівновага:
молекули безупинно переходять з однієї
фази в іншу. У крайній лівій точці
плоскої ділянки
весь газ перейшов у рідину, тобто V2
– це об'єм
рідини Vр
(відрізок НС
на рис. 4).
В
правій точці
цієї ділянки
V1
- об'єм
газу Vг
(відрізок НВ).
Отримаємо
відношення
мас рідини
і пари при проміжному об'ємі
V0
(відрізок
НD).
Будемо вважати, що маса речовини дорівнює
одиниці. Якщо
маса речовини
![]() ,
а газу
,
а газу
![]() ,
то
,
то
![]() (6)
(6)
Оскільки
![]() ,
то
це співвідношення можна переписати у
вигляді
,
то
це співвідношення можна переписати у
вигляді
![]() (7)
(7)
Звідки
![]() (8)
(8)
Співвідношення (8) виявляється вірним для будь-яких двохфазових ділянок.
Теплота фазового перетворення
В стані фазової рівноваги, як вже відмічалося раніше, дві або більше різних фаз співіснують одночасно при однакових тисках і температурах, розділені границею, і маса однієї з них не зростає за рахунок іншої.
Для того, щоб маса однієї з фаз збільшилася за рахунок іншої (наприклад, щоб частина рідини перетворилася в пару) при сталій температурі, необхідно підвести до системи певну кількість теплоти. Ця теплота називається теплотою фазового перетворення або, оскільки перехід відбувається без зміни температури, схованою теплотою фазового переходу.
Питома теплота фазового переходу – це кількість теплоти, яку необхідно надати системі, щоб при Т=const перевести одиницю маси речовини, наприклад, з рідкого стану в газоподібний. Схована теплота Q витрачається на розрив зв’язків між молекулами.
З підвищенням температури схована теплота переходу зменшується, а при Т=Ткр вона стає рівною нулю.
Фазові переходи, які відбуваються з поглинанням або виділенням схованої теплоти переходу (випаровування, кристалізація), називаються фазовими переходами 1-го роду.
