
- •МБилет № 1
- •Билет № 2
- •Билет № 3
- •Билет № 4
- •Напишите уравнения реакций:
- •Билет № 5
- •Напишите уравнения реакций:
- •Билет № 6
- •Напишите уравнения реакций:
- •Билет № 7
- •Напишите уравнения реакций:
- •Билет № 8
- •Напишите уравнения реакций:
- •Билет № 9
- •Напишите уравнения реакций:
- •Билет № 10
- •Напишите уравнения реакций:
- •Билет № 11
- •Какой объем воды необходимо добавить к 36%-му раствору соляной кислоты для приготовления 500 г 20%-го раствора?
- •Напишите уравнения реакций:
- •Билет № 12
- •Напишите уравнения реакций:
- •Билет № 13
- •Напишите уравнения реакций:
- •Билет № 14
- •Напишите уравнения реакций:
- •Билет № 15
- •Напишите уравнения реакций:
- •Билет № 16
- •Напишите уравнения реакций:
- •Билет № 17
- •Напишите уравнения реакций:
- •Билет №18
- •Напишите уравнения реакций:
- •Билет №19
- •Напишите уравнения реакций:
- •Билет №20
- •Напишите уравнения реакций:
МБилет № 1
В каких массовых соотношениях надо смешать 37 %-ю соляную кислоту с 15%-ой, чтобы получить 20%-ый раствор?
Рассчитайте значение pH раствора, содержащего 0.005 моль/л Ca(OH)2 в присутствии 0.01 моль/л KCl исходя из: а) молярной концентрации ионов гидроксила; б) активности ионов гидроксила.
Напишите уравнения реакций:
а) H2S + I2 →
б) KO2 + H2O →
в) AgNO3 →t
Сколько теплоты выделится в стандартных условиях при брожении 90 г глюкозы (М = 180 г/моль) по реакции C6H12O6(к) 2С2H5OH(ж) + 2СО2(г), если стандартные энтальпии образования глюкозы, этилового спирта и углекислого газа равны –1270, –80 и –390 кДж/моль соответственно.
Рассчитайте концентрацию ионов комплексообразователя в 0.001 M растворе K2[Cd(CN)4], содержащем 1 М KCN. При какой концентрации ионов S2– начнется выпадение осадка CdS из этого раствора при добавлении к нему K2S?
Kуст ([Cd(CN)4]2–) = 1.31017, KПР(CdS) = 7.810–27.
Билет № 2
Какую массу 50%-го раствора азотной кислоты необходимо добавить к 100 г 10%-го раствора, чтобы приготовить 20%-й раствор?
Рассчитайте значения рН в 0.025 М растворах аммиака, азотистой кислоты и нитрата калия, используя справочные данные. Напишите уравнения протолитических равновесий.
Напишите уравнения реакций:
а) S + NaOH →
б) KClO3 →t
в) FeCl2+Cl2→
При сгорании фосфора в избытке кислорода в стандартных условиях выделилось 149.2 кДж теплоты и образовалось 14.2 г Р2О5. Рассчитайте энтальпию образования Р2О5. Напишите соответствующее термохимическое уравнение.
Рассчитайте концентрацию ионов комплексообразователя в растворе, 1 л которого содержит 0.03 моль [Ag(NH3)2]NO3 и 1 моль аммиака? Какую массу NaCl нужно прибавить к 1 л этого раствора до начала выпадения осадка AgCl? Kуст([Ag(NH3)2]+) = 1.5107, KПР(AgCl) = 1.810–10.
Билет № 3
Какой объем воды необходимо добавить к 36%-му раствору соляной кислоты для приготовления 500 г 20%-го раствора?
Рассчитайте значение рН раствора, полученного после смешивания равных объемов 0.005 М раствора гидроксида натрия и 0.01 М раствора азотной кислоты.
Напишите уравнения реакций:
а) NO2 + H2O →
б) KO2 + H2SO4 →
в) Fe + HNO3(разб) →
Для реакции: C6H14 (ж) + 9.5 O2 (г) → 6 CO2 (г) + 7 H2O (ж),
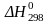 = –4167 кДж/моль.
Рассчитайте стандартную энтальпию
образования гексана (C6H14 (ж)),
используя стандартные энтальпии
образования CO2 (г)
и H2O (ж)
(см. табл.). Напишите термохимическое
уравнение реакции, к которому относится
рассчитанная величина.
= –4167 кДж/моль.
Рассчитайте стандартную энтальпию
образования гексана (C6H14 (ж)),
используя стандартные энтальпии
образования CO2 (г)
и H2O (ж)
(см. табл.). Напишите термохимическое
уравнение реакции, к которому относится
рассчитанная величина.Рассчитайте концентрацию ионов комплексообразователя в растворе, 1 л которого содержит 0.4 моль [Cu(en)2](NO3)2. Какую массу Na2CO3 нужно прибавить к 1 л этого раствора до начала выпадения осадка CuCO3? (Kуст ([Cu (en) 2]2+) = 11020, KПР (CuCO3) = 110–10)
