
- •2.Химический элемент,атом,молекула,ион и.Т.Д
- •3.Химическое соединение,простые вещества,сложные вещества,типы химических соединений.
- •4.Химические соединения,типы солей,свойства и способы получения.
- •Типы солей
- •5.Классификация химических соединений.Оксиды.Свойства и способы получения.
- •Характерные свойства
- •Классификация
- •Классификация
- •Химические свойства [править]Основные оксиды
- •[Править]Кислотные оксиды
- •[Править]Амфотерные оксиды
- •[Править]Получение
- •6.Химические соединения.Типы гидроксидов.Свойства и способы получения
- •Классификация
- •1. Кислотные и основные гидроксиды. Соли
- •2. Кислотные и оснόвные оксиды
- •4. Бинарные соединения
- •7.Кислые соли.Свойства и способы получения.Примеры
- •Получение
- •Химические свойства
- •Двойные и смешанные соли
- •8.Типы химический реакций
- •9.Основные газовые законы.Законы хим.Эквивалентов
- •Закон эквивалентов
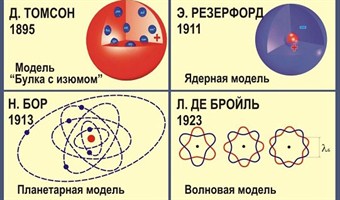
- •10.Строение атома.Планетарная модель атома резерфорда.Постулаты бора
- •Постулаты
- •[Править]Уровни энергии
- •11.Электронные строения атома.Квантовые энергии.Положение электрона в атоме в соотв. С квантовыми числами. Электронное строение атома
- •12.Квантовые числа.Физический смысл каждого из квантовых чисел.Принцип паули
- •Строение атомов и принцип Паули
- •13.Химические свойства атомов.Энергия ионизации.Сродство к электрону и эо.Изменение по группам и периодам
- •[Править]Масса
- •[Править]Размер
- •[Править]Радиоактивный распад
- •[Править]Магнитный момент
- •[Править]Энергетические уровни
- •[Править]Валентность
- •14.Строение электронных оболочек.Правила заполнения электронных орбиталей
- •Оболочки
- •15.Строение атома и систематика хим.Элементов.Периодический закон
- •Субатомные частицы
- •[Править]Электроны в атоме
- •[Править]Свойства атома
- •[Править]Масса
- •[Править]Размер
- •[Править]Радиоактивный распад
- •[Править]Магнитный момент
- •[Править]Энергетические уровни
- •[Править]Валентность
- •Определения
- •15.Квантовые числа.Физический смысл главного и орбитального квантовых чисел
- •16.Распределение электронов в атомах в соответствии с прицнипом паули.Правило хунда,и клечковского.
- •Формулировка правила Клечковского
- •19.Смотри другие билеты,там ответ
- •20.Квантовая модель строения атома.Квантовые числа.Понятия энергетического уровня и электронной оболочки
- •Электронные энергетические уровни
- •Внутриядерные энергетические уровни
- •21.Полярность химической связи.Полярные и неполярные молекулы.Дипольный момент
Электронные энергетические уровни
В современном понятии об орбитальной модели атома, электроны в атоме способны обладать лишь определёнными величинами энергии, и переходить с одного энергетического уровня на другой лишь скачком. Разница между энергетическими уровнями определяет частоту кванта света, выделяемого или поглощаемого при переходе. Каждой паре значенийглавного квантового числа n и орбитального квантового числа l соответствует определённый уровень энергии, которой может обладать электрон.
Внутриядерные энергетические уровни
Термин появился благодаря исследованию радиоактивности. Радиационное излучение разделяется на три части: альфа-лучи, бета-лучи и гамма-лучи. Исследования показали, что альфа-излучение состоит из ядер гелия-4 (см. альфа-частица), бета-излучение является потоком быстро движущихся электронов, а гамма-лучи являются электромагнитными. Поскольку энергии переходов между различными электронными уровнями недостаточно для возникновения гамма-лучей, стало понятно, что их источник нужно искать внутри атомного ядра, то есть ядро атома само может обладать различными энергетическими уровнями, при переходах между которыми и происходит излучение гамма-квантов. Гамма-лучи расширили спектр известных электромагнитных волн, и все волны короче 10−3 нм называются гамма-лучами.
Квантовая модель строения атома
В дальнейшем некоторые положения теории Н. Бора были дополнены и переосмыслены. Наиболее значительным изменением стало введение понятие об электронном облаке, которое сменило понятие об электроне только как частице. Позже теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
Основой современной теории строения атомаявляется планетарная модель, дополненная и усовершенствованная. Согласно данной теории, ядро атома состоит из протонов (положительно заряженных частиц) и нейронов (не имеющих заряда частиц). А вокруг ядра по неопределённым траекториям движутся электроны (отрицательно заряженные частицы).
 Квантовая
модель строения атома
Квантовая
модель строения атома
Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Число электронов в каждой электронной оболочке не превышает определенного максимального значения.
Порядок заполнения электронных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
21.Полярность химической связи.Полярные и неполярные молекулы.Дипольный момент
Полярность химических связей — характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах.
В качестве количественной меры полярности связи используются так называемые эффективные заряды на атомах.
Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный смысл, поскольку невозможно однозначно выделить в молекуле область, относящуюся исключительно к отдельному атому, а при нескольких связях — к конкретной связи.
Наличие эффективного заряда может быть указано символами зарядов у атомов (например, Н+δ — Cl−δ, где δ — некоторая доля элементарного заряда).
Практически все химические связи, за исключениям связей в двухатомных гомоядерных молекулах — в той или иной степени полярны. Ковалентные связи обычно слабо полярны.Ионные связи — сильно полярны.
ПОЛЯРНЫЕ МОЛЕКУЛЫ, молекулы, обладающие постоянным дипольным моментом в отсутствие внеш. электрич. поля. Дипольный момент присущ таким молекулам, у к-рых распределение электронного и ядерного зарядов не имеет центра симметрии. Обычно полярность отдельных фрагментовмолекулы или хим. связей между двумя атомами (или большим числом атомов) определяется величиной соответствующего дипольного момента: чем он больше, тем сильнее полярность.
Под влиянием внеш. электрич. поля в-во поляризуется, т.е. в нем возникает дипольный момент единицы объема. У в-в, состоящих из полярныхмолекул, поляризация обусловлена смещением электронной плотности под влиянием поля и ориентацией молекул в поле. Ориентации молекулпрепятствует тепловое движение, поэтому изучение зависимости поляризации от т-ры позволяет определять дипольный момент молекул (ур-ние Ланжевена-Дебая; см. Диэлектрики). Для двухатомных молекул полярность часто связывают с приближенным представлением электронной волновой ф-ции в рамках валентных связей метода как суммы двух слагаемых, одно из к-рых отвечает ковалентной схеме, другое -ионной валентной схеме. Такое соотнесение позволяет ввести понятие о степени ковалентности или степени ион-ности хим. связи, причем полярность связи определяется в осн. ионной составляющей. Для многоатомных молекул также возможно подобное приближенное выделение в электронной волновой ф-ции ковалентной и ионной составляющих.
В-ва, образованные сильно полярными молекулами, как правило, хорошо раств. в полярных р-рителях, тогда как при отсутствии у молекул сколько-нибудь значит. дипольного момента в-во раств. лишь в неполярных р-рителях. В-ва, включающие сильно полярную концевую группу и объемный неполярный фрагмент (т. наз. дифильные молекулы), обычно относятся к числу поверхностно-активных веществ.
Неполярные молекулы также могут образовать граничный слой, поскольку поверхность металла индуцирует в них дипольный момент. Однако связь их с поверхностью существенно менее прочная. [1]
Неполярные молекулы также вступают во взаимодействие друг с другом. Возникновение сил взаимодействия, названных дисперсионными, обусловлено непрерывным движением, в котором находятся внутренние составные части молекулы - ядра и электроны. Благодаря непрерывному вращению электронов и колебательному движению ядер в каждом из атомов может происходить временное смещение атомных орбиталей относительно ядра и обусловленное этим временное возникновение диполя
еполярные молекулы обладают только индуцированным дипольным моментом. Для полярных молекул сумма постоянного и индуцированного дипольных моментов называется результирующим дипольным моментом, обозначаемым и к. [3]
Неполярные молекулы не имеют постоянных диполей и не могут образовывать обычные связи. Однако неполярные инертные газы конденсируются до жидкостей и в конце концов образуют твердые вещества в случае достаточного охлаждения. Отсюда следует, что некоторый вид межмолекулярной силы удерживает молекулы вместе в растворе и твердом состоянии. Количество энергии, необходимое, чтобы расплавить твердый ксенон, равно 14 9 кДж моль -, что служит доказательством действия сил когезии между молекулами. [4]
Неполярные молекулы взаимодействуют между собой за счет так называемых мгновенных диполей, связанных с мгновенным перераспределением зарядов в неполярных молекулах. Как правило, взаимодействие между неполярными молекулами, называемое дисперсионным, значительно слабее рассмотренных ранее видов взаимодействия. [5]
Электри́ческий ди́польный моме́нт — векторная физическая величина, характеризующая, наряду с суммарным зарядом (и реже используемыми высшими мультипольными моментами), электрические свойства системы заряженных частиц (распределения зарядов) в смысле создаваемого ею поля и действия на нее внешних полей. Главная после суммарного заряда и положения системы в целом (ее радиус-вектора) характеристика конфигурации зарядов системы при наблюдении ее издали.
Дипольный момент — первый[прим 1] мультипольный момент.
Простейшая система зарядов, имеющая определенный (не зависящий от выбора начала координат) ненулевой дипольный момент — это диполь(две точечные частицы с одинаковыми по величине разноимёнными зарядами). Электрический дипольный момент такой системы по модулю равен произведению величины положительного заряда на расстояние между зарядами и направлен от отрицательного заряда к положительному, или:
![]()
— где
q — величина положительного заряда, ![]() —
вектор с началом в отрицательном заряде
и концом в положительном.
—
вектор с началом в отрицательном заряде
и концом в положительном.
Для системы из N частиц электрический дипольный момент равен
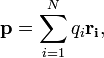
где ![]() —
заряд частицы с номером
—
заряд частицы с номером ![]() а
а ![]() —
её радиус-вектор; или, если суммировать
отдельно по положительным и отрицательным
зарядам:
—
её радиус-вектор; или, если суммировать
отдельно по положительным и отрицательным
зарядам:
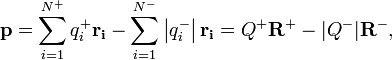
где ![]() —
число положительно/отрицательно
заряженных частиц,
—
число положительно/отрицательно
заряженных частиц, ![]()
![]() —
их заряды;
—
их заряды; ![]() —
суммарные заряды положительной и
отрицательной подсистем и радиус-векторы
их «центров тяжести»[прим
2].
—
суммарные заряды положительной и
отрицательной подсистем и радиус-векторы
их «центров тяжести»[прим
2].
Электрический дипольный момент нейтральной системы зарядов не зависит от выбора начала координат, а определяется относительным расположением (и величинами) зарядов в системе.
Из определения видно, что дипольный момент аддитивен (дипольный момент наложения нескольких систем зарядов равен просто векторной сумме их дипольных моментов), а в случае нейтральных систем это свойство приобретает еще более удобную форму в силу изложенного в абзаце выше.
Подробности определения и формальные свойства [показать]
Электрический дипольный момент (если он ненулевой) определяет в главном приближении электрическое[прим 3] поле диполя (или любой ограниченной системы с суммарным нулевым зарядом) на большом расстоянии от него, а также воздействие на диполь внешнего электрического поля.
Физический и вычислительный смысл дипольного момента состоит в том, что он дает поправки первого порядка (чаще всего — малые) в положение каждого заряда системы по отношению к началу координат (которое может быть условным, но приближенно характеризует положение системы в целом — система при этом подразумевается достаточно компактной). Эти поправки входят в него в виду векторной суммы, и везде, где при вычислениях такая конструкция встречается (а в силу принципа суперпозиции и свойства сложения линейных поправок — см.Полный дифференциал — такая ситуация встречается часто), там в формулах оказывается дипольный момент
Дипо́ль:
Диполь — в электродинамике: идеализированная система, служащая для приближённого описания статического поля или распространения электромагнитных волн вдали от источника (особенно - от источника с нулевым суммарно, но пространственно разделенным зарядом).
