
- •52 Классификация окислительно-восстановительных реакций Межмолекулярные окислительно-восстановительные реакции
- •Внутримолекулярные окислительно- восстановительные реакции
- •53. Составление уравнений окислительно-восстановительных реакций
- •Типичные реакции окисления-восстановления Реакции с участием перманганата калия в качестве окислителя
- •Реакции в кислой среде.
- •Реакции в нейтральной среде
- •Реакции в щелочной среде.
1.Химическое соединение — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов .Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.(Оксиды,основания,соли)
2.Химический элемент-совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева.Атом- наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств.Молекула — электрически нейтральная частица, состоящая из двух или более связанных ковалентными связями атомов.Ион— одноатомная или многоатомная электрически заряженная частица, образующаяся в результате потери или присоединения атомом или молекулой одного или нескольких электронов.Молекулярная масса — масса молекулы, выраженная в атомных единицах массы.Моль — единица измерения количества вещества.Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях.
3.Основные Понятия химии.Закон сохранения массы — исторический закон физики, согласно которому масса как мера количества вещества сохраняется при всех природных процессах, то есть несотворима и неуничтожима.Закон постоянства — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами.Закон кратных отношений — если два элемента образуют друг с другом более одного соединения, то массы одного из элементов, приходящиеся на одну и ту же массу другого элемента, относятся как целые числа, обычно небольшие.Закон Авога́дро — одно из важных основных положений химии, гласящее, что «в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.В результате работ И. В. Рихтера (1792—1800) был открыт закон эквивалентов:все вещества реагируют в эквивалентных отношениях.формула, выражающая Закон эквивалентов: m1Э2=m2Э1.
4.Эквиваленты простых и сложных веществ Эквивалент – это реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода или в окислительно-восстановительной реакции эквивалентна одному электрону. Единица количества эквивалента – моль. Эквивалент химический, условная частица, в целое число раз меньшая (или равная) соответствующей ей формульной единицы - атома, молекулы, иона, радикала
5. Квантовая модель строения атома. В последующие годы некоторые положения теории Бора были переосмыслены и дополнены. Наиболее существенным нововведением явилось понятие об электронном облаке, которое пришло на смену понятию об электроне только как частице. Теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
Свойства элементарных частиц, образующих атом
Частица |
Заряд |
Масса |
||
Кл |
условн. ед. |
г |
а.е.м. |
|
Электрон |
-1,6∙10-19 |
-1 |
9,10∙10-28 |
0,00055 |
Протон |
1,6∙10-19 |
+1 |
1,67∙10-24 |
1,00728 |
Нейтрон |
0 |
0 |
1,67∙10-24 |
1,00866 |
В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна, подобно частице, электрон обладает определенной массой и зарядом; в то же время, движущийся электрон проявляет волновые свойства, например, характеризуется способностью к дифракции. Длина волны электрона λ и его скорость v связаны соотношением де Бройля:
λ = h / mv,
где m — масса электрона.
2. Для электрона невозможно одновременно точно, измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот. Математическим выражением принципа неопределенности служит соотношение
∆x∙m∙∆v > ћ/2,
где ∆х — неопределенность положения координаты, ∆v — погрешность измерения скорости.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части около ядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью.
4. Ядра атомов состоят из протонов и нейтронов (общее название — нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
Последнее положение было сформулировано после того, как в 1920 г. Э.Резерфорд открыл протон, а в 1932 г. Дж.Чедвик — нейтрон.
Различные виды атомов имеют общее название — нуклиды. Нуклиды достаточно характеризовать любыми двумя числами из трех фундаментальных параметров: А — массовое число, Z — заряд ядра, равный числу протонов, и N — число нейтронов в ядре. Эти параметры связаны между собой соотношениями:
Z = А - N, N = А - Z, А= Z + N.
Нуклиды с одинаковым Z, но различными А и N, называют изотопами.
Сформулированные выше положения составляют суть новой теории, описывающей движение микрочастиц, — квантовой механики (механику, применимую к движению обычных тел и описываемую законами Ньютона, стали называть классической механикой). Наибольший вклад в развитие этой теории внесли француз Л. де Бройль, немец В.Гейзенберг, австриец Э.Шредингер, англичанин П.Дирак. Впоследствии каждый из этих ученых был удостоен Нобелевской премии.
6.Правила квантования.Смотри в интернете,там восновном картинки может что и найдешь.
7. Квантовые числа электронов
Главное квантовое число n определяет общую энергию электрона на данной орбитали. Оно может принимать любые целые значения, начиная с единицы (n = 1,2,3, ...). Под главным квантовым числом, равным ∞, подразумевают, что электрону сообщена энергия, достаточная для его полного отделения от ядра (ионизация атома).
Кроме того, оказывается, что в пределах определенных уровней энергии электроны могут отличаться своими энергетическими подуровнями. Существование различий в энергетическом состоянии электронов, принадлежащих к различным подуровням данного энергетического уровня, отражается побочным (иногда его называют орбитальным) квантовым числом l. Это квантовое число может принимать целочисленные значения от 0 до n - 1 (l = 0,1, ..., n - 1). Обычно численные значения l принято обозначать следующими буквенными символами:
Значение l 0 1 2 3 4 Буквенное обозначение s p d f g
В этом случае говорят о s-, р-, d-, f-, g-состояниях электронов, или о s-, р-, d-, f-, g-орбиталях.
Орбиталь — совокупность положений электрона в атоме, т.е. область пространства, в которой наиболее вероятно нахождение электрона.
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, определяет форму электронного облака, а также орбитальный момент р — момент импульса электрона при его вращении вокруг ядра (отсюда и второе название этого квантового числа — орбитальное)
![]()
Таким образом, электрон, обладая свойствами частицы и волны, с наибольшей вероятностью движется вокруг ядра, образуя электронное облако, форма которого в s-, р-, d-, f-, g-состояниях различна.
Подчеркнем,
что форма электронного облака зависит
от значения побочного квантового
числа l.
Так, если l =
0 (s-орбиталь),
то электронное облако имеет шаровидную
форму (сферическую симметрию) и не
обладает направленностью в пространстве 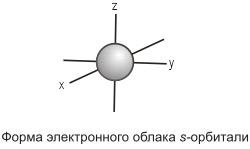
При l =
1 (р-орбиталь) электронное облако имеет
форму гантели, т.е. форму тела вращения,
полученного из «восьмерки» .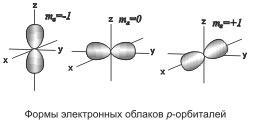 Формы электронных облаков d-, f-
и g-электронов
намного сложнее.
Формы электронных облаков d-, f-
и g-электронов
намного сложнее.
Движение электрона по замкнутой орбите вызывает появление магнитного поля. Состояние электрона, обусловленное орбитальным магнитным моментом электрона (в результате его движения по орбите), характеризуется третьим квантовым числом — магнитным m1. Это квантовое число характеризует ориентацию орбитали в пространстве, выражая проекцию орбитального момента импульса на направление магнитного поля.
Соответственно ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля, магнитное квантовое число m1 может принимать значения любых целых чисел, как положительных, так и отрицательных, от –l до +l, включая 0, т.е. всего (2l + 1) значений.
Таким
образом, m1 характеризует
величину проекции вектора орбитального
момента количества движения на выделенное
направление. Например, р-орбиталь
(«гантель») в магнитном поле может
ориентироваться в пространстве в трех
различных положениях, так как в случае l =
1 магнитное квантовое число может иметь
три значения: -1, 0, +1. Поэтому электронные
облака вытянуты по осям х, y и z,
причем ось каждого из них перпендикулярна
двум другим .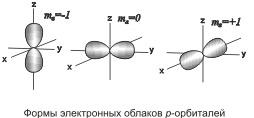
Для объяснения всех свойств атома в 1925 г. была выдвинута гипотеза о наличии у электрона так называемого спина (сначала — для наглядности — считалось, что это явление аналогично вращению Земли вокруг своей оси при движении ее по орбите вокруг Солнца). На самом деле, спин — это чисто квантовое свойство электрона, не имеющее классических аналогов. Строго говоря, спин — это собственный момент импульса электрона, не связанный с движением в пространстве. Для всех электронов абсолютное значение спина всегда равно s = 1/2. Проекция спина на ось = (магнитное спиновое число ms) может иметь лишь два значения: ms = 1/2 или ms = -1/2 .
Поскольку спин электрона s является величиной постоянной, его обычно не включают в набор квантовых чисел, характеризующих движение электрона в атоме, и говорят о четырех квантовых числах.
8. полный пи….
9. В1925 г. швейцарский физик В.Паули (в 1945 г. ему была присуждена Нобелевская премия по физике) установил правило, названное впоследствии принципом Паули (или запретом Паули): В атоме не может быть двух электронов, обладающих одинаковыми свойствами.
Поскольку свойства электронов характеризуются квантовыми числами, принцип Паули часто формулируется так:
В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
Хотя бы одно из квантовых чисел n, l, ml и ms, должно обязательно различаться проекцией спина. Поэтому в атоме могут быть лишь два электрона с одинаковыми n, l и ml: один с ms = +1/2 другой c ms = -1/2 . Напротив, если проекции спина двух электронов одинаковы, должно отличаться одно из квантовых чисел n, l или ml.
Зная принцип Паули, посмотрим, сколько же электронов в атоме может находиться на определенной «орбите» с главным квантовым числом n. Первой «орбите» соответствует n = 1. Тогда l = 0, ml=0 и ms может иметь произвольные значения: +1/2 или -1/2 . Мы видим, что если n = 1, таких электронов может быть только два.
В общем случае, при любом заданном значении n электроны прежде всего отличаются побочным квантовым числом l, принимающим значения от 0 до n 1. При заданных n и l может быть (2l + 1) электронов с разными значениями магнитного квантового числа ml. Это число должно быть удвоено, так как заданным значениям n, l и ml соответствуют два разных значения проекции спина ms.
Следовательно, максимальное число электронов с одинаковым квантовым числом n выражается суммой
![]()
Отсюда ясно, почему на первом энергетическом уровне может быть не больше 2 электронов, на втором — 8, на третьем — 18 и т.д.
Рассмотрим, например, атом гелия. В атоме гелия 2He квантовые числа n = 1, l = 0 и ml = 0 одинаковы для обоих его электронов, а квантовое число ms отличается. Проекции спина электронов гелия могут быть ms = +1/2 или ms = -1/2 . Строение электронной оболочки атома гелия 2Не можно представить как 1s2 или, что то же самое
![]()
Заметим, что в одной квантовой ячейке согласно принципу Паули никогда не может быть двух электронов с параллельными спинами.
Третий электрон лития согласно принципу Паули уже не может находиться в состоянии 1s, а только в состоянии 2s:
![]()
Правило Гунда
При данном значении l (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным.
Если, например, в трех p-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т.е. размещаться на трех разных p-орбиталях:
![]()
В этом случае суммарный спин равен 3/2 , поскольку его проекция равна ms = +1/2-1/2+1/2=1/2 . Эти же три электрона не могут быть расположены таким образом:
![]()
потому что тогда проекция суммарного спина ms = +1/2-1/2+1/2=1/2 . По этой же причине именно так, как приведено выше, расположены электроны в атомах углерода, азота и кислорода.
Рассмотрим далее электронные конфигурации атомов следующего третьего периода. Начиная с натрия 11Nа, заполняется третий энергетический уровень с главным квантовым числом n = 3. Атомы первых восьми элементов третьего периода обладают следующими электронными конфигурациями:
10.Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс.Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток.Ниже приведён длинный вариант (длиннопериодная форма), утверждённый Международным союзом теоретической и прикладной химии (IUPAC) в качестве основного.
11.Степень окисления — условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер.При пользовании степенями окисления полезно придерживаться следующих правил:1) сумма степеней окисления атомов в любой частице равна ее электрическому заряду. Следовательно, степень окисления элемента в его простом веществе равна нулю;2) в соединениях фтор всегда проявляет степень окисления -1;3) степень окисления кислорода в соединениях обычно равна -2 (кроме ОF2, Н2О2 и др.);) степень окисления водорода равна +1 в соединениях с неметаллами и -1 в соединениях с металлами (КН, СаН2).Вале́нтность (от лат. valens — имеющий силу) — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
12.Химическая связь — явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.Металлическая связь Ковалентная связь Ионная связь Ван-дер-ваальсова связь Водородная связь Двухэлектронная трёхцентровая химическая связь.
13.Cвязь между атомами возникает при перекрывании их атомных орбиталей с образованием молекулярных орбиталей (МО). Различают два механизма образования ковалентной связи. ОБМЕННЫЙ МЕХАНИЗМ - в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону: .+.=:ДOНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ - образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора: 0+:=:Метод валентных связей (МВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. В отличие от ММО, в котором простейшая химическая связь может быть как двух-, так и многоцентровой, в МВС она всегда двухэлектронная и обязательно двухцентровая. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности.
14.Сигма (σ)-, пи (π)-связи — приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании π-связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. . Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют π-связью
15.Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.Донорно-акцепторный механизм (иначе координационный механизм) — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов, атома-донора и свободной орбитали атома-акцептора.
17.Электpоoтрицательность χ (греч. хи) — способность атома удерживать внешние (валентные) электроны. Она определяется степенью притяжения этих электронов к положительно заряженному ядру.Это свойство проявляется в химических связях как смещение электронов связи в сторону более электроотрицательного атома.Электpоотрицательность атомов, участвующих в образовании химической связи, – один из главных факторов, который определяет не только ТИП, но и СВОЙСТВА этой связи, и тем самым влияет на характер взаимодействия между атомами при протекании химической реакции.Элeктроотрицательность элементов подчиняется периодическому закону: она растет слева направо в периодах и снизу вверх в главных подгруппах Периодической системы элементов Д.И. Менделеева. лектроотрицательность не является абсолютной константой элемента. Она зависит от эффективного заряда ядра атома, который может изменяться под влиянием соседних атомов или групп атомов, типа атомных орбиталей и характера их гибридизации.
18.Полярность химических связей — характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах.В качестве количественной меры полярности связи используются так называемые эффективные заряды на атомах.Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный смысл, поскольку невозможно однозначно выделить в молекуле область, относящуюся исключительно к отдельному атому, а при нескольких связях — к конкретной связи.Наличие эффективного заряда может быть указано символами зарядов у атомов (например, Н+δ — Cl−δ, где δ — некоторая доля элементарного заряда).Практически все химические связи, за исключениям связей в двухатомных гомоядерных молекулах — в той или иной степени полярны. Ковалентные связи обычно слабо полярны. Ионные связи — сильно полярныПОЛЯРНЫЕ МОЛЕКУЛЫ, молекулы, обладающие постоянным дипольным моментом в отсутствие внеш. электрич. поля. Дипольный момент присущ таким молекулам, у к-рых распределение электронного и ядерного зарядов не имеет центра симметрии. Обычно полярность отдельных фрагментов молекулы или хим. связей между двумя атомами (или большим числом атомов) определяется величиной соответствующего дипольного момента: чем он больше, тем сильнее полярность.
19.Химическая термодинамика использует законы термодинамики применительно к химическим и физико-химическим явлениям. Она рассматривает тепловой и энергетический балансы процессов, а также химические и фазовые равновесия. Эти вопросы играют важную роль в ферментативной кинетике.В термодинамике совокупность исследуемых тел называется системой, а тела, не входящие в нее, - внешним окружением. Рассматриваемые далее законы термодинамики применимы только к закрытым системам. Закрытые системы обмениваются с окружающей средой только энергией, но не массой. Живые организмы представляют собой открытые системы, способные обмениваться с окружающей средой массой и при определенных условиях достигать динамического равновесия (стационарного состояния), но не термодинамического (с максимумом энтропии, см. второй закон термодинамики). В термодинамически-равновесных системах нельзя наблюдать макроскопических изменений. Их внутренняя энергия минимальна, и они находятся в состоянии полной беспорядочности. Живые системы достигают термодинамического равновесия только после смерти, т. е. после полного разложения всего организма. Все открытые системы вместе с их окружением образуют закрытую систему. При наличии теплообмена и возможности хотя бы частичной диффузии между телами, составляющими систему, образуется термодинамическая система. Термодинамическая система может взаимодействовать со своим окружением, и это взаимодействие можно обнаружить по переносу тепла или совершению работы. В том случае, когда взаимодействие системы со средой полностью отсутствует, система называется изолированной. Если состояние термодинамической системы остается неизменным и причиной этого не является какой-либо внешний стационарный процесс, говорят, что система находится в равновесии. Если система состоит из одной фазы, то она гомогенная, в противном случае - гетерогенная. Термодинамические системы можно классифицировать по совокупности их свойств. Экстенсивные свойства, такие как вес и объем, пропорциональны массе. Интенсивные свойства, такие как температура, давление, не зависят от массы. Состояние системы, находящейся в равновесии, можно описать совокупностью ее интенсивных свойств. Они называются термодинамическими параметрами состояния. Термодинамические параметры системы описывают только данное состояние, не учитывая предшествующих. Следовательно, изменение параметров при переходе системы из одного состояния в другое не зависит от пути реакции, а определяется только термодинамическими параметрами начального и конечного состояний.Масса и объем - это общепринятые термины. Давление характеризует взаимодействие с внешним окружением, измеряемое как сила, приходящаяся на единицу площади поверхности. Температура, которая определяется интенсивностью теплового движения молекул, образующих систему, не простое понятие, оно включает понятие разности теплот. Между телами различной температуры происходит теплоперенос, приводящий к выравниванию температур. Абсолютная шкала температур основана на втором законе термодинамики; ее начало находится при абсолютном нуле (-273,16о К). При абсолютном нуле часть энергии любого вещества, которая зависит от температуры (тепловая энергия), равна нулю, хотя энергия частиц, составляющих вещество, при нулевой температуре, естественно, не исчезает. Любое изменение термодинамической системы, приводящее к изменению хотя бы одного термодинамического параметра, называется термодинамическим процессом. Если при протекании термодинамического процесса система проходит равновесные состояния, то при данных условиях работа, совершаемая самой системой, будет максимальна, а работа, свершаемая над системой, - минимальна. В таком случае говорят о равновесном процессе. И наоборот, процесс, протекающий при некотором ограниченном воздействии на систему, определяется как неравновесный. Работа, совершенная такой системой, меньше, чем максимальная работа в равновесном процессе.Если единственным результатом обратного процесса в изолированной системе является возвращение системы из конечного состояния в исходное, то такой процесс называют обратимым. Если в результате прямой или обратной реакции в системе или в ее окружении имеют место длительные изменения, то процесс называют необратимым. Причина необратимости в том, что процессы протекают через неравновесные состояния. Термодинамические параметры однозначны только для обратимых процессов, когда система находится в равновесии в любой момент времени и в каждой ее части. Если вывести систему из состояния устойчивого равновесия, то возникнет термодинамический процесс, препятствующий внешнему воздействию (принцип Ле Шателье-Брауна).
23.Основные понятия термодинамики: система, работа, энергия, теплота.
Системой называется совокупность находящихся во взаимодействии веществ или частиц, мысленно или фактически обособленная от окружающей среды.
Системы бывают открытыми (возможен обмен массы и энергии), закрытыми (обмен энергией), изолированными (никакой обмен не возможен).
Работа — это количественная мера направленного движения частиц, мера энергии передаваемой от одной системы к другой под действием воздействующих сил.
Энергия — общее количественная мера движения взаимодействия всех видов материи.
Теплота — количественная мера хаотического движения частиц данной системы или тела.
Виды термодинамических систем
Охарактеризуем основные особенности термодинамических систем:
1. Термодинамические системы являются системами большого числа частиц, взаимодействующих как друг с другом, так и с внешними полями. Заметим, что число частиц ограничено как сверху, так и снизу. Наличие нижней границы () связано с необходимостью установления в системе равновесного распределения по скоростям частиц и по координатам. Результаты компьютерного моделирования показывают, что такие распределения могут установиться и для систем гораздо меньшего числа частиц (порядка сотен и даже десятков). Однако в этом случае систему гораздо легче вывести из состояния равновесия, а время установления равновесного состояния будет бо’льшим.
Причина ограничения на сверху также связана с тем, что системы существенно больших масштабов, чем макроскопические (системы Мегамира, имеющих масштаб Вселенной или ее частей) не имеют равновесного состояния.
Таким образом, важной особенностью термодинамической системы является ее равновесность (равномерное распределение частиц, температуры, концентрации и других характеристик по объему, занимаемому системой).
2. Для любой термодинамической системы существует состояние термодинамического равновесия, которое оно достигает с течением времени самопроизвольно при фиксированных внешних условиях. Сформулированное положение получило название нулевого начала термодинамики.
Это свойство является специфическим для всех термодинамических систем.
На практике для макроскопических систем под состоянием термодинамического равновесия будем понимать сохранение макроскопических параметров термодинамической системы с течением времени при отсутствии потоков любого типа: вещества, энергии (тепла), энтропии.
Состояние термодинамического равновесия обладает двумя важными свойствами:
2.1. В отличие от механического (статического) равновесия термодинамическое равновесие предполагает наличие теплового движения, т.е. является подвижным. Поэтому макроскопические параметры не фиксированы, а флуктуируют около средних значений. Флуктуациям также подвержены и потоки.
Внутренняя энергия — полная энергия системы за вычетом ее движения как целого и энергии взаимодействия с окружающим миром. Во внутреннюю энергию входят кинетическая энергия движения ядер, электронов, молекул и потенциальная энергия взаимодействия этих частиц. В.Э. — это все виды энергии системы.
Энтальпия H = U + pV — термодинамическая функция, которая учитывает возможность совершения системой механической работы (pV).
24. Первый закон термодинамики. В любом процессе соблюдается закон сохранения энергии, выражаемый равенством q = ∆U + A, которое означает, что теплота q, подведенная к системе, расходуется на увеличение ее внутренней энергии ∆U и на совершение системой работы А над внешней средой. Это уравнение математическое выражение первого закона термодинамики. Из первого закона термодинамики следует, что приращение внутренней энергии системы ∆U в любом процессе равно количеству вещества сообщенной системе теплоты q за вычетом количества совершенной системой работы A.
Расчет теплового эффекта реакции: Если реакция происходит при постоянном давлении, то тепловой эффект связан с изменением энтальпии системы:
Q = - ∆H = H1 — H2, где Н1 — общая энтальпия исходных веществ, а Н2 — энтальпия продуктов реакции.
Так как многие химические реакции происходят при постоянном давлении, то под тепловым эффектом обычно понимают изменение энтальпии в химической реакции, ∆H.
Тепловой эффект химической реакции. Изменение энергии системы при протекании в ней химической реакции при условии, что система не совершает никакой другой работы, кроме работы расширения, называется тепловым эффектом химической реакции. При постоянном давлении — это DH — энтальпия реакции. В стандартных условиях DH0.
Закон Гесса: тепловой эффект химической реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от пути реакции, а определяется только состоянием реагентов и продуктов реакции.
Пример. С(ТВ) + ½ О2(г) = СО(г), DH1= -110 кДж,
СО(г) + ½ О2(г) = СО2(г), DH2= -283 кДж,
С(ТВ) + О2(г) = СО2(г), DH3 = DH1 + DH2 = -393 кДж.
Для расчета тепловых эффектов химических реакций используют следствия из основного закона термохимии — закона Гесса.
Следствие 1. Тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов). Для реакции вида aA + bB = cC + dD тепловой эффект равен
DH = с *DHобр(С) + d *DHобр(D) - a *DHобр(A) — b *DHобр(B).
Теплота образования DHобр — это тепловой эффект образования одного моля соединения из простых веществ при заданных условиях.
Следствие 2. Тепловой эффект химической реакции
aA + bB = cC + dD равен разности теплот сгорания исходных веществ и продуктов реакции (с учетом стехиометрических коэффициентов): DH = a *DHобр(A) + b *DHобр(B) — с *DHобр(С) — d *DHобр(D).
Теплота сгорания — это теплота реакции полного окисления одного моля вещества. Это следствие обычно используют для расчетов органических реакций.
Следствие 3. изменение энтальпии в химической реакции равно разности энергий разрываемых и образующихся химических связей.
Энергия связи А-В — это энергия, необходимая для разрыва связи и разведения образующихся частиц на бесконечное расстояние: АВ(г)→А(г)+В(г).
Энергия связи всегда положительна.
40. Растворами называются гомогенные системы, содержащие не менее двух веществ. Могут существовать растворы твердых, жидких и газообразных веществ в жидких растворителях, а также однородные смеси (растворы) твердых, жидких и газообразных веществ. Как правило, вещество, взятое в избытке и в том же агрегатном состоянии, что и сам раствор, принято считать растворителем, а компонент, взятый в недостатке - растворенным веществом.
Количественный состав раствора чаще всего выражается с помощью понятия «концентрации», под которым понимается содержание растворенного вещества (в определенных единицах) в единице массы или объема.
Договорились растворенное вещество обозначать через X, а растворитель - через S.
Чаще всего для выражения состава раствора используют массовую долю, молярную концентрацию (молярность) и мольную долю.
Массовая доля - это отношение массы растворенного вещества к общей массе раствора. Для бинарного раствора:
![]() (1)
(1)
где ω(Х) - массовая доля растворенного вещества X; m(Х) масса растворенного вещества X, г; m(S) - масса растворителя S, г; m= [m(Х) + m(S)] - масса раствора, г.
Массовую долю выражают в долях единицы или в процентах (например: ω = 0,01 или ω = 1%).
Молярная концентрация (молярность) показывает число молей растворенного вещества, содержащегося в 1 литре раствора:
С(Х) = v(Х) / V, (2)
где С(Х) - молярная концентрация растворенного вещества X, моль/л; v(Х) - количество растворенного вещества X, моль; V - объем раствора, л.
Как следует из (2), молярная концентрация выражается в моль/л. Эта размерность иногда обозначается М, например: 2МNаОН.
Мольная доля растворенного вещества - безразмерная величина, равная отношению количества растворенного вещества к общему количеству веществ в растворе:
![]() (3)
(3)
где N(Х) - мольная доля растворенного вещества X; v(Х) - количество растворенного вещества X, моль; v(S) - количество вещества растворителя S, моль.
Нетрудно представить, что сумма мольных долей растворенного вещества и растворителя равна 1:
N(X) + N(S) = 1. (4)
При решении многих задач полезно переходить от молярной концентрации к массовой доле, мольной доле и т.д. Например, молярная и процентная концентрации взаимосвязаны так:
C(X) = 10 ∙ ω(X) ∙ ρ / M(X), (5)
ω(X) = C(X) ∙ M(X) / (10 ∙ ρ) (6)
где ω(Х) - массовая доля растворенного вещества, выраженная в %; М(Х) - молярная масса растворенного вещества, г/моль; р = m/(1000 V) -плотность раствора, г/мл.
Очень часто концентрацию насыщенного раствора, наряду с вышеперечисленными характеристиками, выражают через так называемыйкоэффициент растворимости или просто растворимость вещества.
Отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют коэффициентом растворимости:
ks = mв-ва / mр-ля . (7)
Растворимость вещества s показывает максимальную массу вещества, которая может раствориться в 100 г растворителя:
s = (mв-ва / mр-ля) ∙ 100. (8)
41Электролиты - проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и протекает ток. Очевидно,чем больше ионов в растворе, тем лучше он проводит электрический ток. Чистая вода электрический ток проводит очень плохо.
Распад электролитов на ионы при растворении их в воде называется элекролитической диссоциацией.
Так, хлорид натрия NaСl при растворении в воде полностью распадается на ионы натрия Na+ и хлорид-ионы Cl-. Вода образует ионы водорода Н+ и гидроксид-ионы ОН- лишь в очень незначительных количествах.
Различают сильные и слабые электролиты.
Сильные электролиты при растворении в воде диссоциируют на ионы.
1) почти все соли;
2) многие минеральные кислоты, например Н2SO4, HNO3, НСl, HBr, HI, НМnО4, НСlО3, НСlО4;
3) основания щелочных и щелочноземельных металлов.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы.
К ним относятся:
1) почти все органические кислоты;
2) некоторые минеральные кислоты, например H2СО3, Н2S, НNO2, HClO, H2SiO3;
3) многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также NH4OH, который можно изображать как гидрат аммиака NH3∙H2O.
К слабым электролитам относится вода.
Слабые электролиты не могут дать большой концентрации ионов в растворе.
Теория электролитической диссоциации:
Для объяснения особенностей водных растворов электролитов шведским ученым С.Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим трем положениям:
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы - положительные и отрицательные.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома - это простые ионы (Na+, Mg2+,Аl3+ и т.д.) - или из нескольких атомов - это сложные ионы (NО3-, SO2-4, РОЗ-4и т.д.).
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду,отрицательно заряженные - к аноду. Поэтому первые называются катионами, вторые - анионами.
Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация - обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов(ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К+ и анион А- в общем виде записывается так:
КА![]() K+ + A-
K+ + A-
Теория электролитической диссоциации является одной из основных теорий в неорганической химии и полностью согласуется с атомно-молекулярным учением и теорией строения атома.
Степень диссоциации (а) — отношение числа молекул, распавшихся на ионы (N’) к общему числу растворенных молекул (N): а = N’/ N;
Сильный электролит — вещество, степень диссоциации которого больше 30%.. к сильным электролитам относят все соли , сильные кислоты, сильные основания.
Слабый электролит — вещество, степень диссоциации которого меньше 3%. к слабым электролитам относят слабые кислоты, слабые основания.
степень диссоциации зависит от концентрации вещества в растворе, поэтому некоторые слабые электролиты при разбавлении могут стать сильными.
константа диссоциации — константа равновесия электролитической диссоциации. она равна отношению произведений концентраций ионов, образующихся при диссоциации, к концентрации исходных частиц.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарногослабого электролита от концентрации раствора:
![]()
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
![]()
где α — степень диссоциации.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
42. Тщательно очищенная от посторонних примесей вода обладает определённой, хотя и незначительной, электрической проводимостью, заметно возрастающей с повышением температуры. Наличие электрической проводимости может быть объяснено только тем, что молекулы воды, частично распадаются на ионы, т.е. H2O является слабым электролитом. Процесс диссоциации воды может быть записанH2O + H2O ↔ H3O+ + OH¯. Этот процесс называется самоионизацией. Реакцию воды часто записывают в более простом виде:H2O ↔ H+ + OH¯. Константа диссоциации воды может быть вычислена по уравнению
Кд = (aH aOH)/aH2O (1). Учитывая, что при комнатной температуре на ионы распадается лишь одна из примерно 108молекул воды, активности ионов в уравнении могут быть заменены их концентрациями , а концентрацию нераспавшихся молекул воды можно считать равной общей концентрации молекул воды. Концентрацию молекул можно рассчитать, разделив массу 1 л воды на массу её моля: 1000/18 = 55,5 моль/л. Считая эту величину постоянной, можно уравнение (1) записать в виде: [H+] [OH¯] = Кд 55,5 = Кв, где Кв — ионное произведение воды. При расчётах связанных с водными растворами электролитов, используют не концентрации, активности ионов: aH·aOH = Кв.
Водородным показателем, или pH, называется взятый с обратным знаком десятичный логарифм активности ионов водорода в растворе: pH = - lg aH. Водородный показатель определяет характер реакции раствора. При pH<7 реакция раствора кислая, при pH>7 — щелочная, при pH=7 — реакция нейтральная. Водородный показатель имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе, так как ионы H+ и OH¯ непосредственно участвуют во многих из этих процессов. Кроме того, эти ионы являются гомогенными катализаторами многих реакций. Величина pH может служить критерием силы кислоты или основания. Водородный показатель играет важную роль в жизнедеятельности организма, так в норме pH сыворотки крови равен 7,40 ± 0,05, слёз — 7,4 ± 0,1. отклонение pH от нормальных значений приводит к расстройству деятельности организма. Существенно влияние на урожайность оказывает pH почвы, на экологию водоёма — pH воды.
43. Гидролизом солей называют реакции обмена между водой и растворенными в ней солями. В результате протекания процесса гидролиза соли растворе появляется некоторое избыточное количество ионов H+ и OH¯, сообщающее раствору кислотные или щелочные свойства. Таким образом, процесс гидролиза соли во многом обратен процессу нейтрализации, т.е. процессу взаимодействия кислот с основаниями. Гидролизу не подвергаются соли, образованные сильными кислотами и основаниями, например KCl.
Гидролиз солей — обратимая или необратимая реакция солей с водой.
1. если соль образована сильным основанием и слабой кислотой НА, то в водном растворе она диссоциирует с образованием ионов кислотного остатка А-,, которые стремятся забрать протоны у воды: А- +H2O ↔ НА + ОН-.
Константа гидролиза выражается через ионное произведение воды и константу диссоциации кислоты: концентрации продукты реакции делятся на исходное вещество.
44. ----
45. Гидролизу подвергаются растворимые соли, в состав которых входит либо катион слабого электролита, либо анион слабого электролита. Если катион слабого электролита – идет гидролиз по катиону. Если анион слабого электролита – идет гидролиз по аниону. Если катион и анион многозарядные – гидролиз идет ступенчато. Если в состав соли входят катион и анион слабых электролитов, идет необратимый гидролиз
1Соли, образованные катионом сильного основания и анионом слабой кислоты. Они подвергаются гидролизу по аниону. К таким солям относятся: Na2CO3, Na2S, K2SO3, CH3COOK, NaCN, Ba(NO2)2 и т. д. Их растворы имеют щелочную реакцию среды, рН » 7. Лакмус в таких растворах синий, фенолфталеин приобретает малиновую окраску, метилоранж - жёлтый. Na2S ↔ 2Na+ + S2- S2- + H2O ↔ HS- + OH- Na2S + H2O ↔ NaHS + NaOH 2. Cоли, образованные катионом слабого основания и анионом сильной кислоты. Они подвергаются гидролизу по катиону.К таким солям относятся: ZnCl2, FeCl3, CuCl2, NH4I, Al2(SO4)3 и др.. Их растворы имеют кислую реакцию среды, рН « 7. Лакмус и метилоранж в таких растворах имеют красный цвет, фенолфталеин не изменяет окраски. FeCl2 ↔ Fe2+ + 2Cl- Fe2+ + H2O ↔ (FeOH)+ + H+ FeCl2 + H2O ↔ FeOHCl + HCl 3. Соли, образованные катионом слабого основания и анионом слабой кислоты. Они подвергаются гидролизу по катиону и по аниону одновременно. К таким солям относятся: CH3COONH4, (NH4)2S, NH4CN. Реакция среды их растворов может быть нейтральной, слабо щелочной или слабо кислотной в зависимости константы диссоциации образующихся продуктов. CH3COONH4 ↔ CH3COO- + NH4+ CH3COO- + NH4+ + H2O ↔ CH3COOH + NH4OH CH3COONH4 + H2O ↔ CH3COOH + NH4OH КД (СН3СООН) = КД (NH4OН) , поэтому рН раствора =7 4. Соли, образованные катионом сильного основания и анионом сильной кислоты не подвергаются гидролизу. К таким солям относятся: NaCl, K2SO4, NaNO3. Их растворы имеют нейтральную реакцию среды, рН = 7. Окраска индикаторов в таких растворах не изменяется. 46. Степень гидролиза увеличивается при разбавлении раствора и повышении температуры. Степень гидролиза уменьшается с понижением температуры раствора, повышением концентрации раствора, введением в раствор одноименных ионов.
Необратимый гидролиз:
Для большинства солей гидролиз обратимый процесс. Однако есть соли, продукты гидролиза которых выводятся из сферы реакции, и гидролиз становится необратимым. Такими солями являются: Al2S3, (NH4)2S, Fe2(CO3)3, (NH4)2SiO3 В уравнениях необратимого гидролиза солей ставится знак равенства: Al2S3 + 6H2O = 2Al(OH)3↓+ 3H2S↑. Необратимому гидролизу подвергаются также бинарные соединения: Mg3N2, CaC2, Р2S5 Пример: 3K2S + 2FeBr3 = Fe2S3 + 6KBr Fe2S3 + 6H2O = 2Fe(OH)3↓ + 3H2S↑ 3K2S + 2FeBr3 + 6H2O = 2Fe(OH)3↓ + 3H2S↑ + 6KBr
52 Классификация окислительно-восстановительных реакций Межмолекулярные окислительно-восстановительные реакции
Окислитель и восстановитель находятся в разных веществах; обмен электронами в этих реакциях происходит между различными атомами или молекулами:
S0 + O20 S+4O2-2
S - восстановитель; O2 - окислитель
Cu+2O + C+2O Cu0 + C+4O2
CO - восстановитель; CuO - окислитель
Zn0 + 2HCl Zn+2Cl2 + H20
Zn - восстановитель; HСl - окислитель
Mn+4O2 + 2KI-1 + 2H2SO4 I20 + K2SO4 + Mn+2SO4 + 2H2O
KI - восстановитель; MnO2 - окислитель.
Сюда же относятся реакции между веществами, в которых атомы одного и того же элемента имеют разные степени окисления
2H2S-2 + H2S+4O3 3S0 + 3H2O
Внутримолекулярные окислительно- восстановительные реакции
Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель.
2KCl+5O3-2 2KCl-1 + 3O20
Cl+5 - окислитель; О-2 - восстановитель
N-3H4N+5O3 –t N2+1O + 2H2O
N+5 - окислитель; N-3 - восстановитель
2Pb(N+5O3-2)2 2PbO + 4N+4O2 + O20
N+5 - окислитель; O-2 - восстановитель
Опыт. Разложение дихромата аммония
(N-3H4)2Cr2+6O7 –t Cr2+3O3 + N20 + 4H2O
Cr+6 - окислитель; N-3 - восстановитель.
Диспропорционирование - окислительно-восстановительная реакция, в которой один элемент одновременно повышает и понижает степень окисления.
Cl20 + 2KOH KCl+1O + KCl-1 + H2O
3K2Mn+6O4 + 2H2O 2KMn+7O4 + Mn+4O2 + 4KOH
3HN+3O2 HN+5O3 + 2N+2O + H2O
2N+4O2 + 2KOH KN+5O3 + KN+3O2 + H2O
В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2.
В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества:
|
|
|
|
|
|
|
Реакции диспропорционирования (самоокисления-самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, состоящих из промежуточных степеней окисления данного элемента:
|
|
|
|
|
|
|
|
53. Составление уравнений окислительно-восстановительных реакций
A Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
Уравнение составляется в несколько стадий:
1. Записывают схему реакции.
KMnO4 + HCl KCl + MnCl2 + Cl2 + H2O
2. Проставляют степени окисления над знаками элементов, которые меняются.
KMn+7O4 + HCl-1 KCl + Mn+2Cl2 + Cl20 + H2O
3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем.
Mn+7 + 5ē Mn+2
2Cl-1 - 2ē Cl20
4. Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления.
Mn+7 + 5ē Mn+2 |
2 |
2Cl-1 - 2ē Cl20 |
5 |
––––––––––––––––––––––––
2Mn+7 + 10Cl-1 2Mn+2 + 5Cl20
5. Подбирают коэффициенты для всех остальных участников реакции.
2KMn+7O4 + 16HCl-1 2KCl + 2Mn+2Cl2 + 5Cl20 + 8H2O
B Электронно-ионный баланс (метод полуреакций) метод нахождения коэффициентов, в котором рассматривается обмен электронами между ионами в растворе с учетом характера среды:
2Cl1- – 2ē |
Cl20 |
|
5 |
MnO41- + 8H+ |
+ 5ē |
Mn2+ + 4H2O |
2 |
7+ |
|
2+ |
|
––––––––––––––––––––––––––––––––––––––
10Cl- + 2MnO41- + 16H+ 5Cl20 + 2Mn2+ + 8H2O
(для уравнивания ионной полуреакции используют H+, OH- или воду)
СУЩНОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Окислительно-восстановительные процессы принадлежат к числу более распространенных хим реакций и имеют большущее значение в теории и практике. Окисление-восстановление—один из важных действий природы. Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд остальных хим действий в базе собственной являются окислительно-восстановительными реакциями. Сжигание топлива в топках паровых котлов и движках внутреннего сгорания, электролитическое осаждение металлов, процессы, происходящие в гальванических элементах и аккумах, включают реакции окисления-восстановления. Получение элементарных веществ (железа, хрома, марганца, золота, серебра, серы, хлора, йода и т.д.) и ценных хим товаров (аммиака, щёлочей, азотной, серной и остальных кислот) базирована на окислительно-восстановительных реакциях. На окислении-восстановлении в аналитической химии основаны способы объёмного анализа: перманганатометрия, йодометрия, броматометрия, и остальные, играющие важную роль при контролировании производственных действий и выполнении научных исследований. В органической химии для проведения ряда хим перевоплощений самое обширное распространение отыскали процессы окисления-восстановления. Инертные газы только в исключительных вариантах способны вступать в окислительно-восстановительные реакции.
54. Активные окислители
Чем
больше абс. величина ![]() или
или ![]() ,
тем более активным окислителем является
данное в-во. Так, при обычных условиях
в р-циях Са + Х2
,
тем более активным окислителем является
данное в-во. Так, при обычных условиях
в р-циях Са + Х2![]() СаХ2 (где
X = Cl, F), Са + 1/2O2,
СаХ2 (где
X = Cl, F), Са + 1/2O2, ![]() CaO
хлор-более активный окислитель, чем О,
но менее активный, чем F2 (
CaO
хлор-более активный окислитель, чем О,
но менее активный, чем F2 (![]() CaO
-603,9, СаСl2 -749,3,
CaF2 -1168,4
кДж/моль).
CaO
-603,9, СаСl2 -749,3,
CaF2 -1168,4
кДж/моль).
Активные восстановители
Чем
больше![]() или
абс. величина
или
абс. величина![]() ,
тем более активным восстановителем
является данное в-во. так, при обычных
условиях в р-циях nМ + mМ'Fn ->
nMFm +
mM'кальций -
более активный восстановитель фторидов металлов (
,
тем более активным восстановителем
является данное в-во. так, при обычных
условиях в р-циях nМ + mМ'Fn ->
nMFm +
mM'кальций -
более активный восстановитель фторидов металлов (![]() CaF2,
отнесенная к одному атому фтора,
- 584,2 кДж/моль),
чем Mg (-535,5 кДж/моль)
и А1 (-477,1 кДж/моль),
но менее активный, чем Li (для LiF
CaF2,
отнесенная к одному атому фтора,
- 584,2 кДж/моль),
чем Mg (-535,5 кДж/моль)
и А1 (-477,1 кДж/моль),
но менее активный, чем Li (для LiF![]() —
588,0 кДж/моль).
—
588,0 кДж/моль).
Влияние среды на характер протекания реакции:
