
- •Кинематика
- •Модели в механике
- •2.Кинематическое описание движения
- •4.Перемещение. Скорость. Вычисление пройденного пути
- •6. Плоское вращение. Угловая скорость и ускорение. Связь между векторами скорости и угловой скорости.
- •Динамика материальной точки
- •1.Основная задача механики. Законы Ньютона
- •2. Система единиц си. Границы применимости классической механики
- •3. Импульс. Закон сохранения импульса системы материальных точек. Применение закона сохранения импульса к абсолютно неупругому удару. Движение тел с переменной массой.
- •4.Момент импульса. Момент силы. Основное уравнение динамики вращательного движения. Закон сохранения момента импульса.
- •5. Силы в природе. Четыре вида взаимодействия. Силы сухого и вязкого трения
- •6. Упругая сила.Закон Гука. Деформация тела
- •7. Энергия. Работа. Мощность. Кинетическия энергия
- •8. Консервативные и неконсервативные силы. Потенциальная энергия
- •9. Закон сохранения энергии в механике
- •10. Применение з-ов сохранения к абсолютно упругому удару
- •11.Закон всемирного тяготения. Движение в центральном поле. Космические скорости. Законы Кеплера
- •Динамика абсолютно твёрдого тела
- •Вращение абсолютно твёрдого тела вокруг неподвижной оси и его кинетическая энергия
- •3.Момент инерции тела и его физический смысл. Пример вычисления момента инерции твёрдого тела. Теорема Штейнера Согласно определению момент инерции твёрдого тела равен
- •Момент инерции тела относительно нецентральной оси Теорема Штейнера
- •6. Гироскоп. Угловая скорость прецессии
- •Колебания
- •1.Уравнения гармонических колебаний и его основные параметры
- •2..Колебания груза под действием упругой сил. Энергия гармонических колебаний
- •Математический и физич маятники
- •4.Уранение затухающих гармонических колебаний. Декремент затухания, добротность.
- •5.Вынужденные колебания. Резонанс
- •6.Сложение гармонических колебаний одинаковой частоты и направления. Векторная диаграмма
- •7. Сложение гармонических колебаний различной частоты. Биения
- •8. Сложение гармонических колебаний одинаковой частоты и взаимно перпендикулярного направления . Фигуры Лиссажу.
- •1.Волновые процессы. Продольные и поперечные волны
- •2.Уравнение плоской гармонической волны и её основный параметры. Фазовая скорость. Волновой пакет. Групповая скорость
- •3.Волновое уравнение
- •4.Фазовая скорость волны в твёрдых телах
- •5. Скорость звука в газах
- •6. Энергия упругой волны. Вектор Умова. Громкость звука
- •7. Стоячие волны. Колебания струны.
- •8. Эффект Доплера для акустических волн
- •Мкт газов
- •1.Статистический и термодинамический методы исследования. Опытные законы идеального газа. Уравнение Клайперона-менделеева
- •2,Основное уравнение молекулярно – кинетической теории газов.
- •Молекулярно-кинетический смысл температуры
- •3,Число степеней свободы. Закон равномерного распределения энергии по степеням свободы молекул газа. Внутренняя энергия идеального газа
- •4.Распределение Максвелла. Средняя, среднеквадратичная и наиболее вероятная скорости газовых молекул.Максвелловское распределение молекул по их скоростям и энергиям
- •5 Барометрическая формула. Распределение Больцмана
- •6.Среднее число столкновений и средняя длина свободного пробега молекул
- •7. Явление переноса в термодинамическинеравноверстных системах. Тепло-проводимость. Диффузия. Вязкость
- •Термодинамика
- •1.Внутренняя энергия системы. Работа и теплота
- •2.Первое начало термодинамики. Графическое изображение термодинамических процессов и работы
- •3.Теплоёмкость вещества. Уравнение Майера
- •4.Адиабатный и политропный процессы идеального газа
- •5.Классическая теория теплоёмкостей идеального газа и её трудности. Квантомеханическое объяснение
- •6,Круговой процесс(цикл) Обратимые и необратимые процессы
- •7.Энтропия , её статистическое толкование и связь с термодинамической вероятностью
- •8,Второе начало термодинамики
- •9. Тепловые двигатели и холодильные машины. Цикл карно. Теорема Карно
- •Реальные газы, жидкости и твёрдые тела
- •1.Силы и потенциальная энергия межмолекулярного взаимодействия
- •2. Уравнение Ван-дер-Ваальса
- •3.Изотермы Ван-дер-Ваальса и их анализ. Критические состояния
- •4. Внутренняя энергия реального газа
- •5.Фазовые переходы 1и 11 рода. Диаграмма состояния. Тройная точка. Уравнение Клайперона-Клаузиуса
- •6.Свойчтва жидкостей. Поверхностное напряжение
- •7. Твёрдые тела. Типы кристаллических твёрдых тел
4.Распределение Максвелла. Средняя, среднеквадратичная и наиболее вероятная скорости газовых молекул.Максвелловское распределение молекул по их скоростям и энергиям
Возьмем идеальный газ. В результате столкновений молекул газа, их скорости все время изменяются, но в газе создается некоторое стационарное распределение молекул по их скоростям .Пусть температура газа T= 300K.Эта таблица называется - распределением молекул по скоростям. Из этого распределения видно, что существует какая-то наиболее вероятная скорость.
Максвелл в 1860 г. получил формулу, которая описывает распределение молекул по скоростям:
 -
Максвелловское
распределение молекул по их скоростямгдеn
– число молекул в единице объема,dn
– число молекул в единице объема, имеющих
скорость в интервале от v
до v+
dv,
-
Максвелловское
распределение молекул по их скоростямгдеn
– число молекул в единице объема,dn
– число молекул в единице объема, имеющих
скорость в интервале от v
до v+
dv,
m – масса молекулы,k – постоянная Больцмана,T – температура.
Построим кривые Максвелла для двух температур (
 ).Физический
смысл кривой Максвелла:
).Физический
смысл кривой Максвелла: - число молекул, имеющих скорости в
единичном интервале скоростей. Возьмем
узкую полоску, которую можно считать
прямоугольной. Ее площадь равна :
- число молекул, имеющих скорости в
единичном интервале скоростей. Возьмем
узкую полоску, которую можно считать
прямоугольной. Ее площадь равна :
 .
.
Тогда
площадь под всей кривой Максвелла равна
n.4)Для
того, чтобы придать вероятностный
характер распределению Максвелла,
введем новую функцию
 - функция
распределения Максвелла молекул по их
скоростям.График
этой функции имеет аналогичный вид, но
теперь площадь под кривой
- функция
распределения Максвелла молекул по их
скоростям.График
этой функции имеет аналогичный вид, но
теперь площадь под кривой
 равна 1.
равна 1. - имеет смысл вероятности того, что
молекула имеет скорость в интервале от
- имеет смысл вероятности того, что
молекула имеет скорость в интервале от
 до
до
 .Согласно
определению функции
имеем
.Согласно
определению функции
имеем
 , откуда видно, что
- плотность
вероятноститого, что молекула имеет
скорость в интервале от
до
.Это
очень важная величина в теории вероятности,
позволяющая вычислять среднее значение
любой физической величины, являющейся
функцией скорости
.
5)От распределения молекул по скоростям
можно перейти к распределению молекул
по их кинетической энергии
.
Для этого надо в распределении молекул
по скоростям выразить
и
, откуда видно, что
- плотность
вероятноститого, что молекула имеет
скорость в интервале от
до
.Это
очень важная величина в теории вероятности,
позволяющая вычислять среднее значение
любой физической величины, являющейся
функцией скорости
.
5)От распределения молекул по скоростям
можно перейти к распределению молекул
по их кинетической энергии
.
Для этого надо в распределении молекул
по скоростям выразить
и
 через
и
через
и
 .
.
 ,
,
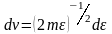 .
.
Производя
вычисления, получим
 - Максвелловскоерасрпеделение
молекул по их кинетическим энергиям.
- Максвелловскоерасрпеделение
молекул по их кинетическим энергиям.
Аналогично вводится :
 -
функция
распределения Максвелла молекул по их
энергиям.
-
функция
распределения Максвелла молекул по их
энергиям.
Характерные скорости молекул идеального газа .
 -
наиболее
вероятная скоростьмолекул
-
наиболее
вероятная скоростьмолекул
Это скорость молекул, при которой функция распределения имеет максимум. Возьмем производную от , и приравняв ее нулю, получим уравнение для нахождения :
 ,
,
 ,
,
 ,
,
 -
наиболее
вероятная скорость молекул
-
наиболее
вероятная скорость молекул
1)<vкв> - средняя квадратичная скорость молекул.
Для нахождения <vкв> можно воспользоваться выражением для средней кинетической энергии <> поступательного движения молекул
 ,
,
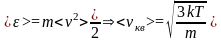 ,
,
или
вычислить интеграл

 - средняя
квадратичная скорость молекул
2)<v>
- средняя
арифметическая скорость молекул.
- средняя
квадратичная скорость молекул
2)<v>
- средняя
арифметическая скорость молекул.
 - средняя
арифметическая скорость молекул
- средняя
арифметическая скорость молекул
Воспользовавшись
соотношением
 ,
формулы для характерных скоростей
молекул можно представить в виде
,
формулы для характерных скоростей
молекул можно представить в виде
 -
наиболее
вероятная скорость молекул,
-
наиболее
вероятная скорость молекул, - средняя
квадратичная скорость молекул,
- средняя
квадратичная скорость молекул,
 -
средняя
арифметическая скорость молекул.
-
средняя
арифметическая скорость молекул.
5 Барометрическая формула. Распределение Больцмана
При выводе основного уравнения молекулярно-кинетической теории газов и макcсвелловского распределения молекул по скоростям предполагалось, что на молекулы газа внешние силы не действуют, поэтому молекулы равномерно распределены по объему. Однако молекулы любого газа находятся в потенциальном поле тяготения Земли. Тяготение, с одной стороны, и тепловое движение молекул — с другой, приводят к некоторому стационарному состоянию газа, при котором давление газа с высотой убывает.
Выведем закон изменения давления с высотой, предполагая, что поле тяготения однородно, температура постоянна и масса всех молекул одинакова. Если атмосферное давление на высоте А равно р (рис. 67), то на высоте h + dh оно равно p+dp(при dh>0 dp<0, так как давление с высотой убывает). Разность давлений р и p + dp равна весу газа, заключенного в объеме цилиндра высотой Ah с основанием площадью, равной единице площади:
р-(p+dp)=gh,
где — плотность газа на высоте h(dhнастолько мало, что при изменении высоты в этом пределе плотность газа можно считать постоянной). Следовательно,
dр=-gdh. (45.1)
Воспользовавшись уравнением состояния идеального газа pV = (m/M)RT (т — масса газа, М—молярная масса газа),
находим, что
Подставив это выражение в (45.1), получим

 С
изменением высоты от h1
до
h2.
давление
изменяется от р1до
p2(рис.
67), т. е.
С
изменением высоты от h1
до
h2.
давление
изменяется от р1до
p2(рис.
67), т. е.
 Выражение
(45.2) называется барометрической
формулой. Она
позволяет найти атмосферное давление
в зависимости от высоты или, измерив
давление, найти высоту. Так как высоты
обозначаются относительно уровня
моря, где давление считается нормальным,
то выражение (45.2) может быть записано в
виде
Выражение
(45.2) называется барометрической
формулой. Она
позволяет найти атмосферное давление
в зависимости от высоты или, измерив
давление, найти высоту. Так как высоты
обозначаются относительно уровня
моря, где давление считается нормальным,
то выражение (45.2) может быть записано в
виде![]() где
р
—
давление на высоте h.Прибор
для определения высоты над земной
поверхностью называется высотомером
(или
альтиметром).
Его
работа основана на использовании
формулы (45.3). Из этой формулы следует,
что давление с высотой убывает тем
быстрее, чем тяжелее газ.Барометрическую
формулу (45.3) можно преобразовать, если
воспользоваться выражением (42.6)
p=nkT:
где
р
—
давление на высоте h.Прибор
для определения высоты над земной
поверхностью называется высотомером
(или
альтиметром).
Его
работа основана на использовании
формулы (45.3). Из этой формулы следует,
что давление с высотой убывает тем
быстрее, чем тяжелее газ.Барометрическую
формулу (45.3) можно преобразовать, если
воспользоваться выражением (42.6)
p=nkT:![]()
где
n—
концентрация молекул на высоте h,
n0—
то же на высоте h=0.
Так как M
= m0NA(NA—
постоянная Авогадро, m0
—масса
одной молекулы), а R=kNA,
то![]() где
m0gh=П
— потенциальная энергия молекулы в
поле тяготения, т. е.
где
m0gh=П
— потенциальная энергия молекулы в
поле тяготения, т. е.
![]() Выражение
(45.5) называется распределением
Больцмана во
внешнем потенциальном поле. Из него
следует, что при постоянной температуре
плотность газа больше там, где меньше
потенциальная энергия его молекул.
Выражение
(45.5) называется распределением
Больцмана во
внешнем потенциальном поле. Из него
следует, что при постоянной температуре
плотность газа больше там, где меньше
потенциальная энергия его молекул.
Если частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределение Больцмана (45.5) справедливо в любом внешнем потенциальном поле, а не только в поле сил тяжести.
