
- •Преобразования Галилея. Механический принцип относительности
- •Угловой скоростью называется векторная величина, равная первой производной угла поворота тела по времени:
- •Момент инерции. Теорема Штейнера.
- •Дифференциальное уравнение вынужденных колебаний (механических и электромагнитных) и его решение
- •Энергия упругой волны.
Энергия упругой волны.
Пусть
плоская продольная волна распространяется
в направлении ОХ в некоторой упругой
среде. Её уравнение: ![]() .
Частицы среды, отклоняясь от положения
равновесия, движутся с некоторыми
скоростями. Следовательно, они обладают
кинетической и потенциальной энергиями.
Выделим
в среде цилиндрический объем
.
Частицы среды, отклоняясь от положения
равновесия, движутся с некоторыми
скоростями. Следовательно, они обладают
кинетической и потенциальной энергиями.
Выделим
в среде цилиндрический объем ![]() V
с площадью основания
S
и высотой
x.
Его величина такова, что можем считать
скорости
частиц
V
с площадью основания
S
и высотой
x.
Его величина такова, что можем считать
скорости
частиц
![]() и относительное
смещение
и относительное
смещение ![]() одинаковыми.
одинаковыми. ![]() Энергия,
заключённая в этом объёме
Энергия,
заключённая в этом объёме ![]() .
Таким образом, плотность
энергии упругой волны
.
Таким образом, плотность
энергии упругой волны
![]() .
Подставим в него уравнение плоской
волны, преобразуем и воспользуемся тем,
что
.
Подставим в него уравнение плоской
волны, преобразуем и воспользуемся тем,
что ![]() :
:
![]() .
Затем найдём среднюю
по периоду плотность энергии:
.
Затем найдём среднюю
по периоду плотность энергии:
![]() .
Из
выражения для плотности энергии видно,
что её величина меняется со временем
от 0 до некоторого максимального значения,
а значит, энергия от источников колебания
переносится волной из одного места
пространства в другое со скоростью
.
Из
выражения для плотности энергии видно,
что её величина меняется со временем
от 0 до некоторого максимального значения,
а значит, энергия от источников колебания
переносится волной из одного места
пространства в другое со скоростью ![]() Волна осуществляет процесс переноса
энергии, но не вещества. Перенос энергии
осуществляется посредством сил упругого
взаимодействия между частицами среды.
Количество энергии, переносимое через
некоторую поверхность за единицу
времени, называется потоком
энергии
через эту поверхность:
Волна осуществляет процесс переноса
энергии, но не вещества. Перенос энергии
осуществляется посредством сил упругого
взаимодействия между частицами среды.
Количество энергии, переносимое через
некоторую поверхность за единицу
времени, называется потоком
энергии
через эту поверхность: ![]() .
Для более детальной характеристики
процесса переноса энергии используется
вектор плотности
потока энергии
.
Для более детальной характеристики
процесса переноса энергии используется
вектор плотности
потока энергии ![]() .
По величине он равен потоку энергии,
переносимой через площадку, перпендикулярную
направлению распространения волны,
делённому на площадь этой площадки:
.
По величине он равен потоку энергии,
переносимой через площадку, перпендикулярную
направлению распространения волны,
делённому на площадь этой площадки: ![]() – последнее – вектор
Умова.
По направлению он совпадает с направлением
распространения волны.
Среднее
– последнее – вектор
Умова.
По направлению он совпадает с направлением
распространения волны.
Среднее
![]() .
Модуль этого
.
Модуль этого
выражения называется интенсивностью волны.
Скорость упругих волн в твёрдой среде.
волновое
уравнение ![]() .
Скорость
распространения волны
определяется модулем Юнга и плотностью
среды:
.
Скорость
распространения волны
определяется модулем Юнга и плотностью
среды: ![]() .
.
Термодинамика — раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Термодинамика не рассматривает микропроцессы, которые лежат в основе этих превращений. Этим термодинамический метод отличается от статистического. Термодинамика базируется на двух началах — фундаментальных законах, установленных в результате обобщения опытных данных.
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным (например, кислород и гелий), а также при низких давления» и высоких температурах близки по своим свойствам к идеальному газу. Кроме того, внеся поправки, учитывающие собственный объем молекул газа и действующие молекулярные силы, можно перейти к теории реальных газов. Уравнение Клапейрона — Менделеева
Как уже указывалось, состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением р, объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния, которое в общем виде дается выражением
![]()
где каждая из переменных является функцией двух других.
Уравнению
![]() удовлетворяет
лишь идеальный газ, и оно является
уравнением состояния идеального газа,
называемым также уравнением Клапейрона
— Менделеева.
удовлетворяет
лишь идеальный газ, и оно является
уравнением состояния идеального газа,
называемым также уравнением Клапейрона
— Менделеева.
Уравнение
Клапейрона — Менделеева для массы т
газа![]() где
=m/M
— количество вещества.
где
=m/M
— количество вещества.
Первое начало термодинамики
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
Изменение
внутренней энергии системы при переходе
её из одного состояния в другое равно
сумме работы внешних сил и количества
теплоты, переданного системе, то есть,
оно зависит только от начального и
конечного состояния системы и не зависит
от способа, которым осуществляется этот
переход. Это определение особенно важно
для химической термодинамики (ввиду
сложности рассматриваемых процессов).
Иными словами, внутренняя энергия
является функцией состояния. В циклическом
процессе внутренняя энергия не
изменяется.![]()
Представляет
собой формулировку обобщённого закона
сохранения энергии для термодинамических
процессов. В наиболее простой форме его
можно записать как
![]() ,
где
,
где
![]() есть полный дифференциал внутренней
энергии системы, а
есть полный дифференциал внутренней
энергии системы, а
![]() и
и
![]() есть
элементарное количество теплоты,
переданное системе, и элементарная
работа, совершенная системой соответственно.
Нужно учитывать, что
и
нельзя считать дифференциалами в обычном
смысле этого понятия, поскольку эти
величины существенно зависят от типа
процесса, в результате которого состояние
системы изменилось.
есть
элементарное количество теплоты,
переданное системе, и элементарная
работа, совершенная системой соответственно.
Нужно учитывать, что
и
нельзя считать дифференциалами в обычном
смысле этого понятия, поскольку эти
величины существенно зависят от типа
процесса, в результате которого состояние
системы изменилось.
Теплоёмкость
тела
(обычно обозначается латинской буквой
C) — физическая величина, определяющая
отношение бесконечно малого количества
теплоты δQ, полученного телом, к
соответствующему приращению его
температуры δT:
![]() Для
примера, в молекулярно-кинетической
теории газов показывается, что молярная
теплоёмкость
идеального
газа с i степенями свободы при
постоянном объёме
(для одного моля идеального газа)
равна:
Для
примера, в молекулярно-кинетической
теории газов показывается, что молярная
теплоёмкость
идеального
газа с i степенями свободы при
постоянном объёме
(для одного моля идеального газа)
равна:![]() где
R ≈ 8,31 Дж/(моль·К) — универсальная газовая
постоянная.
А при
постоянном давлении
где
R ≈ 8,31 Дж/(моль·К) — универсальная газовая
постоянная.
А при
постоянном давлении![]() Энтальпи́я,
также тепловая функция и теплосодержание
— термодинамический потенциал,
характеризующий состояние системы в
термодинамическом равновесии при выборе
в качестве независимых переменных
давления, энтропии и числа частиц.
Проще
говоря, энтальпия - это та энергия,
которая доступна для преобразования в
теплоту при определенных температуре
и давлении.
Если термомеханическую
систему рассматривать как состоящую
из макротела (газа) и поршня с грузом
весом Р = p S, уравновешивающего давление
газа р внутри сосуда, то такая система
называется расширенной.
Энтальпия
или энергия расширенной системы Е равна
сумме внутренней энергии газа U и
потенциальной энергии поршня с грузом
Eпот = pSx = pV
Энтальпи́я,
также тепловая функция и теплосодержание
— термодинамический потенциал,
характеризующий состояние системы в
термодинамическом равновесии при выборе
в качестве независимых переменных
давления, энтропии и числа частиц.
Проще
говоря, энтальпия - это та энергия,
которая доступна для преобразования в
теплоту при определенных температуре
и давлении.
Если термомеханическую
систему рассматривать как состоящую
из макротела (газа) и поршня с грузом
весом Р = p S, уравновешивающего давление
газа р внутри сосуда, то такая система
называется расширенной.
Энтальпия
или энергия расширенной системы Е равна
сумме внутренней энергии газа U и
потенциальной энергии поршня с грузом
Eпот = pSx = pV
![]() Согласно
закону Джоуля, выведенному эмпирически,
внутренняя
энергия идеального газа
не зависит от давления или объёма. Исходя
из этого факта, можно получить выражение
для изменения внутренней энергии
идеального газа. По определению молярной
теплоёмкости при постоянном объёме,
Согласно
закону Джоуля, выведенному эмпирически,
внутренняя
энергия идеального газа
не зависит от давления или объёма. Исходя
из этого факта, можно получить выражение
для изменения внутренней энергии
идеального газа. По определению молярной
теплоёмкости при постоянном объёме,
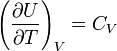 . Так как внутренняя энергия идеального
газа является функцией только от
температуры, то
. Так как внутренняя энергия идеального
газа является функцией только от
температуры, то .
Эта
же формула верна и для вычисления
изменения внутренней энергии любого
тела, но только в процессах при постоянном
объёме (изохорных процессах); в общем
случае
.
Эта
же формула верна и для вычисления
изменения внутренней энергии любого
тела, но только в процессах при постоянном
объёме (изохорных процессах); в общем
случае
![]() является
функцией и температуры, и объёма.
Если
пренебречь изменением молярной
теплоёмкости при изменении температуры,
получим:
является
функцией и температуры, и объёма.
Если
пренебречь изменением молярной
теплоёмкости при изменении температуры,
получим:
![]() ,
где
,
где
![]() — количество вещества,
— количество вещества,
![]() —
изменение температуры.
—
изменение температуры.
Для
любого идеального газа справедливо
соотношение
Майера:
![]() где
— универсальная газовая постоянная,
где
— универсальная газовая постоянная,
![]() —
молярная теплоёмкость при постоянном
давлении,
—
молярная теплоёмкость при постоянном
давлении,
![]() —
молярная теплоёмкость при постоянном
объёме.
—
молярная теплоёмкость при постоянном
объёме.
Уравнение
Майера
вытекает из первого начала термодинамики,
примененного к изобарному процессу в
идеальном газе:![]() в
рассматриваемом случае:
в
рассматриваемом случае:![]()
![]() Очевидно,
уравнение Майера показывает, что различие
теплоёмкостей газа равно работе,
совершаемой одним молем идеального
газа при изменении его температуры на
1 K, и разъясняет смысл универсальной
газовой постоянной — механический
эквивалент теплоты.
Очевидно,
уравнение Майера показывает, что различие
теплоёмкостей газа равно работе,
совершаемой одним молем идеального
газа при изменении его температуры на
1 K, и разъясняет смысл универсальной
газовой постоянной — механический
эквивалент теплоты.
Работа,
совершенная идеальным газом в
изотермическом
процессе,
равна![]() , где
, где
![]() —
число частиц газа,
— температура,
—
число частиц газа,
— температура,
![]() и
и![]() — объём газа в начале и конце процесса,
— постоянная Больцмана .
В твёрдом
теле и большинстве жидкостей изотермические
процессы очень мало изменяют объём
тела, если только не происходит фазовый
переход.
Первый
закон термодинамики для изотермического
процесса
записывается в виде:
— объём газа в начале и конце процесса,
— постоянная Больцмана .
В твёрдом
теле и большинстве жидкостей изотермические
процессы очень мало изменяют объём
тела, если только не происходит фазовый
переход.
Первый
закон термодинамики для изотермического
процесса
записывается в виде:
![]()
![]() Из
определения работы следует, что изменение
работы
при изохорном процессе
равно:
Из
определения работы следует, что изменение
работы
при изохорном процессе
равно:![]()
Чтобы
определить полную работу процесса
проинтегрируем данное выражение.
Поскольку объем неизменен, то:![]() ,
Но
такой интеграл равен нулю. Итак, при
изохорном процессе газ работы не
совершает:
,
Но
такой интеграл равен нулю. Итак, при
изохорном процессе газ работы не
совершает:![]() .
.
Используя
первое
начало термодинамики
можно найти количество теплоты при
изохорном процессе:![]() Но
при изохорном процессе газ не выполняет
работу. То есть, имеет место равенство:
Но
при изохорном процессе газ не выполняет
работу. То есть, имеет место равенство:
![]() ,то
есть вся теплота, которую получает газ
идёт на изменение его внутренней энергии.
,то
есть вся теплота, которую получает газ
идёт на изменение его внутренней энергии.
Работа,
совершаемая газом при расширении или
сжатии газа,
равна
![]()
Первое начало термодинамики:
при
изобарном процессе![]() при
изохорном процессе (
при
изохорном процессе (![]() )
)![]() при
изотермическом процессе
при
изотермическом процессе![]()
![]()
Адиабати́ческий,
или адиаба́тный проце́сс—
термодинамический процесс в макроскопической
системе, при котором система не
обменивается тепловой энергией с
окружающим пространством. Адиабатический
процесс для идеального газа описывается
уравнением Пуассона.
Если
термодинамический процесс в общем
случае являет собой три процесса —
теплообмен, совершение системой (или
над системой) работы и изменение её
внутренней энергии, то адиабатический
процесс в силу отсутствия теплообмена
(![]() )
системы со средой сводится только к
последним двум процессам. Поэтому,
первое начало термодинамики в этом
случае приобретает вид
)
системы со средой сводится только к
последним двум процессам. Поэтому,
первое начало термодинамики в этом
случае приобретает вид![]() где
где
![]() —
изменение внутренней энергии тела,
—
работа, совершаемая системой.
Изменения
энтропии S системы в обратимом
адиабатическом процессе вследствие
передачи тепла через границы системы
не происходит:
—
изменение внутренней энергии тела,
—
работа, совершаемая системой.
Изменения
энтропии S системы в обратимом
адиабатическом процессе вследствие
передачи тепла через границы системы
не происходит:
![]() Здесь
—
температура системы,
Здесь
—
температура системы,
![]() — теплота, полученная системой. Благодаря
этому адиабатический процесс может
быть составной частью обратимого цикла.
— теплота, полученная системой. Благодаря
этому адиабатический процесс может
быть составной частью обратимого цикла.
Понятие
работы
применительно к адиабатическому
процессу.
В частном случае, когда работа совершается
через изменение объёма, можно определить
её следующим способом: пусть газ заключён
в цилиндрический сосуд, плотно закрытый
легко скользящим поршнем, если газ будет
расширяться, то он будет перемещать
поршень и при перемещении на отрезок![]() совершать работу
совершать работу
![]()
 где
F — сила, с которой газ действует на
поршень.
Перепишем уравнение:
где
F — сила, с которой газ действует на
поршень.
Перепишем уравнение:
![]() где
s — площадь поршня. Тогда работа будет
равна
где
s — площадь поршня. Тогда работа будет
равна
![]() где
где
![]() — давление газа,
— давление газа,
![]() —
малое приращение объёма. Аналогично
видно, что уравнение выполняется и для
сосудов с произвольной поперечной
формой сечения. Данное уравнение
справедливо и при расширении на
произвольных объёмах. Для этого достаточно
разбить поверхность расширения на
элементарные участки на которых
расширение одинаково.
—
малое приращение объёма. Аналогично
видно, что уравнение выполняется и для
сосудов с произвольной поперечной
формой сечения. Данное уравнение
справедливо и при расширении на
произвольных объёмах. Для этого достаточно
разбить поверхность расширения на
элементарные участки на которых
расширение одинаково.
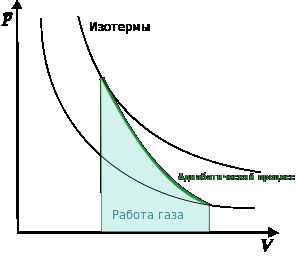
График
адиабаты (жирная линия) на диаграмме
для газа![]() .
.
— давление газа;
— объём.
Адиабата Пуассона
Для
идеальных газов, чью теплоёмкость можно
считать постоянной, в случае
квазистатического процесса адиабата
имеет простейший вид и определяется
уравнением![]()
С
учётом уравнения состояния идеального
газа уравнение адиабаты может быть
преобразовано к виду![]() Или к виду
Или к виду![]() Поскольку
Поскольку
![]() всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении
всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении![]() ) газ нагревается (
возрастает), а при расширении —
охлаждается, что всегда верно и для
реальных газов. Нагревание при сжатии
больше для того газа, у которого больше
коэффициент
.
) газ нагревается (
возрастает), а при расширении —
охлаждается, что всегда верно и для
реальных газов. Нагревание при сжатии
больше для того газа, у которого больше
коэффициент
.
Термодинами́ческие ци́клы — круговые процессы в термодинамике, то есть такие процессы, в которых начальные и конечные параметры, определяющие состояние рабочего тела (давление, объём, температура, энтропия), совпадают. Термодинамические циклы являются моделями процессов, происходящих в реальных тепловых машинах для превращения тепла в механическую работу.
Для
того, чтобы управлять состоянием рабочего
тела, в тепловую машину входят нагреватель
и холодильник. В каждом цикле рабочее
тело забирает некоторое количество
теплоты (![]() )
у нагревателя и отдаёт количество
теплоты
)
у нагревателя и отдаёт количество
теплоты
![]() холодильнику. Работа, совершённая
тепловой машиной в цикле, равна, таким
образом,
холодильнику. Работа, совершённая
тепловой машиной в цикле, равна, таким
образом,
![]() ,
так как изменение внутренней энергии
,
так как изменение внутренней энергии
![]() в круговом процессе равно нулю (это
функция состояния).
Напомним, что
работа не является функцией состояния,
иначе суммарная работа за цикл также
была бы равна нулю.
в круговом процессе равно нулю (это
функция состояния).
Напомним, что
работа не является функцией состояния,
иначе суммарная работа за цикл также
была бы равна нулю.
При этом нагреватель потратил энергию . Поэтому тепловой, или, как его ещё называют, термический или термодинамический коэффициент полезного действия тепловой машины (отношение полезной работы к затраченной тепловой энергии) равен
![]() .
.
Цикл Карно и максимальный КПД тепловой машины Цикл Карно́ — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Состоит из 2 адиабатических и 2 изотермических процессов.
Представим себе следующий цикл:
Фаза
А→Б. Рабочее тело с температурой, равной
температуре нагревателя, приводится в
контакт с нагревателем. Нагреватель
сообщает рабочему телу
![]() тепла в изотермическом процессе (при
постоянной температуре), при этом объём
рабочего тела увеличивается.
тепла в изотермическом процессе (при
постоянной температуре), при этом объём
рабочего тела увеличивается.
Фаза Б→В. Рабочее тело отсоединяется от нагревателя и продолжает расширяться адиабатически (без теплообмена с окружающей средой). При этом его температура уменьшается до температуры холодильника.
Фаза
В→Г. Рабочее тело приводится в контакт
с холодильником и передает ему
![]() тепла
в изотермическом процессе. При этом
объём рабочего тела уменьшается.
тепла
в изотермическом процессе. При этом
объём рабочего тела уменьшается.
Фаза Г→А. Рабочее тело адиабатически сжимается до исходного размера, и его температура увеличивается до температуры нагревателя.
Его КПД равен, таким образом,
![]()
Второе начало термодинамики Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара»
Математическая
формулировка второго закона
термодинамики
Для
обратимого цикла Карно можем записать:
![]() Отсюда
следует:
Отсюда
следует:![]() или
или
![]() .
Величина
Q2 – количество теплоты, отдаваемой
рабочим телом, имеет знак минус, поэтому
.
Величина
Q2 – количество теплоты, отдаваемой
рабочим телом, имеет знак минус, поэтому
![]() или
или
![]() .
Отношение
.
Отношение
![]() называется приведённой теплотой, и
полученное выражение можно прокомментировать
так: в обратимом цикле Карно сумма
приведенных теплот равна нулю.
Можно
показать, что равенство нулю приведённой
теплоты будет выполняться для любого
обратимого цикла.
называется приведённой теплотой, и
полученное выражение можно прокомментировать
так: в обратимом цикле Карно сумма
приведенных теплот равна нулю.
Можно
показать, что равенство нулю приведённой
теплоты будет выполняться для любого
обратимого цикла.
Неравенство
Клаузиуса
: Количество теплоты, полученное системой
при любом круговом процессе, делённое
на абсолютную температуру, при которой
оно было получено (приведённое количество
теплоты), неположительно.

Энтропи́я— в естественных науках мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния.
Определённая
как сумма приведённых теплот, она
является функцией состояния и остаётся
постоянной при обратимых процессах,
тогда как в необратимых — её изменение
всегда положительно.
![]() ,
где
,
где
![]() — приращение энтропии;
— минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса.
— приращение энтропии;
— минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса.
![]()
![]()
![]() Полученные неравенства выражают собой
закон
возрастания энтропии,
который можно сформулировать следующим
образом:
В
адиабатически изолированной
термодинамической системе энтропия не
может убывать: она или сохраняется, если
в системе происходят только обратимые
процессы, или возрастает, если в системе
протекает хотя бы один необратимый
процесс.
Записанное утверждение является ещё
одной формулировкой второго начала
термодинамики.
Третье
начало термодинамики (теорема Нернста)
— физический принцип, определяющий
поведение энтропии при приближении
температуры к абсолютному нулю.
Третье
начало термодинамики может быть
сформулировано так:
«Приращение
энтропии при абсолютном нуле температуры
стремится к конечному пределу, не
зависящему от того, в каком равновесном
состоянии находится система».
Полученные неравенства выражают собой
закон
возрастания энтропии,
который можно сформулировать следующим
образом:
В
адиабатически изолированной
термодинамической системе энтропия не
может убывать: она или сохраняется, если
в системе происходят только обратимые
процессы, или возрастает, если в системе
протекает хотя бы один необратимый
процесс.
Записанное утверждение является ещё
одной формулировкой второго начала
термодинамики.
Третье
начало термодинамики (теорема Нернста)
— физический принцип, определяющий
поведение энтропии при приближении
температуры к абсолютному нулю.
Третье
начало термодинамики может быть
сформулировано так:
«Приращение
энтропии при абсолютном нуле температуры
стремится к конечному пределу, не
зависящему от того, в каком равновесном
состоянии находится система».
![]() или
или
 где
— любой термодинамический параметр.
где
— любой термодинамический параметр.
Ц икл
Карно́
— идеальный термодинамический цикл.
Тепловая машина Карно, работающая по
этому циклу, обладает максимальным КПД
из всех машин, у которых максимальная
и минимальная температуры осуществляемого
цикла совпадают соответственно с
максимальной и минимальной температурами
цикла Карно. Состоит из 2 адиабатических
и 2 изотермических процессов.
икл
Карно́
— идеальный термодинамический цикл.
Тепловая машина Карно, работающая по
этому циклу, обладает максимальным КПД
из всех машин, у которых максимальная
и минимальная температуры осуществляемого
цикла совпадают соответственно с
максимальной и минимальной температурами
цикла Карно. Состоит из 2 адиабатических
и 2 изотермических процессов.
Представим себе следующий цикл:
Фаза А→Б. Рабочее тело с температурой, равной температуре нагревателя, приводится в контакт с нагревателем. Нагреватель сообщает рабочему телу тепла в изотермическом процессе (при постоянной температуре), при этом объём рабочего тела увеличивается.
Фаза Б→В. Рабочее тело отсоединяется от нагревателя и продолжает расширяться адиабатически (без теплообмена с окружающей средой). При этом его температура уменьшается до температуры холодильника.
Фаза В→Г. Рабочее тело приводится в контакт с холодильником и передает ему тепла в изотермическом процессе. При этом объём рабочего тела уменьшается.
Фаза Г→А. Рабочее тело адиабатически сжимается до исходного размера, и его температура увеличивается до температуры нагревателя.
Его КПД равен, таким образом,
Теплова́я маши́на — устройство, преобразующее тепловую энергию в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник). Преобразование осуществляется за счёт изменения внутренней энергии рабочего тела — на практике обычно пара или газа.
Энтропи́я—
в естественных науках мера беспорядка
системы, состоящей из многих
элементов.
Определённая как сумма
приведённых теплот, она является функцией
состояния и остаётся постоянной при
обратимых процессах, тогда как в
необратимых — её изменение всегда
положительно.
,
где
— приращение энтропии;
— минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса.
Изменение
энтропии при
квазистатическом
изобарном процессе
равно
![]() . В случае, если изобарный процесс
происходит в идеальном газе, то
. В случае, если изобарный процесс
происходит в идеальном газе, то
![]() ,
следовательно, изменение энтропии можно
выразить как
,
следовательно, изменение энтропии можно
выразить как
![]() . Если пренебречь зависимостью
от
температуры, то
. Если пренебречь зависимостью
от
температуры, то
![]() .
Энтропия
при изохорном процессе
Поскольку
в системе при изохорном процессе
происходит теплообмен с внешней средой,
то происходит изменение энтропии. Из
определения энтропии следует:
.
Энтропия
при изохорном процессе
Поскольку
в системе при изохорном процессе
происходит теплообмен с внешней средой,
то происходит изменение энтропии. Из
определения энтропии следует:![]() Выше
была выведена формула для определения
количества теплоты. Перепишем ее в
дифференциальном виде:
Выше
была выведена формула для определения
количества теплоты. Перепишем ее в
дифференциальном виде:
![]() ,где
ν — количество вещества,
,где
ν — количество вещества,
![]() —
молярная теплоемкостью при постоянном
объеме. Итак, микроскопическое изменение
энтропии при изохорном процессе можно
определить по формуле:
—
молярная теплоемкостью при постоянном
объеме. Итак, микроскопическое изменение
энтропии при изохорном процессе можно
определить по формуле:![]()
Или, если проинтегрировать последнее выражение, полное изменение энтропии в этом процессе:
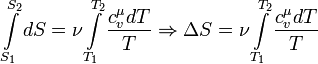
В данном случае выносить выражение молярной теплоемкости при постоянном объеме за знак интеграла нельзя, поскольку она является функцией, которая зависит от температуры. Термодинамическая энтропия S, часто просто именуемая энтропия, в химии и термодинамике является функцией состояния термодинамической системы.
изменение
энтропии термодинамической системы
при обратимом процессе как отношение
общего количества тепла
![]() к
величине абсолютной температуры
(то есть тепло, переданное системе, при
постоянной температуре):
к
величине абсолютной температуры
(то есть тепло, переданное системе, при
постоянной температуре):
.
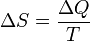
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ. В основе молекулярно-кинетической теории лежат три основных положения: 1)Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы. 2) Атомы и молекулы находятся в непрерывном хаотическом движении 3)Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Средняя скорость молекулы <v> (средняя арифметическая скорость) определяется по формуле

Подставляя сюда f(v) и интегрируя, получаем
![]() (44.3)
(44.3)
Скорости,
характеризующие состояние газа: 1)
наиболее вероятная
![]() 2) средняя
2) средняя
![]() 3) средняя квадратичная
3) средняя квадратичная
![]() (рис. 65). Исходя из распределения
молекул по скоростям
(рис. 65). Исходя из распределения
молекул по скоростям
 (44.4)
(44.4)
можно
найти распределение молекул газа по
значениям кинетической энергии .
Для этого перейдем от переменной v
к переменной =m0v2/2.
Подставив в (44.4) v=![]() и dv=
и dv=![]() d
, получим
d
, получим

где dN() — число молекул, имеющих кинетическую энергию поступательного движения, заключенную в интервале от до + d.
Таким образом, функция распределения молекул по энергиям теплового движения
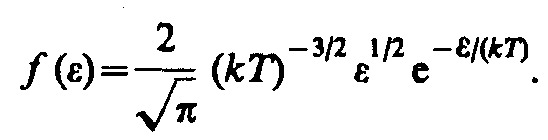
Средняя кинетическая энергия <> молекулы идеального газа
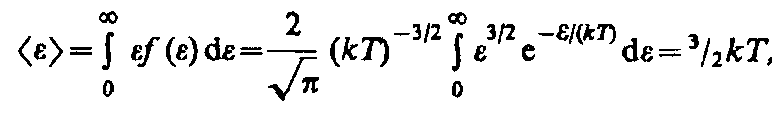
т. е. получили результат, совпадающий с формулой (43.8).
Распределение
Больцмана
При
выводе основного уравнения
молекулярно-кинетической теории газов
и максвелловского распределения молекул
по скоростям предполагалось, что на
молекулы газа внешние силы не действуют,
поэтому молекулы равномерно распределены
по объему. Однако молекулы любого газа
находятся в потенциальном поле тяготения
Земли. Тяготение, с одной стороны, и
тепловое движение молекул — с другой,
приводят к некоторому стационарному
состоянию газа, при котором давление
газа с высотой убывает.
Выведем закон
изменения давления с высотой, предполагая,
что поле тяготения однородно, температура
постоянна и масса всех молекул одинакова.
Если атмосферное давление на высоте h
равно р
(рис. 67), то на высоте h+dh
оно равно p+dp
(при dh>0
dp<0,
так как давление с высотой убывает).
Разность давлений р
и p+dp
равна весу газа, заключенного в объеме
цилиндра высотой dh
с
основанием площадью 1 м2:![]() где
—
плотность газа на высоте h
(dh
настолько мало, что при изменении высоты
в этом пределе плотность газа можно
считать постоянной). Следовательно,
где
—
плотность газа на высоте h
(dh
настолько мало, что при изменении высоты
в этом пределе плотность газа можно
считать постоянной). Следовательно,![]() (45.1)
(45.1)
Воспользовавшись
уравнением состояния идеального газа
pV=(m/M)
RT (т — масса
газа, М — молярная масса газа),
находим, что![]()
Подставив это выражение в (45.1), получим
![]()
С изменением высоты от h1 до h2 давление изменяется от р1 до р2 (рис. 67), т. е.
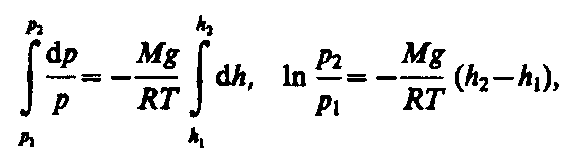
Или
![]() (45.2)
(45.2)
Выражение (45.2) называется барометрической формулой. Она позволяет найти атмосферное давление в зависимости от высоты или, измерив давление, найти высоту: Так как высоты обозначаются относительно уровня моря, где давление считается нормальным, то выражение (45.2) может быть записано в виде
![]() (45.3)
(45.3)
где р — давление на высоте h.
Прибор для определения высоты над земной поверхностью называется высотомером (или альтиметром). Его работа основана на использовании формулы (45.3). Из этой формулы следует, что давление с высотой убывает тем быстрее, чем тяжелее газ.
Барометрическую формулу (45.3) можно преобразовать, если воспользоваться выражением (42.6) p=nkT:
![]()
где n – концентрация молекул на высоте h, n0 – то же, на высоте h=0. Так как M=m0NA (NA – постоянная Авогадро, т0 – масса одной молекулы), a R=kNA, то
![]() (45.4)
(45.4)
где m0gh=П — потенциальная энергия молекулы в поле тяготения, т. е.
![]() (45.5)
(45.5)
Выражение (45.5) называется распределением Больцмана для внешнего потенциального поля. Из вето следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул. Если частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределение Больцмана (45.5) справедливо в любом внешнем потенциальном поле, а не только в поле сил тяжести.
Распределение Максвелла
При выводе основного уравнения молекулярно-кинетической теории молекулам задавали различные скорости. В результате многократных соударений скорость каждой молекулы изменяется по модулю и направлению. Однако из-за хаотического движения молекул все направления движения являются равновероятными, т. е. в любом направлении в среднем движется одинаковое число молекул.
По
молекулярно-кинетической теории, как
бы ни изменялись скорости молекул при
столкновениях, средняя квадратичная
скорость молекул массой т0 в
газе, находящемся в состоянии равновесия
при Т= const. остается
постоянной и равной
![]()
Это объясняется тем, что в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Этот закон теоретически выведен Дж. Максвеллом.
При выводе закона распределения молекул по скоростям Максвелл предполагал, что газ состоит из очень большого числа N тождественных молекул, находящихся в состоянии беспорядочного теплового движения при одинаковой температуре. Предполагалось также, что силовые поля на газ не действуют.
Закон Максвелла описывается некоторой функцией f(v), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные dv, то на каждый интервал скорости будет приходиться некоторое число молекул dN(v), имеющих скорость, заключенную в этом интервале. Функция f(v) определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv, т. е.
![]()
откуда![]()
Применяя методы теории вероятностей. Максвелл нашел функцию f(v) — закон о распределеня молекул идеального газа по скоростям:
![]() (44.1)
(44.1)
Из (44.1) видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т).
График
функции (44.1) приведен на рис. 65. Так как
при возрастании v
множитель exp[–m0v2/(2kT)]
уменьшается быстрее, чем растет множитель
v2, то функция f(v),
начинаясь от нуля, достигает максимума
при vB, и затем
асимптотически стремится к нулю. Кривая
несимметрична относительно vB.
Относительное число молекул dN(v)/N,
скорости которых лежат в интервале от
v до v+dv,
находится как площадь заштрихованной
полоски на рис. 65. Площадь, ограниченная
кривой распределения и осью абсцисс,
равна единице. Это означает, что функция
f(v)
удовлетворяет условию нормировки
![]() Скорость, при которой функция распределения
молекул идеального газа по скоростям
максимальна, называется наиболее
вероятной скоростью. Значение наиболее
вероятной скорости можно найти
продифференцировав выражение (44.1)
(постоянные множители опускаем) по
аргументу v, приравняв результат
нулю и используя условие для максимума
выражения f(v):
Скорость, при которой функция распределения
молекул идеального газа по скоростям
максимальна, называется наиболее
вероятной скоростью. Значение наиболее
вероятной скорости можно найти
продифференцировав выражение (44.1)
(постоянные множители опускаем) по
аргументу v, приравняв результат
нулю и используя условие для максимума
выражения f(v):
![]()
Значения v=0 и v= соответствуют минимумам выражения (44.1), а значение v, при котором выражение в скобках становится равным нулю, и есть искомая наиболее вероятная скорость vB:
![]() (44.2)
(44.2)
Из формулы (44.2) следует, что при повышении температуры максимум функции распределения молекул по скоростям (рис. 66) сместится вправо (значение наиболее вероятной скорости становится больше). Однако площадь, ограниченная кривой, остается неизменной, поэтому при повышении температуры кривая распределения молекул по скоростям будет растягиваться и понижаться.
Распределение Максвелла-Больцмана
Полученные
распределения Больцмана и Максвелла
позволяют определить соответственно
зависимость концентрации молекул от
координат
![]() и функцию распределения по скоростям
и функцию распределения по скоростям
![]() .
При этом распределение Больцмана
описывается в пространстве координат
.
При этом распределение Больцмана
описывается в пространстве координат
![]() ,
,
![]() и
и
![]() , а распределение Максвелла в пространстве
скоростей
, а распределение Максвелла в пространстве
скоростей
![]() ,
,
![]() и
и
![]() .
.
Если
ввести 6-мерное пространство, координатами
молекулы в котором являются величины
,
,
,
,
и
, то функция распределения в таком
пространстве будет зависеть от этих
шести переменных:
![]() . Считая пространственные переменные
,
,
,
и
компоненты скорости
,
и
статистически независимыми друг от
друга, на основании формулы (5.10) можно
записать:
. Считая пространственные переменные
,
,
,
и
компоненты скорости
,
и
статистически независимыми друг от
друга, на основании формулы (5.10) можно
записать:
![]()
или

где выражение для кинетической энергии имеет вид:
![]()
Формула
описывает распределение, называющееся
распределением Максвелла-Больцмана.
Она может быть использована в случае,
когда полная энергия молекулы
![]() равна сумме её потенциальной энергий
равна сумме её потенциальной энергий
![]() во внешнем силовом поле и кинетической
энергии её поступательного движения:
во внешнем силовом поле и кинетической
энергии её поступательного движения:
![]() .
.
При получении закона распределения Максвелла-Больцмана предполагалось, что температура газа не зависит от координаты точки. В частности, температура газа на всех высотах над поверхностью Земли при термодинамическом равновесии должна быть одинакова. С этим утверждением связан парадокс, всесторонне рассмотренный Максвеллом. Дело в том, что при движении вверх молекулы газа должны затрачивать свою кинетическую энергию на преодоление силы тяжести, и поэтому их средняя кинетическая энергия (а следовательно и температура) должна уменьшаться. Но этого не происходит вследствие того, что при этом не все молекулы, из-за недостатка их кинетической энергии, смогут преодолеть силу тяжести. Молекулы, имеющие недостаточную кинетическую энергию, не могут подняться высоко, что приведет, в соответствии с распределением Больцмана, к уменьшению их концентрации с высотой. Поэтому температура газа останется неизменной.
Распределение
по вектору скорости
Учитывая,
что плотность распределения по скоростям
![]() пропорциональна плотности распределения
по импульсам:
пропорциональна плотности распределения
по импульсам:
 и
используя
и
используя
![]() мы получим:
мы получим:
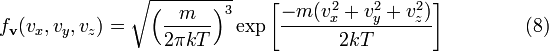 ,
,
что
является распределением Максвелла по
скоростям. Вероятность обнаружения
частицы в бесконечно малом элементе![]() около скорости
около скорости![]() равна
равна
![]()
Распределение
по энергии
Наконец,
используя соотношения![]() и
и
![]() ,
мы получаем распределение по кинетической
энергии:
,
мы получаем распределение по кинетической
энергии:

Наиболее
вероятная скорость![]() —
вероятность обладания которой любой
молекулой системы максимальна, и которая
соответствует максимальному значению
—
вероятность обладания которой любой
молекулой системы максимальна, и которая
соответствует максимальному значению![]() . Чтобы найти её, необходимо вычислить
. Чтобы найти её, необходимо вычислить![]() , приравнять её нулю и решить относительно
, приравнять её нулю и решить относительно
![]() :
:
![]()
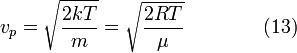
Определить
наиболее вероятное значение кинетической
энергии поступательного движения
молекул газа, находящегося в равновесном
состоянии.
Определим
производную функции
![]() и приравняем её нулю:
и приравняем её нулю:
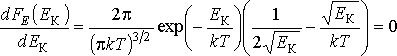
Тогда имеем выражение для наиболее вероятного значения кинетической энергии:
![]() .
.
Из полученного выражения следует, что наиболее вероятное значение кинетической энергии поступательного движения в три раза меньше среднего значения этой энергии молекул газа.
Средняя
скорость

Подставляя
и интегрируя, мы получим

Среднеквадратичная
скорость

Подставляя
и интегрируя, мы получим
Уравнение среднеквадратичной скорости молекулы Уравнение среднеквадратичной скорости молекулы легко выводится из основного уравнения МКТ для одного моля газа.
![]()
![]() ,
где
,
где![]() — молярная масса газа
Отсюда
окончательно
— молярная масса газа
Отсюда
окончательно

Средняя кинетическая энергия молекул идеального газа
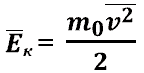 Другие
формулы, где встречается средняя энергия
молекул идеального газа:
Другие
формулы, где встречается средняя энергия
молекул идеального газа:
 Средняя
энергия движения молекул и температура.
Средняя
энергия движения молекул и температура.
 Основное
уравнение МКТ идеального газа
Основное
уравнение МКТ идеального газа
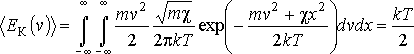
Сравнивая соотношения p = nkT с основным уравнением молекулярно-кинетической теории газов, можно получить:
![]()
Средняя кинетическая энергия хаотического движения молекул газа прямо пропорциональна абсолютной температуре.
Основное уравнение МКТ
![]() ,
где k является постоянной Больцмана
(отношение универсальной газовой
постоянной R к числу Авогадро NA),
i — число степеней свободы молекул ( в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T - абсолютная температура.
Основное
уравнение МКТ связывает макроскопические
параметры (давление, объём, температура)
газовой системы с микроскопическими
(масса молекул, средняя скорость их
движения).
,
где k является постоянной Больцмана
(отношение универсальной газовой
постоянной R к числу Авогадро NA),
i — число степеней свободы молекул ( в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T - абсолютная температура.
Основное
уравнение МКТ связывает макроскопические
параметры (давление, объём, температура)
газовой системы с микроскопическими
(масса молекул, средняя скорость их
движения).
