
- •Физический смысл
- •6. Структура периодической системы д.И.Менделеева. Какие характеристики элемента можно определить по его положению в периодической системе. Классы элементов: s, p, d, f- элементы.
- •7. Атомный радиус. Изменение атомных радиусов в периодах и группах. Объясните характер изменений атомных радиусов в периодах и группах.
- •11.Характеристика ковалентной связи: энергия связи, длина связи, валентный угол. Их взаимосвязанность.
- •13. Свойства и хар-ка ковалентной связи: гибридизация.
- •16. Ионная связь.
- •17. Металлическая связь.
- •Механизм металлической связи
- •Дисперсионное взаимодействие
- •Индукционные взаимодействия
- •2.2. Термохимические уравнения
- •Энергия Гиббса
- •25. Концентрация растворов: нормальная концентрация. Расчет молярной массы одного эквивалента для различных классов соединений.
- •25. Концентрация растворов: нормальная концентрация. Расчет молярной массы одного эквивалента для различных классов соединений.
- •26.Концентрация раствора: молярная концентрация.
- •27. Концентрация растворов: моляльная концентрация. Определите, сколько грамм кон и воды требуется взять, чтобы приготовить 20 мл 0,5m раствора.
- •29. Слабые электролиты. Диссоциация слабых электролитов , равновесие в растворах слабых электролитов. Константа диссоциации.
- •30.Диссоциация воды. Константа диссоциации воды. Ионное произведение воды. Водородный показатель pH. Определение среды раствора.
- •32) Реакция ионного обмена — одна из видов химической реакции, характеризующаяся выделением в продукты реакции воды, газа или осадка.
- •33) Гидролиз солей.
- •Химические свойства
17. Металлическая связь.
Металлы объединяют свойства, имеющие общий характер и отличающиеся от свойств других веществ. Такими свойствами являются сравнительно высокие температуры плавления, способность к отражению света, высокая тепло- и электропроводность. Эти особенности обязаны существованию в металлах особого вида связи — металлической связи.
Металлическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
принято считать, что электроны в металле находятся в свободном состоянии.

Схема кристаллической решетки металла

Металлическая связь имеет сходство как с ионной (образуется за счёт взаимодействия между заряженными частицами: электронами и ионами), так и с ковалентной ( происходит обобществление электронов, но в отличии от ковалентной связи, где электроны локализованы около определенных атомов, электроны в металлах обобществляются для всего кристалла). Свободные электроны иногда называют электронным газом. Катионы в металлических решётках не обладают поступательным движением, а совершают колебания вокруг положения узлов решётки. Амплитуда этих колебаний возрастает при повышении температуры, а при достижении температуры плавления металла решётка разрушается. Температура плавления металлов, как правило, возрастает с увеличением числа валентных электронов в их атомах
18. Межмолекулярные взаимодействия: водородная связь
Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами. Впервые были учтеныЯ. Д. Ван-дер-Ваальсом в 1873 году. Учёт межмолекулярных сил необходим для объяснения свойств реальных газов и жидкостей.
Водородная связь
Водородная связь возникает между молекулами, в которых атом водорода связан с атомом элемента, обладающего высокой электроотрицательностью. Так, атом водорода, образующий в молекуле НХ прочную ковалентную связь с атомом X, может образовывать водородную связь с атомом X (или Y) другой молекулы. Водородную связь принято изображать пунктиром: X - Н …У. Обычно энергия водородной связи (8-80 кДж/моль)значительно уступает энергии химической связи, но намного больше энергии ван-дер-ваальсова взаимодействия (1-5 кДж/моль). Исключением является сильная водородная связь в ионе (FHF) (250 кДж/моль).
Возникновение водородной связи обусловлено двумя причинами:
1. Атом водорода, связанный полярной ковалентной связью с атомом X,фактически не имеет электронов и способен легко внедряться в электронные облака других частиц.
2. Обладая вакантной s-орбиталью, атом водорода может принимать неподеленную электронную пару атома Y, образуя с ним донорно-акцепторную связь.
Н Н
| |
Н – О · · · Н - О · · ·
· ·
· ·
Н - Н -
Определенный вклад в образование водородной связи вносит электростатическое взаимодействие между положительно поляризованным атомом водорода в молекуле Н—X и отрицательно поляризованным атомом Y в другой молекуле. Чаще всего водородная связь образуется с участием атомов таких элементов, как кислород, фтор, азот. Наиболее типичный пример соединения с водородными связями — это вода. В жидком состоянии вода находится в виде ассоциатов (Н2О)n, а в кристаллах льда каждый атом кислорода образует по две водородные связи, что определяет его тетраэдрическое окружение.
Водородная связь существенно влияет на свойства веществ. Так, при ее наличии повышаются температура кипения, теплоты испарения и плавления, молекулы веществ в жидком состоянии становятся ассоциированными. Структура и свойства большинства органических веществ определяются образованием таких связей. Так, молекулы протеинов сохраняют свою спиральную форму из-за водородных связей. Они же удерживают вместедвойные спирали ДНК.
Мерой энергии межмолекулярного взаимодействия могут служить температура кипения и теплота испарения ΔНисп жидкости.
Ван-Дер-Ваальсовы силы – диполь – дипольное взаимодействие
ДИПОЛЬНЫЙ МОМЕНТ - физическая величина, характеризующая свойства диполя. Электрический дипольный момент равен произведению положительного заряда электрического диполя на расстояние между зарядами и направлен от отрицательного заряда к положительному. Магнитный дипольный момент контура с током пропорционален произведению силы тока на площадь контура и направлен перпендикулярно плоскости контура так, что с его конца ток виден текущим против часовой стрелки. Дипольный момент определяет электрическое (магнитное) поле диполя на большом расстоянии от него, а также воздействие на диполь внешнего электрического (магнитного) поля.
Ван-дер-ваальсовы силы существуют всегда между атомами
и молекулами, но могут быть пренебрежимо малы при наличии ионных или ковалентных взаимодействий. Диполь – это физическая модель, описывающая систему из двух разноименных, но равных по величине электрических зарядов на некотором расстоянии друг от друга. Диполь-дипольным взаимодействием называется взаимодействие диполей, приводящие к их взаимной ориентации и притяжению. Энергия взаимодействия двух диполей пропорциональна произведению их дипольных моментов. Диполь-дипольные взаимодействия могут также возникать между различными частями одной и той же молекулы и, следовательно, стабилизовать или дестабилизовать ту или иную конформацию. Они стабилизуют конформаций, в которых противоположно заряженные части сближены, и дестаби-лизуют конформаций, в которых сближены одинаково заряженные части. ДИПОЛЬ-ДИПОЛЬНОЕ ВЗАИМОДЕЙСТВИЕ - взаимодействие между диполями электрическими или диполями магнитными. Каждый электрич. (магн.) диполь создаёт в окружающем пространстве электрич. (магн.) поле, воздействующее на др. диполи. Напряжённость поля электрич. диполя
![]()
где р- дипольный момент (ре - электрич., рт - магн.); r - радиус-вектор из точки локализации диполя в точку наблюдения. Аналогичной ф-лой описывается напряжённость магн. поля НД,создаваемого магн. диполем (напр., магн. моментом парамагн. атома или иона): нужно только заменить в ф-ле (1) Eд на НД и ре на рт.
Энергия
Д--д.в. ![]() двух
диполей с моментами рi н pj,
находящихся в точках ri и rj.
двух
диполей с моментами рi н pj,
находящихся в точках ri и rj.
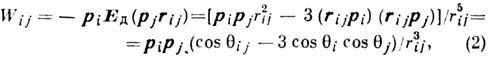
где ![]() -
угол между векторами рi и pj,
-
угол между векторами рi и pj, ![]() -
углы между векторами рi иpj и
вектором - энергия диполя рi в
поле диполя pj.
Полная
-
углы между векторами рi иpj и
вектором - энергия диполя рi в
поле диполя pj.
Полная ![]() энергия
Д--д.в. для системы диполей является
суммой энергий всех парных дипольных
взаимодействий (Д--д. в. - дальнодействующее).
энергия
Д--д.в. для системы диполей является
суммой энергий всех парных дипольных
взаимодействий (Д--д. в. - дальнодействующее).
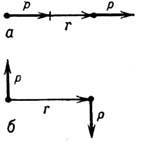
Энергия Д--д. в. зависит от взаимного расположения диполей [см. ф-лу (2)]. Напр., для пары диполей с одинаковыми дипольными моментами р при "горизонтальной" ориентации ди-польных моментов (рис., а)эта энергия минимальна (W=-2р2/r3), когда дипольные моменты параллельны; при "вертикальной" ориентации дипольных моментов (рис., 6) энергия Д--д. в. минимальна (W=- р2/r3), когда ди польные моменты антипараллельны. Д--д. в. играет особенно важную роль при возникновении в твёрдых телах нек-рых видов магнитной атомной структуры и магнитной доменной структуры. Магн. Д--д. в. относится к классу анизотропных взаимодействий и, наряду свнутрикристаллическим полем и анизотропным обменным взаимодействием, даёт вклад в магнитную анизотропию кристаллов.
Магн. Д--д. в.- релятивистское по природе взаимодействие, но несмотря на относительно небольшую величину (по сравнению, напр., с обменным взаимодействием) может существ. образом влиять на низкотемпературные свойства кристаллов с парамагн. ионами, определяя темп-ру их магн. упорядочения и тип возникающей атомной магн. структуры. Существует целый класс соединений (т. н. дипольные магнетики), магн. упорядочение к-рых практически полностью обусловлено Д--д. в. (напр., редкоземельные литиевые фториды и гидроокиси, редкоземельные ортоалюминаты и др.). Д--д. в. ответственно за образование в ферро- и ферримагнетиках доменной структуры (см. Домены ).С Д--д. в. тесно связано поле размагничивания, т. е. магн. поле, создаваемое всеми магн. моментами внутри магнетика и усреднённое по малому (но макроскопич.) объёму, окружающему точку локализации рассматриваемого магн. момента. Энергию Д--Д. в. в связи с этим часто наз. энергией размагничивания. Аналогично проявляет себя взаимодействие электрич. дипольных моментов в сегнетоэлектриках.
