
- •Физический смысл
- •6. Структура периодической системы д.И.Менделеева. Какие характеристики элемента можно определить по его положению в периодической системе. Классы элементов: s, p, d, f- элементы.
- •7. Атомный радиус. Изменение атомных радиусов в периодах и группах. Объясните характер изменений атомных радиусов в периодах и группах.
- •11.Характеристика ковалентной связи: энергия связи, длина связи, валентный угол. Их взаимосвязанность.
- •13. Свойства и хар-ка ковалентной связи: гибридизация.
- •16. Ионная связь.
- •17. Металлическая связь.
- •Механизм металлической связи
- •Дисперсионное взаимодействие
- •Индукционные взаимодействия
- •2.2. Термохимические уравнения
- •Энергия Гиббса
- •25. Концентрация растворов: нормальная концентрация. Расчет молярной массы одного эквивалента для различных классов соединений.
- •25. Концентрация растворов: нормальная концентрация. Расчет молярной массы одного эквивалента для различных классов соединений.
- •26.Концентрация раствора: молярная концентрация.
- •27. Концентрация растворов: моляльная концентрация. Определите, сколько грамм кон и воды требуется взять, чтобы приготовить 20 мл 0,5m раствора.
- •29. Слабые электролиты. Диссоциация слабых электролитов , равновесие в растворах слабых электролитов. Константа диссоциации.
- •30.Диссоциация воды. Константа диссоциации воды. Ионное произведение воды. Водородный показатель pH. Определение среды раствора.
- •32) Реакция ионного обмена — одна из видов химической реакции, характеризующаяся выделением в продукты реакции воды, газа или осадка.
- •33) Гидролиз солей.
- •Химические свойства
2.2. Термохимические уравнения
В
термохимических уравнениях в отличие
от химических указывается тепловой
эффект химической реакции и между левой
и правой частями уравнения принято
ставить знак равенства (=).
Тепловой
эффект Q измеряется
в килоджоулях (кДж), в случае экзотермических
реакций он положителен, а в случае
эндотермических реакций отрицателен.
Энтальпия
(![]() )
– величина, характеризующая внутреннюю
энергию вещества, обратная по знаку
тепловому эффекту, имеет размерность
кДж на моль (кДж/моль).
Две возможные
формы записи термохимического уравнения:
)
– величина, характеризующая внутреннюю
энергию вещества, обратная по знаку
тепловому эффекту, имеет размерность
кДж на моль (кДж/моль).
Две возможные
формы записи термохимического уравнения:
2Н2 (г.) + О2 (г.) = 2Н2О (г.) + 483,6 кДж
или
Н2 (г.) + 1/2О2 (г.) = Н2О (г.), = –241,8 кДж/моль.
Задача. При сжигании 3 г магния выделилось 75,15 кДж теплоты. Составьте термохимическое уравнение реакции горения магния.
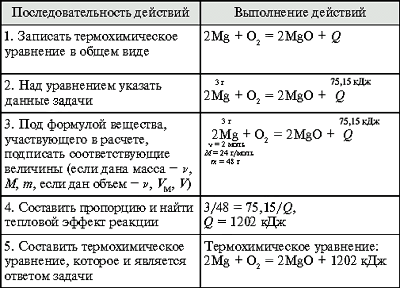
Задача 2. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
Дано: Q1 = 652,5 кДж Найти: m(C2H2)-? |
Решение:
1) Установим пропорциональные отношения между количеством вещества ацетилена и количеством теплоты. По уравнению 2 моль C2H2_---------- 2610 кДж По условию х моль ---------- 652,5 кДж
Решаем пропорцию
2) Определяем массу ацетилена по формуле m= n * M m = 0,5 моль * 26 г/моль = 13 г.
|
Ответ: масса сгоревшего ацетилена 13 г.
Термодинамическая энтропия S, часто просто именуемая энтропия, в химии и термодинамике являетсяфункцией состояния термодинамической системы. Термодинамическая система — это некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом. Также обычно полагается, что такая система подчиняется статистическим закономерностям. Для термодинамических систем справедливы законы термодинамики.
Определение энтропии
Энтропия определяется как :
S = H / T гдеS = энтропия (кДж/кг*К) H = энтальпия (кДж/кг) T = абсолютная температура (K)
Изменение энтропии системы вызвано изменением содержания темпла в ней. Изменение энтропии равно изменению темпла системы деленной на среднюю абсолютную температуру ( Ta):
dS = dH / Ta
Пример - Энтропия при нагревании воды
Процесс нагревания 1 кг воды от 0 до 100oC (273 до 373 K) при нормальных условиях. Удельная энтальпия для воды при 0oC = 0 кДж/кг (удельная - на единицу массы) Удельная энтальпия для воды при 100oC = 419 кДж/кг
Изменение удельной энтропии :
dS = dH / Ta
= ((419 кДж/кг) - (0 кДж/кг)) / ((273 К + 373 К)/2)
= 1.297 кДж/кг*К
Пример - Энтропия при испарении воды
Процесс превращения 1 кг воды при 100oC (373 K) в насыщенный пар при 100oC (373 K) при нормальных условиях. Удельная энтальпия пара при 100oC (373 K) до испарения = 0 кДж/кг
Удельная теплота парообразования 100oC (373 K) при испарении = 2 258 кДж/кг Изменение удельной энтропии:
dS = dH / Ta
= (2 258 - 0) / ((373 + 373)/2)
= 6.054 кДж/кг*К
Полное изменение удельной энтропии испарения воды - это сумма удельной энтропии воды (при 0oC) плюс удельная энтропия пара (при температуре 100oC).
