- •Физический смысл
- •6. Структура периодической системы д.И.Менделеева. Какие характеристики элемента можно определить по его положению в периодической системе. Классы элементов: s, p, d, f- элементы.
- •7. Атомный радиус. Изменение атомных радиусов в периодах и группах. Объясните характер изменений атомных радиусов в периодах и группах.
- •11.Характеристика ковалентной связи: энергия связи, длина связи, валентный угол. Их взаимосвязанность.
- •13. Свойства и хар-ка ковалентной связи: гибридизация.
- •16. Ионная связь.
- •17. Металлическая связь.
- •Механизм металлической связи
- •Дисперсионное взаимодействие
- •Индукционные взаимодействия
- •2.2. Термохимические уравнения
- •Энергия Гиббса
- •25. Концентрация растворов: нормальная концентрация. Расчет молярной массы одного эквивалента для различных классов соединений.
- •25. Концентрация растворов: нормальная концентрация. Расчет молярной массы одного эквивалента для различных классов соединений.
- •26.Концентрация раствора: молярная концентрация.
- •27. Концентрация растворов: моляльная концентрация. Определите, сколько грамм кон и воды требуется взять, чтобы приготовить 20 мл 0,5m раствора.
- •29. Слабые электролиты. Диссоциация слабых электролитов , равновесие в растворах слабых электролитов. Константа диссоциации.
- •30.Диссоциация воды. Константа диссоциации воды. Ионное произведение воды. Водородный показатель pH. Определение среды раствора.
- •32) Реакция ионного обмена — одна из видов химической реакции, характеризующаяся выделением в продукты реакции воды, газа или осадка.
- •33) Гидролиз солей.
- •Химические свойства
11.Характеристика ковалентной связи: энергия связи, длина связи, валентный угол. Их взаимосвязанность.
Энергия связи - это количество энергии, которую необходимо затратить для разрыва связи. Чем больше энергия связи, тем устойчивей молекула.
Длина связи – расстояние между ядрами атомов в соединении. Длина связи зависит от размеров, форы электронных облаков и степени их перекрывания.
Валентный угол – угол между направлениями связи.
Молекула, образуемая двумя атомами всегда линейна(180град.) Молекула, образуемая тремя атомами линейна, если центральный атом является S элементом.
Молекула, образ. Тремя ат. Углов. Если центральный атом относится к d или p элементам.
12.Св-ва и характеристика ковалентной связи: полярность связи. Ковалентная полярная и ковалентная неполярная связь. Поляризуемость связи.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Если двухатомная молекула состоит из из атомов одного элемента, как, например, молекулы Н2, N2, Cl2, то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно ядра обоих атомов. В подобном случае ковалентная связь называется НЕПОЛЯРНОЙ или гомеополярной. Если же двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает асимметрия в распределении заряда. В таком случае ковалентная связь называется ПОЛЯРНОЙ или гетерополярной.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
13. Свойства и хар-ка ковалентной связи: гибридизация.
Гибридизация – процесс смешения разных, но близких по энергии, орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по форме и энергии.
Гибридизация орбиталей - это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
sp3- Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109°28'.
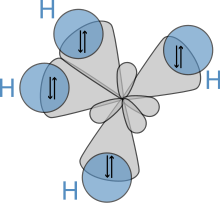
Молекулы, в которых осуществляется sp3- гибридизация, имеют тетраэдрическую геометрию (CH4, NH3).
sp2- Гибридизация. Одна s- орбиталь и две p- орбитали превращаются в три одинаковые "гибридные" орбитали, угол между осями которых равен 120°.
Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется s- связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется p- связь. Три sp2- орбитали могут образовывать три s- связи (BF3, AlCl3). Еще одна связь (p- связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2H4).
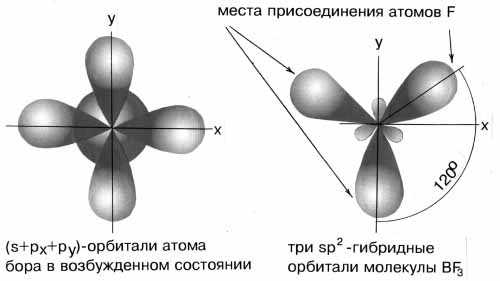
Молекулы, в которых осуществляется sp2- гибридизация, имеют плоскую геометрию.
sp- Гибридизация. Одна s- орбиталь и одна p- орбиталь превращаются в две одинаковые "гибридные" орбитали, угол между осями которых равен 180°.
Две sp- орбитали могут образовывать две s- связи (BeH2, ZnCl2). Еще две p- связи могут образоваться, если на двух p- орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2H2).
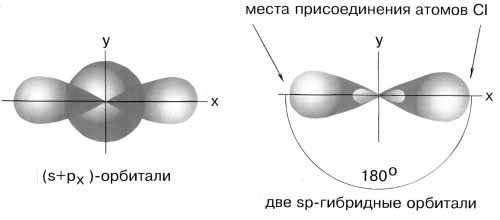
Молекулы, в которых осуществляется sp- гибридизация, имеют линейную геометрию.
14.Св-ва и хар-ка ковалентной связи: Направленность. Насыщаемость.
Направленность. Т.к.атомные орбитали пространственно ориентированы, то перекрывание их происходит под определенным направлением.
По теории валентных связе, ковалентная связь направленна в сторону максимального перекрывания взаимодействия атомов.
1)Сигма связь – образованная перекрыванием атомных орбиталей по линии соединяющей центры взаимодействия атомов.
2)Пи связь – это связь, образов. Перекрыванием атомных орбиталей над и под линией соед. линии взимод. Атомов.
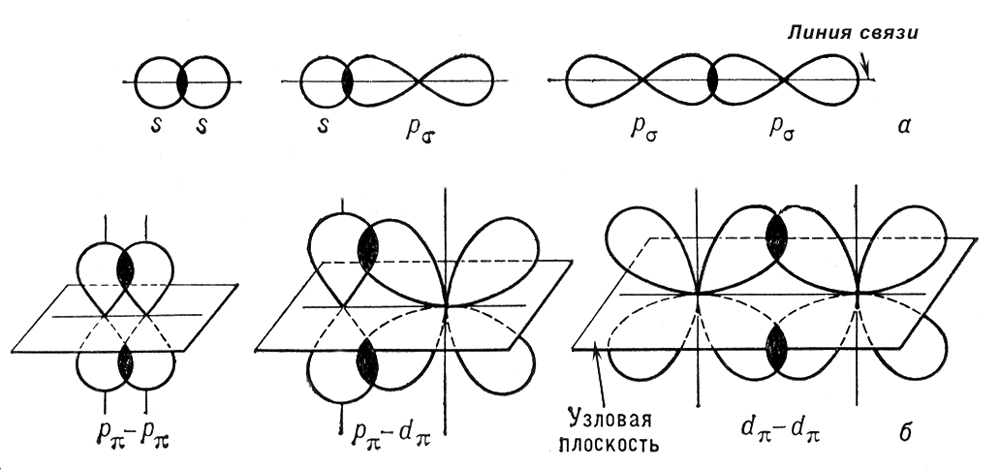
Насыщаемость ковалентной связи вызванно наличием ограниченного числа электронов, находящихся на внешних оболочках,которые могут принимать участие в образовании связи.
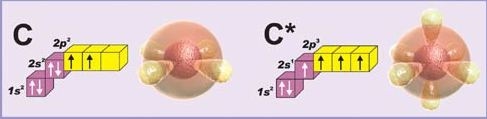
15.Степень окисления. Определение возможного степени окисления элимента. Покажите возможные степени окисления для атома углерода в основном и электронно – возбужденном состоянии. Оцените устойчивость данных степени окисления.
СТЕПЕНЬ ОКИСЛЕНИЯ (устар.-окислит. число), условный электростатич. заряд атома в хим. соединении, к-рый находят, считая хим. связи в соед. чисто ионными и принимая заряды атомов О, М (M-Li,...Cs) и Н, равными соотв. — 2 (в пероксидных соед. -1), —1 и +1 (если Н соединен с более электроотрицат. элементом). Суммируя степени окисления всех атомов в молекуле, кроме интересующего, и считая, что в нейтральной молекуле сумма всех степеней окисления равна 0, находят неизвестное значение степени окисления. Напр., для Na2SO4 степень окисления серы + 6. В нейтральных молекулах, состоящих из одинаковых атомов, обычно считают степень окисления нулевой (,и др.). Иногда степени окисления, вычисленные по приведенным правилам, оказываются дробными. Макс. значение степени окисления +8 реализуется в RuO4 и OsO4 и нек-рых соед. Хе.
Степень окисления обычно не соответствует эффективному заряду атома. Поэтому для мн. типов соед. (напр., интерметаллиды, кластеры) понятие степени окисления не применяют. Использование степени окисления полезно для нахождения стехиометрич. коэф. р-ций, для классификации в-в, в т.ч. комплексных. Степень окисления необходима также для хим. номенклатуры, полезна для систематизации описания св-в в-в.
Определение степени окисления
1
При определении окисления необходимо знать, что высшая степень окисления металла соответствует номеру группы периодической системы, где находится данный элемент. Но из этого правила есть исключения.
2
Также степени окисления неметаллов при соединении их с атомами металлов всегда отрицательны, а при соединении с атомами неметаллов-то могут быть и отрицательными, и положительными. Высшую отрицательную степень окисления неметаллов можно найти, вычтя из 8 номер группы, в которой находится данный элемент. Высшая положительная равна числу электронов на внешнем слое (число электронов соответствует номеру группы).
3
Степень окисления простого вещества, независимо от того, металл это или неметалл, всегда равняется нулю. В молекулах алгебраическая сумма этих степеней элементов с учетом числа их атомов равняется нулю.
4
Чтобы легко определить степень любого элемента в соединении, необходимо также помнить, что водород имеет в соединениях степень окисления (+1). Исключая гидриды (соединения водорода с металлами главной подгруппы первой-второй групп, степень окисления -1, например Na+H- ); кислород имеет (-2), за исключением соединения кислорода со фтором O+2 F-2 и в перекисях (Н2О2 - степень окисления кислорода (-1); фтор имеет (-1).
5
Например, следует определить степени окисления элементов в молекуле калия двухромовокислого (бихромата калия), формула которого K2Cr2O7.
У двух химических элементов калия и кислорода они постоянны и равны соответственно +1 и -2. Число степеней окисления у кислорода равна (-2)•7=(-14), у калия (+1)•2=(+2). Число положительных равно числу отрицательных. Следовательно (-14)+(+2)=(-12). Значит у атома хрома число положительных степеней равно 12, но атомов 2, значит, на один атом приходится (+12):2=(+6), запишите степени окисления над элементами: К+12Cr+6 2O-2 7.
Возможные степени окисления для атома углерода в основном и электронно – возбужденном состоянии.