
- •Часть 2. Основы учения о климате и микроклимате
- •Тема 4. Основы молекулярной физики и термодинамики Введение Предмет мф и тд
- •Агрегатные состояния вещества
- •Основные методы изучения вещества
- •Физические модели в мф и тд
- •§ 4.1. Молекулярно-кинетическая теория
- •4.1.1. Основные утверждения мкт Всякое вещество состоит из частиц
- •Частицы взаимодействуют друг с другом
- •Частицы совершают тепловое движение
- •4.1.2. Основные законы теплового движения Основное уравнение мкт
- •Теорема о равнораспределении энергии
- •Температура – мера энергии
- •4.1.3. Статистические распределения молекул Распределение Максвелла
- •Распределение Больцмана
- •§ 4.2. Термодинамика
- •4.2.1. Основные понятия термодинамики
- •4.2.2. Начала термодинамики и их применение
- •Первый постулат тд
- •Второй постулат тд
- •Третий постулат тд
- •Четвёртый постулат тд
- •Пятый постулат тд
- •§ 4.3. Явления переноса и фазовые превращения
- •4.3.1. Диффузия
- •4.3.2. Вязкость
- •4.3.3. Теплопроводность
- •Тема 5. Микроклимат помещений
- •§ 5.1. Этапы теплотехнического проектирования зданий
- •Формирование климата
- •§ 5.2. Распространение тепла в ограждающих конструкциях Теплообмен
- •Теплопередача
- •Термическое сопротивление
- •Тепловосприятие
- •Теплоотдача
Четвёртый постулат тд
Четвёртый постулат называют вторым началом термодинамики (о существовании и неубывании энтропии): в состоянии термодинамического равновесия у системы существует макропараметр энтропия, которая в случае адиабатически изолированной системы (нет обмена теплотой) не убывает
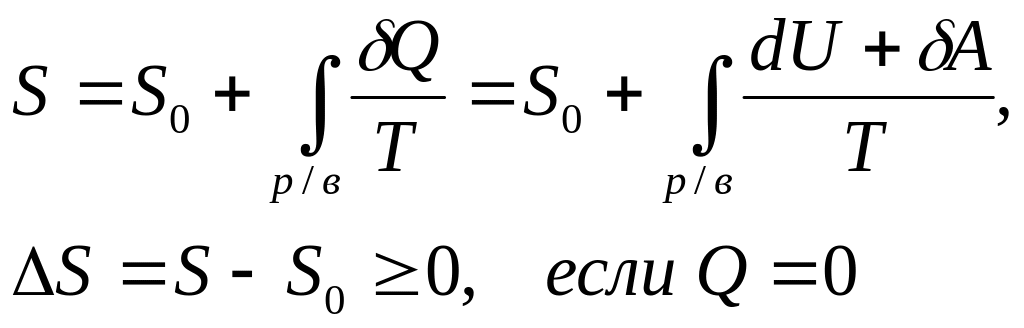
Для обратимого (равновесного) процесса в изолированной системе энтропия не меняется
![]() .
.
Для необратимого (неравновесного) процесса в изолированной системе энтропия возрастает
![]() ,
,
![]() .
.
Согласно второму началу ТД в виде полученного неравенства Клаузиуса, необратимый процесс в изолированной системе всегда происходит в определённом направлении так, что энтропия системы не убывает:
![]()
При этом термодинамическая трактовка изменения энтропии – суммарная приведённая теплота. Однако термодинамика не рассматривает микроскопическое строение вещества, поэтому для более глубокого понимания смысла 2 НТД следует обратиться к статистической трактовке энтропии.
Л. Больцман выдвинул гипотезу: между термодинамической вероятностью макросостояния системы и её энтропией существует однозначная связь. Он доказал, что эта связь имеет вид уравнения Больцмана:
![]()
![]()
Термодинамическая вероятность – это число способов реализации данного макросостояния системы, т. е. число микросостояний, обусловленных движением и «перестановкой» частиц.
Когда система находится в состоянии равновесия, то:
- частицы равномерно (равновероятно) распределены,
- число микросостояний системы (термодинамическая вероятность) максимально
![]()
- энтропия системы максимальна
![]() .
.
Таким образом:
энтропия есть мера беспорядка, хаоса;
наиболее вероятными процессами в природе являются самопроизвольные процессы перехода в состояние равновесия и беспорядка с максимальной энтропией.
Однако в системе многих частиц всегда есть флуктуации, отклонения от общих закономерностей. Они становятся более существенными в системах небольшого числа частиц. Поэтому процесс роста энтропии оказывается лишь более вероятным, и есть вероятность процессов с уменьшением энтропии.
Пятый постулат тд
Пятый постулат называют третьим началом термодинамики или тепловой теоремой Нернста (о существовании и недостижимости абсолютного нуля температуры): при приближении к абсолютному нулю температуры энтропия любой ТД системы перестаёт зависеть от каких-либо ТД параметров и принимает одно и то же постоянное значение
![]()
§ 4.3. Явления переноса и фазовые превращения
Если вещество каким-либо образом вывести из состояния равновесия, то оно вновь окажется в равновесном состоянии (но в другом) спустя некоторое время. В течение этого времени происходят явления переноса, которые обусловлены столкновениями частиц вещества (молекул).
Существуют 4 явления переноса: диффузия, вязкость, теплопроводность, электропроводность.
4.3.1. Диффузия
Диффузия – это перенос массы частиц.
Диффузия подчиняется закону А. Фика: поверхностная плотность потока массы вещества, переносимого через единичную площадку в единицу времени, пропорциональна градиенту плотности вещества
![]()
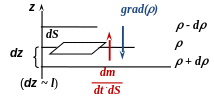
В частном случае диффузии вдоль одного направления (оси 0z):
![]()
Коэффициент диффузии газа (по молекулярно-кинетической теории):
![]()
![]()
Следовательно,
![]()
В разных веществах:
![]()
