
- •Часть 2. Основы учения о климате и микроклимате
- •Тема 4. Основы молекулярной физики и термодинамики Введение Предмет мф и тд
- •Агрегатные состояния вещества
- •Основные методы изучения вещества
- •Физические модели в мф и тд
- •§ 4.1. Молекулярно-кинетическая теория
- •4.1.1. Основные утверждения мкт Всякое вещество состоит из частиц
- •Частицы взаимодействуют друг с другом
- •Частицы совершают тепловое движение
- •4.1.2. Основные законы теплового движения Основное уравнение мкт
- •Теорема о равнораспределении энергии
- •Температура – мера энергии
- •4.1.3. Статистические распределения молекул Распределение Максвелла
- •Распределение Больцмана
- •§ 4.2. Термодинамика
- •4.2.1. Основные понятия термодинамики
- •4.2.2. Начала термодинамики и их применение
- •Первый постулат тд
- •Второй постулат тд
- •Третий постулат тд
- •Четвёртый постулат тд
- •Пятый постулат тд
- •§ 4.3. Явления переноса и фазовые превращения
- •4.3.1. Диффузия
- •4.3.2. Вязкость
- •4.3.3. Теплопроводность
- •Тема 5. Микроклимат помещений
- •§ 5.1. Этапы теплотехнического проектирования зданий
- •Формирование климата
- •§ 5.2. Распространение тепла в ограждающих конструкциях Теплообмен
- •Теплопередача
- •Термическое сопротивление
- •Тепловосприятие
- •Теплоотдача
§ 4.2. Термодинамика
4.2.1. Основные понятия термодинамики
Термодинамическая система – система огромного числа частиц (атомов, молекул), способная обмениваться своим веществом и энергией с другими системами.
Термодинамическое состояние – способ существования ТД системы, который характеризуется ТД параметрами. Состояния бывают:
равновесные – неизменные с течением времени, причём при постоянных внешних условиях внутри системы нет потоков (явлений переноса); на координатных сетках (p, V), (V,T), (p,T), (S,T) изображаются точками;
неравновесные состояния характеризуются явлениями переноса, после прекращения которых переходят в равновесные.
Термодинамические параметры (макропараметры) – физически величины, описывающие состояние ТД системы в целом (объём, температура, давление, внутренняя энергия, энтропия и др.). В равновесном состоянии они имеют постоянные значения.
Термодинамические процессы – переходы из одного ТД состояния в другое. Процессы бывают:
равновесные – достаточно медленные процессы перехода между равновесными состояниями (в газах: изотермический, изобарический, изохорический); на координатных сетках (p, V), (V,T), (p,T), (S,T) изображаются сплошными линиями;
неравновесные – сравнительно быстрые процессы перехода между неравновесными состояниями (в газах: адиабатический); на координатных сетках (p, V), (V,T), (p,T), (S,T) нельзя изобразить линиями.
4.2.2. Начала термодинамики и их применение
Началами термодинамики называют постулаты (законы), которые были эмпирически установлены на основе многовековых наблюдений. Существует 5 начал ТД.
Первый постулат тд
Первый постулат называют общим началом термодинамики (о существовании состояния ТД равновесия): у изолированной ТД системы существует состояние термодинамического равновесия, в которое она переходит с течением времени и никогда самопроизвольно из него не выходит.
Второй постулат тд
Второй постулат называют нулевым началом термодинамики (о существовании связи между параметрами): в состоянии термодинамического равновесия существует функциональная связь между макропараметрами, т. е. при изменении хотя бы одного из равновесных параметров меняются и другие.
Эта связь математически (количественно) выражается в виде уравнения состояния вещества. Уравнения состояния бывают:
термические (связь между p, V и T),
калорические (связь между p, V, T и U).
Для идеального газа термическим уравнением состояния служит уравнение Менделеева – Клапейрона
![]()
или
![]() .
.
Оно содержит в себе в виде частных случаев все газовые законы (законы идеального газа).
1. Закон Авогадро: если давления, объемы и температуры газов одинаковые, то газы содержат одинаковое число молекул
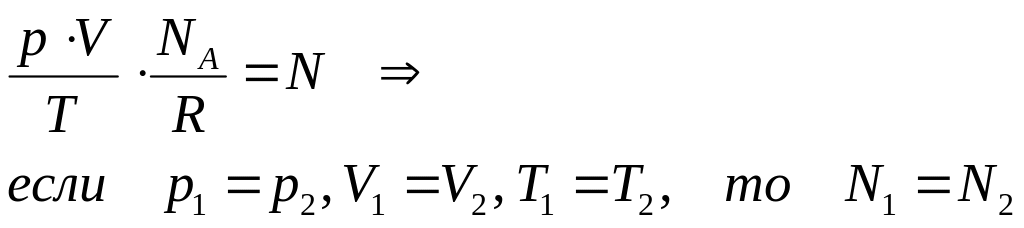
2. Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений компонент смеси
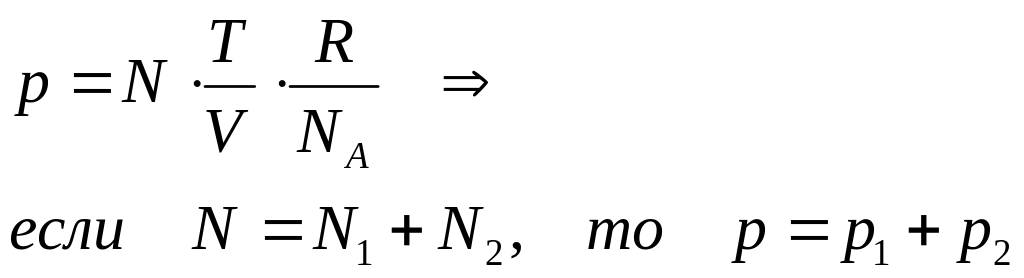
3. Закон Бойля-Мариотта: при изотермическом процессе давление идеального газа обратно пропорционально его объёму
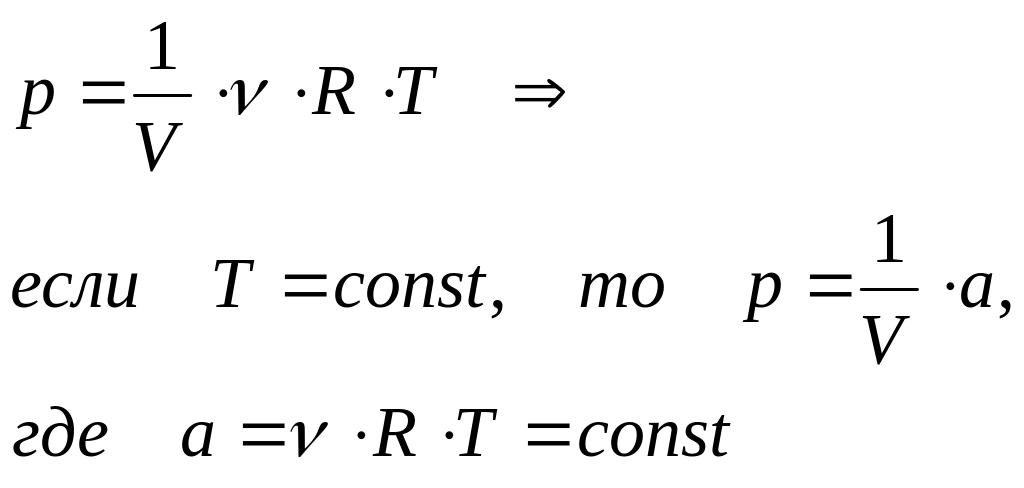
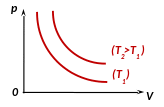
Зависимость p(V) на координатной плоскости (p,V) изображается гиперболой, которая называется изотермой (рис.):
Давление есть сила, с которой все молекулы действуют на поверхность. Единицей измерения давления в СИ является паскаль:
![]() .
.
На практике значение давления измеряют с помощью специальных приборов – барометров.
4. Закон Гей-Люссака: при изобарном процессе объём идеального газа прямо пропорционален его температуре
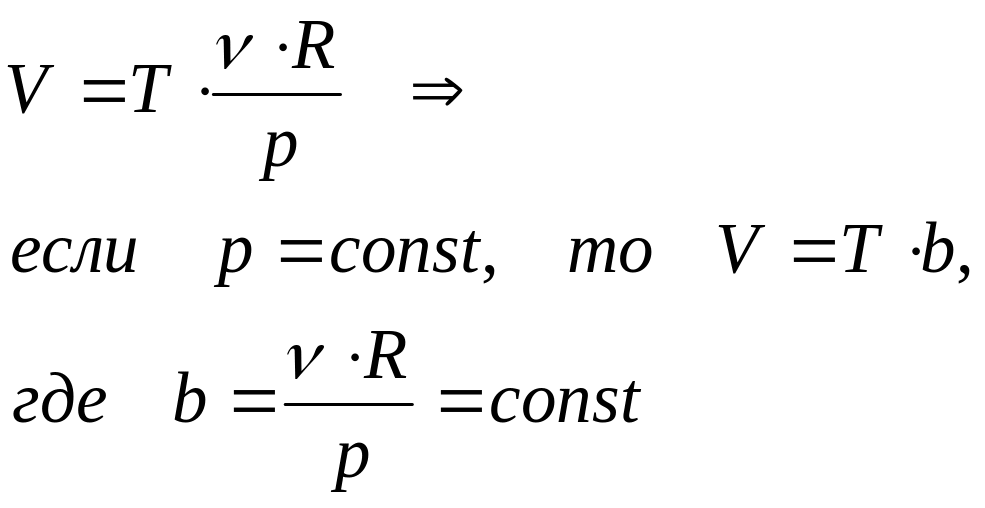

Зависимость V(T) на плоскости (V,T) изображается прямой, которая называется изобарой, выходит из начала координат и имеет тангенс угла наклона (рис.).
5. Закон Шарля: при изохорном процессе давление идеального газа прямо пропорционально его температуре
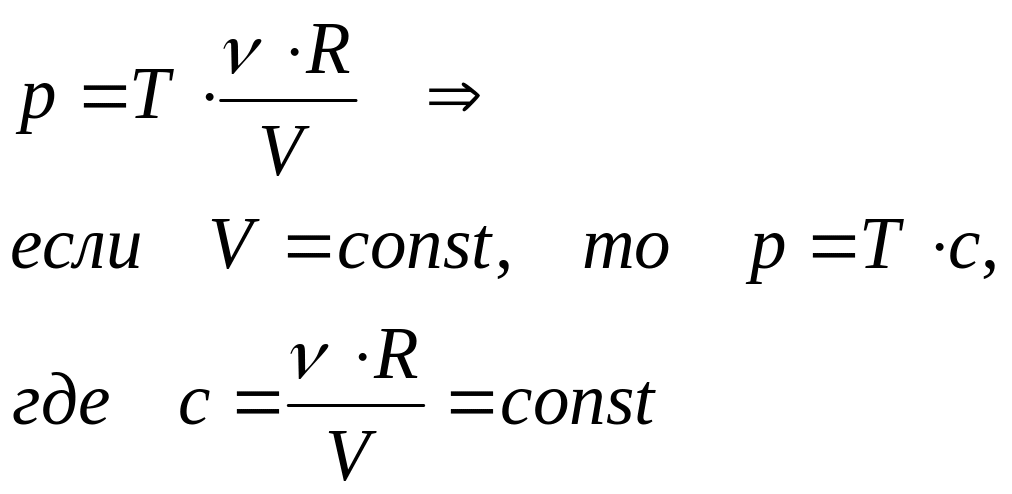

Зависимость p(T) на плоскости (p,T) изображается прямой, которая называется изохорой, выходит из начала координат и имеет тангенс угла наклона (рис.):
Для реального газа термическим уравнением состояния служит уравнение Ван-дер-Ваальса
![]() .
.
В отличие от уравнения Менделеева - Клапейрона, оно содержит поправки к давлению, оказываемому газом на стенки сосуда, и к объёму сосуда, занимаемому газом.
Поправка «внутреннее давление» учитывает действие сил притяжения, которые препятствую разбеганию частиц после столкновения на далёкие расстояния и обеспечивают самосжатие газа. В реальном газе давление на стенки сосуда несколько меньше, чем в идеальном; эта поправка равна
![]()
где а – постоянная Ван-дер-Ваальса, характерная для данного газа,
![]() .
.
Поправка «собственный объём» учитывает действие сил отталкивания, препятствущих сближению молекул на расстояния, меньшие эффективного диаметра. Доступный объём для движения частиц оказывается меньше, чем в идеальном газе:
![]() .
.
Множитель «4» обусловлен наибольшей вероятностью попарных столкновений молекул, b – постоянная Ван-дер-Ваальса, характерная для данного газа,
![]() .
.
Следовательно,
![]() .
.
У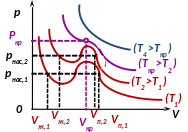 равнение
Ван-дер-Ваальса позволяет описывать
фазовый переход «газ
↔ жидкость»,
что невозможно было сделать на основе
уравнения состояния идеального газа
(рис.).
равнение
Ван-дер-Ваальса позволяет описывать
фазовый переход «газ
↔ жидкость»,
что невозможно было сделать на основе
уравнения состояния идеального газа
(рис.).
На изотермах Ван-дер-Ваальса:
газообразные состояния соответствуют участкам с параметрами
![]() ;
;
жидкость соответствует участкам с параметрами
![]() ;
;
д
 вухфазные
состояния соответствуют участкам с
параметрами
вухфазные
состояния соответствуют участкам с
параметрами
![]()
Теоретические изотермы Ван-дер-Ваальса в целом удовлетворяют экспериментально полученным изотермам Эндрюса (рис.), кроме физически невозможных участков, на которых одновременно при сжатии вещества падаем давление. Критические параметры определяются по формулам:
![]()
Состояние с критическими параметрами называют «критическим», т. к. если параметры превышают критические, реальный газ невозможно сжать до жидкого состояния. При этом критическая температура выше температуры кипения.
Например:
![]()
Для идеального газа калорическим уравнением состояния служит уравнение, в котором внутренняя энергия газа из молекул определённого типа зависит лишь от температуры
![]() .
.
Внутренняя энергия идеального газа равна сумме кинетических энергий всех его N частиц, поскольку
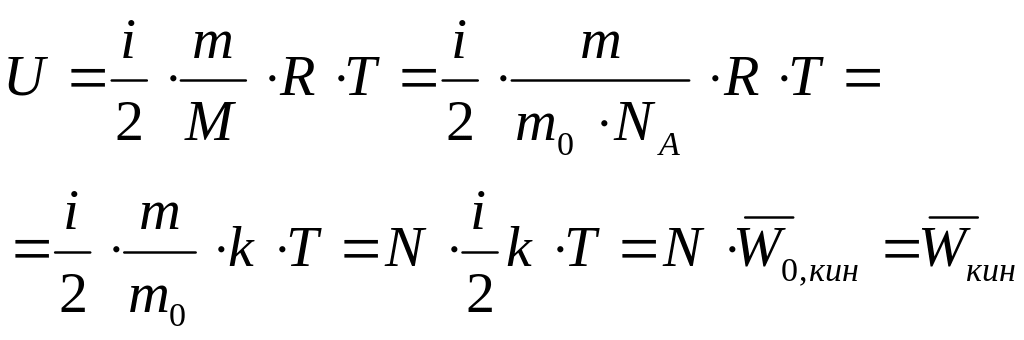
В случае реального газа калорическим уравнением состояния служит уравнение, в котором внутренняя энергия газа из молекул определённого типа зависит не только от температуры, но и от объёма вещества.
![]() .
.
Это обусловлено тем, что молекулы после столкновения взаимодействуют с силами притяжения, т. е. есть потенциальная энергия. Работа сил притяжения равна
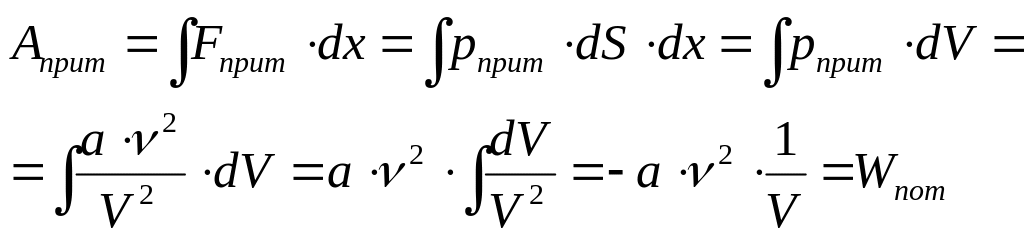
(a – постоянная Ван-дер-Ваальса, - количество вещества). Внутренняя энергия реального газа зависит и от кинетической энергии частиц (температуры), и от потенциальной энергии взаимодействия частиц (объёма вещества):
![]()
Таким образом, статистический смысл величины «внутренняя энергия вещества» состоит в том, что она равна сумме
кинетической энергии хаотического поступательного и вращательного движения молекул;
потенциальной энергии взаимодействия молекул на расстояниях (притяжение);
потенциальной и кинетической энергий колебательного движения атомов в молекулах.
