
- •Часть 2. Основы учения о климате и микроклимате
- •Тема 4. Основы молекулярной физики и термодинамики Введение Предмет мф и тд
- •Агрегатные состояния вещества
- •Основные методы изучения вещества
- •Физические модели в мф и тд
- •§ 4.1. Молекулярно-кинетическая теория
- •4.1.1. Основные утверждения мкт Всякое вещество состоит из частиц
- •Частицы взаимодействуют друг с другом
- •Частицы совершают тепловое движение
- •4.1.2. Основные законы теплового движения Основное уравнение мкт
- •Теорема о равнораспределении энергии
- •Температура – мера энергии
- •4.1.3. Статистические распределения молекул Распределение Максвелла
- •Распределение Больцмана
- •§ 4.2. Термодинамика
- •4.2.1. Основные понятия термодинамики
- •4.2.2. Начала термодинамики и их применение
- •Первый постулат тд
- •Второй постулат тд
- •Третий постулат тд
- •Четвёртый постулат тд
- •Пятый постулат тд
- •§ 4.3. Явления переноса и фазовые превращения
- •4.3.1. Диффузия
- •4.3.2. Вязкость
- •4.3.3. Теплопроводность
- •Тема 5. Микроклимат помещений
- •§ 5.1. Этапы теплотехнического проектирования зданий
- •Формирование климата
- •§ 5.2. Распространение тепла в ограждающих конструкциях Теплообмен
- •Теплопередача
- •Термическое сопротивление
- •Тепловосприятие
- •Теплоотдача
Физические модели в мф и тд
Объект ли процесс заменяют какой-либо моделью:
"идеальный газ" – газ при температуре порядка комнатной (~300 К) и давлении порядка атмосферного (~105 Па), состоящий из одноатомных молекул, которые можно считать невзаимодействующими материальными точками;
"идеальная жидкость" – несжимаемая и невязкая жидкость;
"идеальный кристалл" – твёрдое тело, кристаллическая решётка которого не имеет дефектов.
§ 4.1. Молекулярно-кинетическая теория
4.1.1. Основные утверждения мкт Всякое вещество состоит из частиц
Масса вещества равна сумме масс частиц (молекул, атомов).
![]()
Масса частицы очень мала
![]()
Поэтому используют величину молярной массы, т. е. массы одного моля вещества. Она пропорциональна сумме относительных масс атомов в молекуле (указаны в таблице Менделеева):
![]()
Количество вещества равно отношению числа частиц к числу Авогадро
![]()
![]()
В одном моле содержится число Авогадро частиц.
Если частицы считать «упругими шариками», то их размер описывают величиной эффективный диаметр, т. е. реальный диаметр совместно с частью пространства, которое при столкновении частиц недоступно из-за сил отталкивания. Иначе, эффективный диаметр - это минимальное расстояние, на которое могут сблизиться центры частиц при столкновении (рис.)
![]()

Частицы взаимодействуют друг с другом
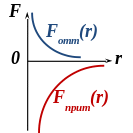
Силами взаимодействия являются силы Ван-дер-Ваальса – силы притяжения и отталкивания. Они существенно, но по-разному зависят от расстояния между частицами (рис.):
![]() ,
,
![]() ,
,
![]()
Р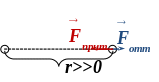 ассмотрим
зависимость сил Ван-дер-Ваальса от
расстояния между частицами газа.
ассмотрим
зависимость сил Ван-дер-Ваальса от
расстояния между частицами газа.
На далёких расстояниях между частицами силы притяжения и отталкивания пренебрежимо малы (рис.), и частицы движутся равномерно, без ускорений
![]()
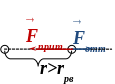 .
.
При сближении частиц силы Ван-дер-Ваальса возрастают (рис.), при этом притяжение преобладает над отталкиванием:
![]()
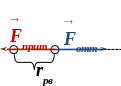 .
.
При дальнейшем сближении силы отталкивания существенно возрастают (рис.), компенсируя силы притяжения (энергия взаимодействия частиц минимальная):
![]()
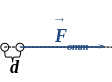 .
.
На малых расстояниях между частицами силы отталкивания преобладают над силами притяжения (рис.), и происходит столкновение частиц – они не могут сблизиться на расстояние, меньшее эффективного диаметра
![]() .
.
Частицы совершают тепловое движение
Тепловое движение – это непрерывное хаотическое движение частиц, которые сталкиваются друг с другом случайным образом.
Во время столкновения силы отталкивания заставляют частицы «разлетаться», при этом у каждой частицы изменяются (рис.):
модуль и направление скорости (по закону сохранения импульса),
кинетическая энергия,
пройденный путь до следующего столкновения.
н
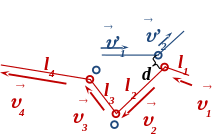 аправление
траектории (в течение некоторого времени
наблюдения она приобретает вид ломаной
линии из отрезков разной длины).
аправление
траектории (в течение некоторого времени
наблюдения она приобретает вид ломаной
линии из отрезков разной длины).
После столкновения силы Ван-дер-Ваальса быстро убывают, и движение молекул можно считать равномерным, «свободным».
Случайность столкновений (вероятностный процесс) означает, что длина свободного пробега (пути) между столкновениями, скорость и кинетическая энергия любой молекулы являются случайными величинами. Поэтому физический смысл имеют средние значения этих величин.
Средняя длина свободного пробега молекулы

Вакуум - это состояние газа, в котором средняя длина свободного пробега частиц сопоставима и больше линейных размеров сосуда, т. е. частицы практически не сталкиваются друг с другом. Понятие вакуума относительно: чем больше характерный размер сосуда, тем при меньшем давлении наступает состояние вакуума, и наоборот. Например, для воздуха в пористых телах с диаметром пор менее 10-7 м (< 0,1 мкм), состояние воздуха можно считать вакуумом даже при атмосферном давлении.
Средняя арифметическая скорость молекулы
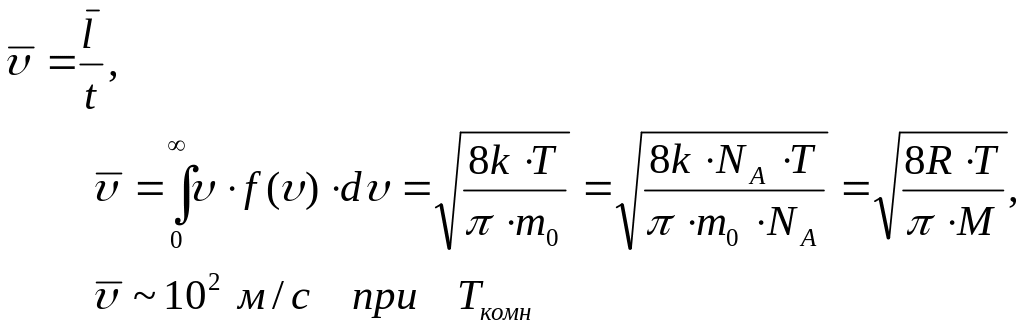
(f() – плотность вероятности, определяемая функцией Максвелла)
Средняя квадратичная скорость молекулы
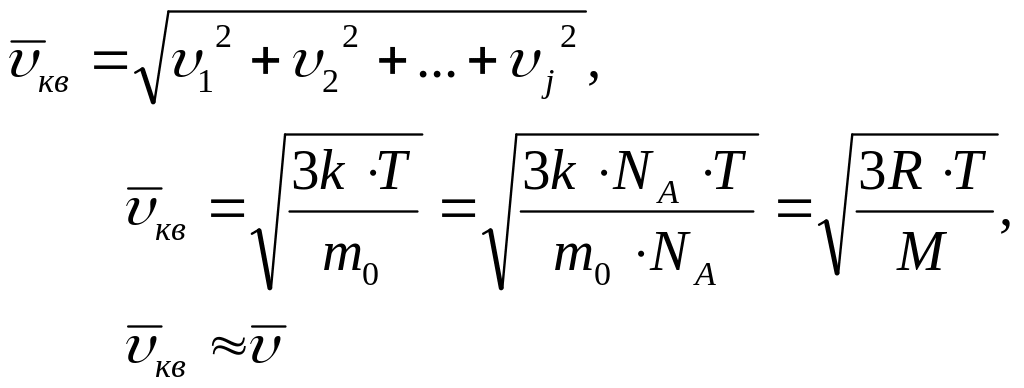
Средняя кинетическая энергия молекулы
![]()
