
- •Часть 2. Основы учения о климате и микроклимате
- •Тема 4. Основы молекулярной физики и термодинамики Введение Предмет мф и тд
- •Агрегатные состояния вещества
- •Основные методы изучения вещества
- •Физические модели в мф и тд
- •§ 4.1. Молекулярно-кинетическая теория
- •4.1.1. Основные утверждения мкт Всякое вещество состоит из частиц
- •Частицы взаимодействуют друг с другом
- •Частицы совершают тепловое движение
- •4.1.2. Основные законы теплового движения Основное уравнение мкт
- •Теорема о равнораспределении энергии
- •Температура – мера энергии
- •4.1.3. Статистические распределения молекул Распределение Максвелла
- •Распределение Больцмана
- •§ 4.2. Термодинамика
- •4.2.1. Основные понятия термодинамики
- •4.2.2. Начала термодинамики и их применение
- •Первый постулат тд
- •Второй постулат тд
- •Третий постулат тд
- •Четвёртый постулат тд
- •Пятый постулат тд
- •§ 4.3. Явления переноса и фазовые превращения
- •4.3.1. Диффузия
- •4.3.2. Вязкость
- •4.3.3. Теплопроводность
- •Тема 5. Микроклимат помещений
- •§ 5.1. Этапы теплотехнического проектирования зданий
- •Формирование климата
- •§ 5.2. Распространение тепла в ограждающих конструкциях Теплообмен
- •Теплопередача
- •Термическое сопротивление
- •Тепловосприятие
- •Теплоотдача
Третий постулат тд
Третий постулат называют первым началом термодинамики (о существовании способов изменения внутренней энергии): существует два способа изменения внутренней энергии ТД системы - передача (сообщение или отнятие) теплоты и совершение работы внешними системами над данной системой
![]() ,
,
![]() .
.
Количество теплоты и работа являются способами изменение внутренней энергии, поэтому имеют различные значения в разных процессах, т. е. характеризуют не состояние системы, а процесс изменения состояния.
Рассмотрим первое начало термодинамики в применении к различным процессам в идеальном газе.
Изохорный процесс – это процесс при неизменном объёме вещества:
![]()
В этом случае ТД система работу не совершает:

Тогда всё отдаваемое системе (или отбираемое) количество теплоты при изохорном процессе идёт только на изменение её внутренней энергии (кинетической энергии):
![]() .
.
Поскольку
![]() ,
,
то
![]()
С точки зрения классической теории теплоёмкости молярная изохорная теплоёмкость не зависит от температуры, определяется лишь числом степеней свободы и является постоянной величиной для данного газа. В частности,

Изобарный процесс – это процесс при неизменном давлении вещества:
![]()
В этом случае ТД система совершает работу:

Тогда всё отдаваемое системе (или отбираемое у системы) количество теплоты при изобарном процессе идёт на изменение её внутренней энергии совершение системой работы против окружающей среды:
![]()
Поскольку
![]() ,
,
то
![]()
С точки зрения классической теории теплоёмкости молярная изобарная теплоёмкость не зависит от температуры, определяется лишь числом степеней свободы и является постоянной величиной для данного газа. При этом
![]()
и справедливо уравнение Мáйера:
![]() .
.
В частности,

Изотермический процесс – процесс при неизменной температуре вещества:
![]()
В этом случае ТД система совершает работу:
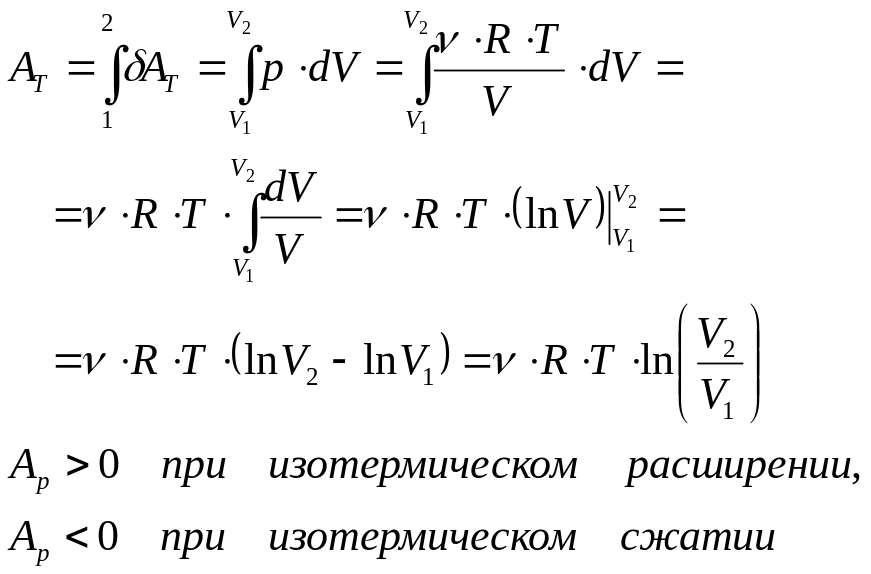
Поскольку внутренняя энергия не меняется
![]()
то всё отдаваемое системе (или отбираемое у системы) количество теплоты при изотермическом процессе идёт только на совершение системой работы против окружающей среды:
![]()
При этом с точки зрения классической теории теплоёмкости молярная изотермическая теплоёмкость бесконечно велика:
![]()
Адиабатическим называют процесс, протекающий без теплообмена между ТД системой (веществом) и окружающей средой
![]()
Тогда
![]()
т. е. при адиабатическом процессе работа ТД системы над окружающей средой происходит за счёт убыли внутренней энергии системы:
![]() .
.
Поскольку
![]()
то работа равна

Молярная адиабатическая теплоёмкость равна нулю:
![]()
Адиабатический процесс является изоэнтропийным (энтропия не меняется):
![]()
Все другие параметры {p, V, T} меняются. Их взаимосвязь выражается уравнением Пуассона (в разных переменных):

Величина называется коэффициентом Пуассона (показатель адиабаты) и равна
![]()
В частности,

И з
сравнения уравнения Пуассона в переменных
(p,
V)
и уравнения Бойля – Мариотта (для
изотермического процесса) с учётом
з
сравнения уравнения Пуассона в переменных
(p,
V)
и уравнения Бойля – Мариотта (для
изотермического процесса) с учётом
![]()
следует, что адиабата на координатной сетке (p, V) «круче» изотермы (рис.).
Теоретическое рассмотрение теплоёмкостей всех процессов показало, что они не зависят от температуры. Однако опыты свидетельствуют, что при охлаждении вещества его теплоёмкость уменьшается и в пределе при абсолютном нуле температуры стремится к нулю. Это привело к необходимости создания новой теории теплоёмкости – квантовой теории – для области низких температур. Классическая МКТ и ТД оказываются не справедливыми при исследовании веществ с очень низкими температурами.
