
- •1. Вода, ее происхождение и количество на земном шаре.
- •2. Круговорот воды на земном шаре.
- •3. Физические и химические свойства воды.
- •4. Дисперсные водные системы и их классификация.
- •5. Свойства коллоидных растворов, их устойчивость и разрушение.
- •6. Состав природных вод.
- •7.Показатели качества природных вод.
- •8. Оценка качества поверхностных вод.
- •9. Контроль загрязнения поверхностных вод
- •10. Показатели качества сточных вод
- •11. Оценка качества сточных вод.
- •12. Понятие о системах водообеспечения и водоотведения промышленных предприятий.
- •13. Система канализации промышленных предприятий.
- •14. Условия выпуска производственных сточных вод в городскую канализацию.
- •15. Определение необходимой степени очистки производственных сточных вод.
- •16. Основная схема механической очистки производственных сточных вод.
- •17. Решетки для процеживания. Назначение. Схема.Принцип действия. Пропускная способность.
- •18. Песколовки. Назначение. Схема. Принцип действия. Пропускная способность.
- •19. Усреднители. Назначение. Схема. Принцип действия. Пропускная способность.
- •20. Теоретические основы процессов осаждения твердых частиц в вязкой среде.
- •21. Первичные отстойники. Назначение. Схема. Принцип действия. Пропускная способность. Эффективность очистки сточных вод.
- •22. Осветлитель. Назначение. Схема. Принцип действия. Пропускная способность. Эффективность очистки сточных вод.
- •23. Открытые и напорные гидроциклоны. Назначение. Схема. Принцип действия. Эффективность очистки
- •24. Центрифуги. Назначение. Схема. Принцип действия. Пропускная способность
- •25. Фильтрование через фильтрующие перегородки.
- •26. Сетчатые барабанные фильтры.
- •Глава 1Фильтры с зернистой загрузкой.
- •Глава 2Реагентная нейтрализация.
- •Расход реагентов, кг/кг, для нейтрализации 100%-ных кислот и щелочей
- •29. Нейтрализация кислых сточных вод путем их фильтрования через нейтрализующие материалы.
- •30. Окисление реагентами, содержащими активный хлор.
- •Состав цианосодержащих сточных вод гальванических цехов автозаводов России. (по д.Н.Смирнову и в.Е.Генкину).
- •31. Озонаторы. Назначение. Основные химические реакции в процессе озоноривания. Схема озонатора. Технические характеристики отечественных озонаторов трубчатого типа.
- •32. Очистка восстановлением. Назначение метода. Основные химические реакции.
- •34. Коагуляция и флокуляция. Назначение в очистке сточных вод. Осветлители со взвешенным слоем осадка. Схема. Принцип действия аппарата.
- •35.Сорбционный фильтр. Назначение. Схема. Принцип действия.
- •36 Флотация. Назначение метода. Схема аппарата флотации. Принцип очистки сточных вод.
- •37 Экстракция. Назначение метода. Схема процессов многоступенчатой экстракции. Принцип очистки сточных вод.
- •38. Ионный обмен. Назначение метода. Принцип осуществления ионного обмена при очистке сточных вод. Технологические схемы ионного обмена.
- •Технологические схемы ионообменной очистки сточных вод и установки для их реализации.
- •39. Электролизеры. Назначение. Принципиальная схема аппарата. Принцип действия электролизера.
- •40. Обратный осмос и ультрафильтрация для очистки сточных вод. Назначение метода. Схема осмоса. Принцип очистки сточных вод методом осмоса и методом ультрафильтрации.
- •41. Термическая обработка сточных вод. Назначение метода. Принципиальные схемы установок.
- •42. Сооружения почвенной очистки и биологические пруды. Назначение. Принцип очистки сточных вод.
- •43. Биофильтры. Назначение. Схемы биофильтров. Принцип действия. Производительность.
- •44. Аэротенки. Назначение. Схемы аэротенков. Принцип действия. Производительность.
- •45. Окситенки. Назначение. Схемы окситенков. Принцип действия. Производительность
- •46. Основные процессы, применяемые для обработки осадков производственных сточных вод . Схемы аппаратов.
- •47. Анаэробное (метановое) сбраживание осадков. Схема процесса. Принцип действия
- •48. Термическая сушка осадков. Назначение. Схема применяемого оборудования. Принцип действия.
32. Очистка восстановлением. Назначение метода. Основные химические реакции.
При содержании в сточных водах легко восстанавливаемых соединений меди, хрома, мышьяка, ртути применяют методы восстановительной очистки. Катионы меди, содержащиеся в кислых сточных водах могут быть выделены цементацией на железном скрапе или никелевом песке. При этом протекают следующие реакции восстановления:
Сu2+ + Fe Cu + Fe2+
Cu2+ + Ni Cu + Ni2+
Медь выделяется на железе или никеле в виде металла, и вместо нее в раствор переходят катионы железа или никеля. Метод цементации применяют для грубой, предварительной очистки достаточно концентрированных по меди сточных вод. Очищенная цементацией вода затем нейтрализуется до рН = 8 9 при одновременной доочистке ее от оставшихся катионов меди и перешедших в раствор катионов железа или никеля.
Высокотоксичные соединения шестивалентного хрома содержатся в промывных сточных водах и отработанных технологических растворах, образовавшихся в процессе хромирования, при химической обработке поверхностей стальных изделий (травление, пассирование), при анодировании изделий из алюминия и при проведении других технологических процессов.
Обработка сточных вод осуществляется в две ступени:
1) перевод (восстановление) шестивалентного хрома в трехвалентную форму;
2) осаждение трехвалентного хрома в виде гидроксида.
При обработке хромсодержащих сточных вод солями сернистой кислоты протекают следующие химические реакции:
Cr2O72- + 3HSO3- + 5H+ 2Cr3+ + 3SO42- + 4H2O
Cr2O72- + 3SO32- + 8H+ 2Cr3+ + 3SO42- + 4H2O
Скорость и полнота восстановления до указанными солями в значительной степени зависит от величины рН, причем наибольшая скорость наблюдается при рН=2 2,5, что требует дополнительного подкисления сточных вод. Для этих целей обычно используют 10-15 % раствора серной кислоты.
После восстановления в кислой среде шестивалентного хрома до трехвалентного состояния сточные воды подвергают нейтрализации, при которой осаждается в виде гидроксида. В качестве реагентов-восстановителей используют Cu(OH)2, Na2CO3, NaOH. Во всех случаях осуществляется следующая химическая реакция:
Cr3+ + 3OH- Cr(OH)3
Оптимальное значение рН этой реакции - 8,0 9,5 обладает амфoтерными свойствами и при рН=12 растворяется в избытке едкой щелочи. При этом протекает следующая химическая реакция:
Сr (OH)3 + NaOH NaCrO2 + 2H2O
При использовании в качестве восстановителя сульфата двухвалентного железа (FeSO4), процесс можно проводить в кислой, нейтральной и щенлочной среде:
2CrO3 + 6FeSO4 + 6H2SO4 3Fe2(SO4)3 + Cr2(SO4)3 + 6H2O
2CrO3 + 6FeSO4 + 6Ca(OH)2 + 6H2O 2Cr(OH)3 + 6Fe(OH)3 + 6CaSO4
Восстановление диоксидом серы происходит по схеме:
SO2 + H2O H2SO3
2CrO3 + 3H2SO3 Cr2(SO4)3 + 3H2O
В присутствии в сточных водах соды протекает следующая химическая реакция:
6Na2CrO4 + SO2 + Na2CO3 + nH2O Cr2O3nH2O + 3Na2SO4 + CO2
В результате протекания этой реакции происходит практически полное удаление шестивалентного хрома из раствора.
Реакция восстановления шестивалентного хрома гидразином протекает в нейтральной или слабощелочной среде:
4K2CrO4 + 3N2H4 4Cr(OH)3 + 3N2 + 8KOH
33. Реагентные методы выделения загрязняющих веществ в виде малорастворимых и нерастворимых соединений. Назначение. Химические реакции. Общая технологическая схема реагентной очистки сточных вод от ионов тяжелых металлов.
Для очистки производственных сточных вод от соединений тяжелых цветных металлов. и в первую очередь, от соединений Сu, Ni, Co, Zn, Pb, Cd, Hg их осаждают в виде соответствующих гидрооксидов, сульфатов, либо карбанатов. Растворимость вышеуказанных соединений может быть охарактеризована также произведением растворимости. Для выделения из кислых сточных вод тяжелых цветных металлов и железа используются те же реагенты, что и при нейтрализации. При этом протекают следующие реакции:
Me2+ + 2OH- Me (OH)2
Me3+ + 3OH- Me (OH)3
Количество реагентов, (G, кг), необходимых для нейтрализации кислых сточных вол, содержащих тяжелые цветные металлы рассчитывают по следующей формуле:
G
= k
![]() (a A + b1C1
+ b2C2
+ ........ + bn Cn),
(a A + b1C1
+ b2C2
+ ........ + bn Cn),
где k - коэффициент запаса расхода реагента по сравнению с теоретическим (для известкового молока k=1,1 для известкового теста и сухой извести k=1,5);
В - количество активной части в товарном продукте, %;
Q - количество сточных вод, подлежащих нейтрализации, м3;
а - расход реагента для нейтрализации, кг/кг;
А - концентрации щелочи, кг/м;
С1,С2,...,Сn - концентрации металлов в сточных водах, кг/м
b1, b2,....,bn - расход реагентов, требуемых для перевода металлов из растворенного состояния в осадок.
В многокомпонентных сточных водах, значения рН, соответствующие началу и окончанию осаждения гидроксидов, существенно сдвинуты в сторону больших величин.
Следует указать, что ионы тяжелых цветных металлов могут осаждаться не только в виде гидроксидов, но и гидроксид-карбонаты (в случае использования для осаждения реагентов, содержащих в своем составе карбонатные ионы). Например:
2ZnCl2 + 2Na2CO3 + H2O 4NaCl + CO2 + (ZnOH)2CO3
2Сu + 2ОН- + СО32- (СuОН)2СО3
2Ni2+ + CO32- + 2OH- (NiOH)2CO3
2Рb + 2ОН- + СО32- (РbОН)2СО3
Кроме того, возможно образование и труднорастворимых карбонатов тяжелых цветных металлов:
Ni2+ + CO32- NiCO3
Рb + CO32- РbСО3
Гидрооксиды цинка, свинца, меди, алюминия и некоторых других металлов растворяются в избытке едкой щелочи с образованием комплексных анионов. Ниже представлена величина рН, соответствующая началу растворения гидроксидов (по Д.Н.Смирнову и В.Е.Генкину):
Цинк, алюминий и некоторые другие металлы, обладающие амфотерными свойствами, могут содержаться в виде анионов в щелочных сточных водах. Для их удаления используют растворы кислот. При этом образуются осадки гидроксидов этих металлов согласно следующим уравнениям:
AlO2- + H+ + H2O Al(OH)3
ZnO2- + 2H+ Zn(OH)2
При обработке щелочными реагентами сточных вод, содержащих ионы тяжелых цветных металлов, достигается снижение их концентраций до величин, позволяющих осуществлять сброс очищенной воды в городскую канализацию или водоемы санитарно-бытового пользования.
В том случае, когда требуется более глубокая степень очистки, тяжелые металлы рекомендуется выделять в виде сульфидов. Обычно в виде сульфидов выделяют Сu, Со, Ni, Fe, Sn, Mo, As, Sb, Hg, Ag, Zn, Cd, Pb. Для двухвалентного катиона металла реакция образования сульфида может быть записана в следующем виде:
Ме2+ + S2- MeS
В качестве осадителя обычно используют Na2S ( реже - (NH4)2S ).
В отечественной практике для выделения из сточных вод сурьмы и мышьяка в виде малорастворимых сульфидов в качестве реагента-осадителя используют сульфат железа. Sb3+ в зависимости от величины рН содержится в сточных водах либо в виде анионов тиосолей (SbS2-), либо в виде кислородсодержащих анионов, что практически встречается редко. Указанные анионы тиосолей диссоциируют в растворе с образованием сульфид-ионов:
2SbS2- Sb2S3 + S2-
При выделении из раствора сульфид-ионов эта реакция практически целиком сдвигается вправо. При этом образуется нерастворимый сульфид сурьмы и вода оказывается очищенной. При добавлении к сточным водам сульфита железа протекает следующая реакция:
2SbS2- + FeSO4 Sb2S3 + FeS + SO42-
Данный метод позволяет очистить сточную воду от сурьмы практически полностью. Общий расход сульфита железа (Q , г/л), необходимый для очистки сточных вод от сурьмы может быть определен по следующей формуле:
где С S2-- концентрация несвязанных сульфид-ионов очищаемой сточной воды, г/л;
С Sb3+ - концентрация сурьмы в очищаемой сточной воде, г/л:
q - дополнительное количество сульфита железа при очистке сточных вод, содержащих сурьму, входящую в состав анионов SbS2- или SbS3- ( q обычно составляет 1 - 5 г/л).
Рассмотренный метод может быть использован и для очистки сточных вод от мышьяка, если он присутствует в растворах в виде тиосолей. При этом анионы тиосолей диссоциируют в растворе с образованием сульфид-иона:
2AsS2- As2S3 + S2-
При добавлении к очищаемым сточным водам сульфата железа образуются практически нерастворимые сульфиды железа и мышьяка:
2AsS2- + FeSO4 As2S3 + FeS + SO42-
Существуют методы осаждения катионов тяжелых цветных металлов в виде труднорастворимых соединений, в основе которых лежит окислительно-восстановительные реакции. Примером этого является способ выделения из растворов и промышленных сточных вод двухвалентного кобальта с использованием органического реагента - этилксантогената калия КSСSОС2Н5 . Двухвалентный кобальт в процессе осаждения окисляют до трехвалентного состояния двухвалентной медью‑ которая при этом восстанавливается до одновалентной и также осаждается ксантогенатом по реакции:
Сu2+ + Со2+ + 4( SСSОС2Н5 )- СuSСSОС2Н5 + Со(SСSОС2Н5)3
Содержание меди и кобальта в очищенных указанном способом водах не превышает ПДК. В осадок переходят смешанные ксантогенаты меди и кобальта.
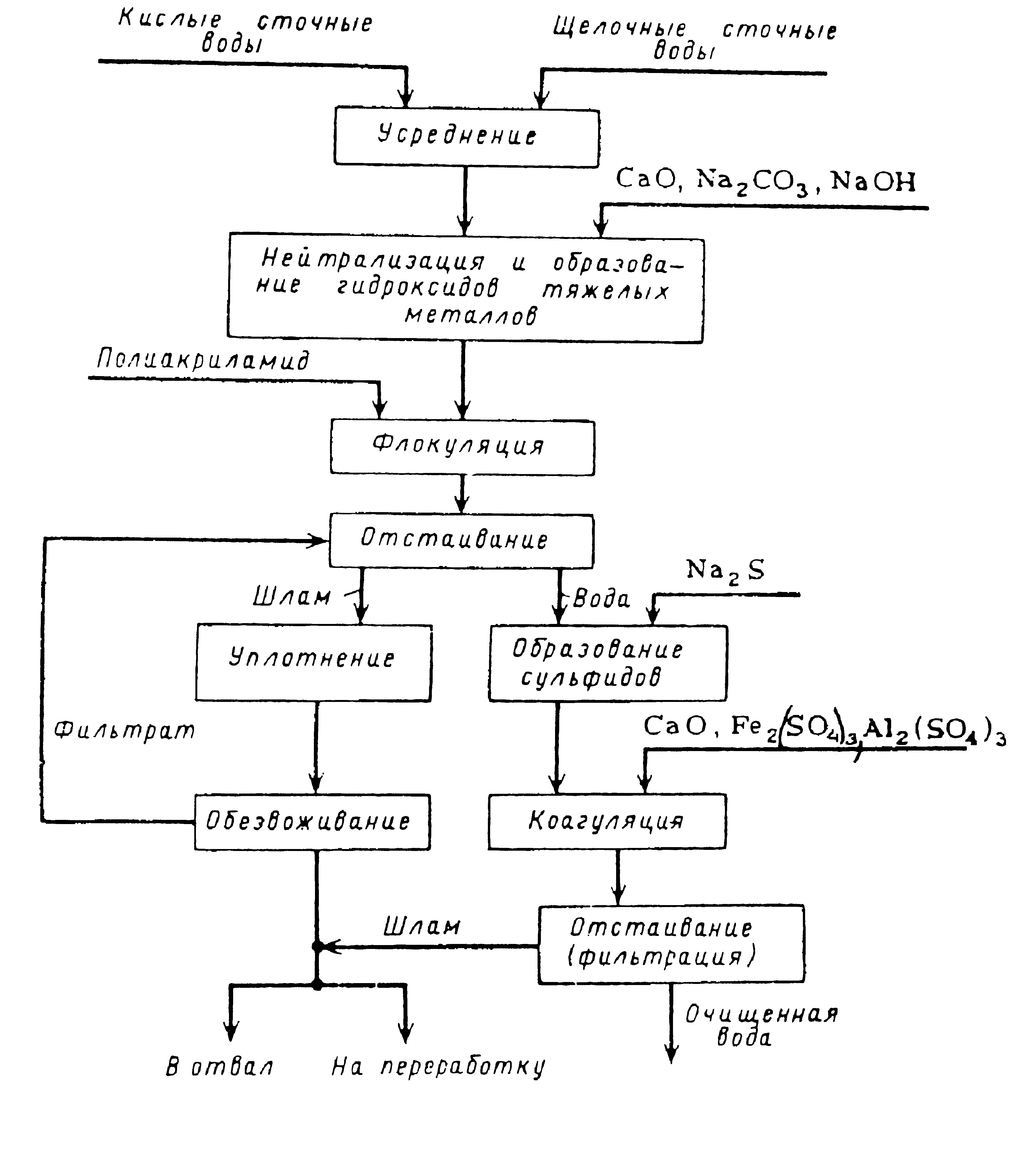
Рис. Общая технологическая схема реагентной очистки сточных вод от ионов тяжелых металлов.
К преимуществам реагентного метода следует отнести высокую степень очистки от тяжелых металлов (до ПДК), а также простоту эксплуатации оборудования. Основные недостатки метода - это образование значительных количествах трудноперерабатываемого шлама, а также существенный расход реагентов и связанная с этим необходимость организации реагентного хозяйства. Кроме того, очищенная этим методом вода содержит значительное количество солей и может быть использованы в оборотных системах водоснабжения лишь после дополнительной очистки.
