
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9 Соотношение неопределённостей Гейзенберга
- •Вопрос 10 .Волновая функция и ее статистический смысл
- •Вопрос 11 Стационарное уравнение Шрёдингера
- •Вопрос 12
- •Вопрос 14 Прохождение частицы сквозь потенциальный барьер, туннельный эффект
- •Вопрос 15 Квантовый гармонический осциллятор
- •Вопрос 16 Решение уравнения Шрёдингера
- •Вопрос 17 Квантование энергии электрона в атоме
- •Линейчатый спектр атома водорода
- •1. Орбитальный механический момент импульса электрона
- •Вопрос 19
- •Вопрос 20
- •Структура периодической системы
- •Значение периодической системы
- •Вопрос 21 Поглощение, спонтанное и вынужденное излучения
- •Эйнштейна коэффициенты
- •Вопрос 22
- •Принцип действия лазера
- •Вопрос 23
- •1. Классическая теория теплоёмкости. Модель независимых осцилляторов
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •§ 77. Периодическая система элементов Менделеева
- •Вопрос 29
- •Вопрос 30
- •13.Температурная зависимость электропроводимости п/п-ов.
- •Вопрос 32
- •Масса и энергия связи ядра
- •Вопрос 33
- •Гамма-лучи
- •Бета-лучи
- •Альфа-частицы
- •Законы сохранения в ядерных реакциях
- •Закон сохранения энергии
- •Закон сохранения импульса
- •Закон сохранения момента импульса
- •Другие законы сохранения
- •Вопрос 35
- •Вопрос 36
§ 77. Периодическая система элементов Менделеева
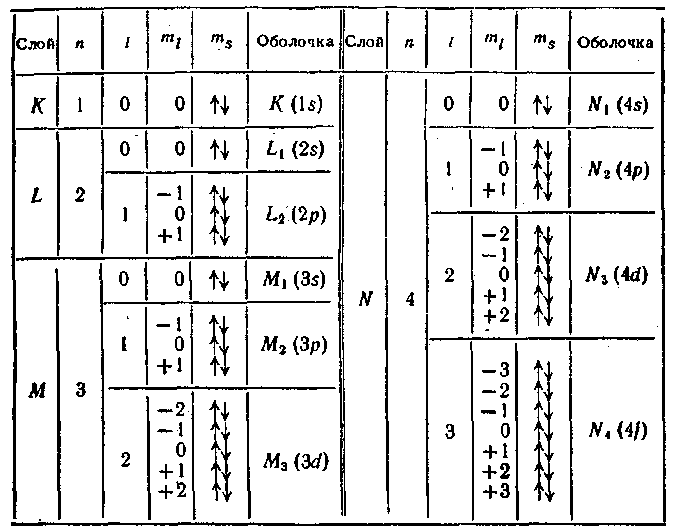
Принцип Паули дает объяснение периодической повторяемости свойств атомов. Проследим построение периодической системы элементов Д. И. Менделеева. Начнем с атома с Z = 1, имеющего один электрон. Каждый последующий атом будем получать, увеличивая заряд ядра предыдущего атома на единицу и добавляя к нему один электрон, который мы будем
помещать в доступное ему согласно принципу Паули состояние с наименьшей энергией,
В
атоме водорода имеется в основном
состоянии один Is электрон с произвольной
ориентацией спина. Его квантовые числа:
![]()
![]() .
Соответственно основной терм водородного
атома имеет вид 25у2.
.
Соответственно основной терм водородного
атома имеет вид 25у2.
Если заряд ядра атома водорода увеличить на единицу и добавить к нему еще один электрон, получится атом гелия. Оба электрона в этом атоме могут находиться в /(-слое, но с антипараллельной ориентацией спинов.
Так
называемая электронная конфигурация
амома может быть записана как Is2
(два ls-электрона). Основным термом будет
![]() (L
=
О, S
=
= 0,7 = 0).
(L
=
О, S
=
= 0,7 = 0).
На атоме гелия заканчивается заполнение слоя К. Третий электрон атома лития может занять лишь уровень 2s (рис, 218). Получается электронная конфигурация ls22s. Основное состояние характеризуется L = О, 5 = 7г- Поэтому основным термом, как и у водорода, будет 2Sy2. Третий электрон атома лития, занимая более высокий энергетический уровень, чем остальные два электрона, оказывается слабее, чем они, связанным с ядром атома, В результате он определяет оптические и химические свойства атома.
У четвертого элемента, бериллия, полностью заполняется оболочка 2s. У последующих шести элементов (В, С, N, О, F и Ne) происходит заполнение электронами оболочки 2/7, в результате чего неон имеет полностью заполненные слои К (двумя электронами) и L (восемью электронами), образующие устойчивую систему, подобную системе гелия, чем обусловливаются специфические свойства инертных газов.
Процесс
застройки электронных оболочек у
элементов периодической системы
наглядно представлен в табл, 6. Одиннадцатый
элемент, натрий, имеет, кроме заполненных
слоев К
и
L, один электрон в оболочке 3s. Электронная
конфигурация имеет вид:
![]() .
Основным
.
Основным

Рис. 218.
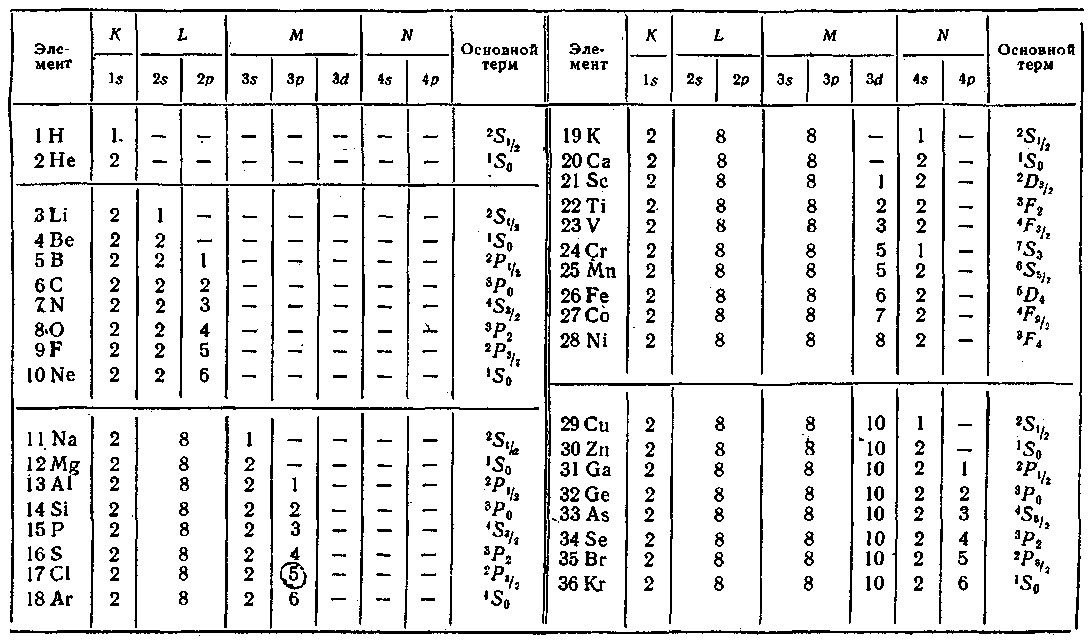

термом будет 2Sy2. Электрон 35 связан с ядром слабее других и является валентным или оптическим электроном. В связи с этим химические и оптические свойства натрия подобны свойствам лития.
Основное состояние оптического электрона в атоме натрия характеризуется значением п — 3. Этим и объясняется то обстоятельство, что на схеме* уровней атома натрия (см. рис. 204) основной уровень помечен цифрой 3. Попутно отметим, что атом цезия имеет в основном состоянии электронную конфигурацию
![]()
Следовательно, его оптический электрон имеет в основном состоянии п — 6. В соответствии с этим помечены уровни на рис. 205.
У следующих за натрием элементов нормально заполняются оболочки 35 и Зр. Оболочка 3d при данной общей конфигурации оказывается энергетически выше оболочки 45, в связи с чем при незавершенном в целом заполнении слоя М начинается заполнение слоя N. Оболочка Ар лежит уже выше, чем 3d, так что после 45 заполняется оболочка 3d.
С аналогичными отступлениями от обычной последовательности, повторяющимися время от времени, осуществляется застройка электронных уровней всех атомов. При этом периодически повторяются сходные электронные конфигурации (например, 15, 25, 35 и т. д.) сверх полностью заполненных оболочек или слоев, чем обусловливается периодическая повторяемость химических и оптических свойств атомов.
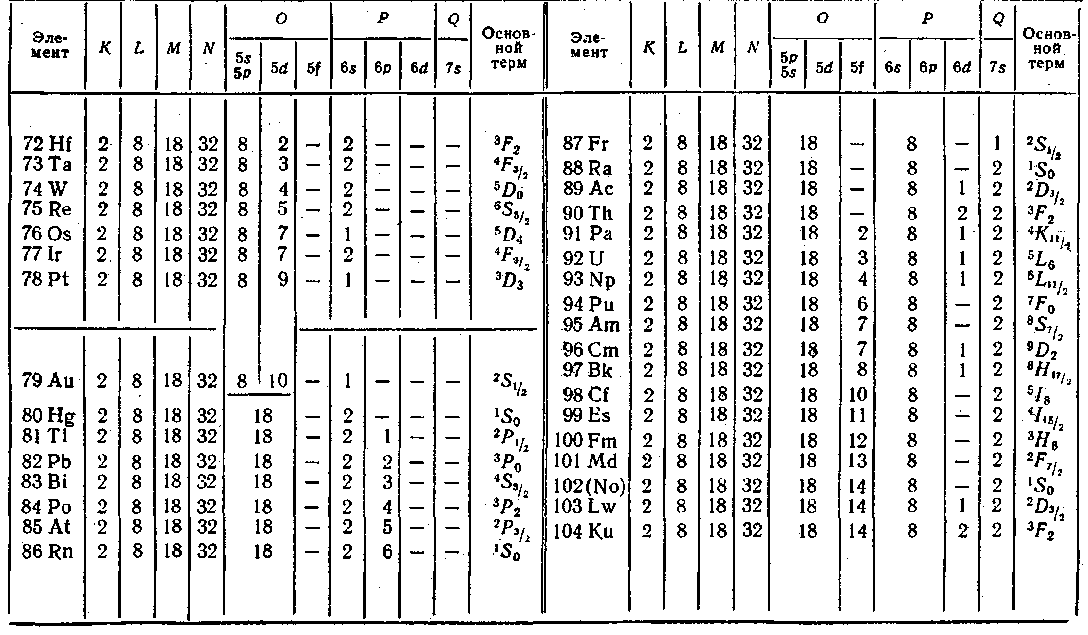
Как видно из табл. 6, заполнение оболочки 4f, которая может содержать 14 электронов, начинается лишь после того, как полностью заполняются оболочки 55, 5/) и 6s. Квантовомеханический расчет показывает, что в d- и особенно в /-состоянии электрон находится гораздо ближе к ядру, чем в 5- и ^-состояниях. Следовательно, 4f-электроны располагаются во внутренних областях атома. Поэтому у элементов с номера 58 по 71, называемых редкими землями или лантанидами, внешняя оболочка (б52) оказывается одинаковой. В связи с этим лантани-ды весьма близки по своим химическим свойствам, которые определяются внешними (валентными) электронами. Аналогичную группу химически родственных элементов
образуют актиниды (атомные номера с 90 по 103), у которых заполняется 5/-оболочка при неизменной внешней оболочке 7s2.
Изложенные
в § 74 правила сложения моментов позволяют
вычислить значения квантовых чисел L,
S и /, возможные при заданной электронной
конфигурации. Так, например, при
конфигурации пр2
(два
электрона с главным квантовым числом
п
и
I
= \) возможными
значениями L
будут
0, 1, 2 (1\
=
1, /2
= 1), а квантовое число 5 может иметь
значения 0 и 1 (si = 7г, s2
■=
7г)-В соответствии с этим, казалось бы,
при конфигурации пр2
возможны
термы:
![]() .
Однако при
.
Однако при
установлении вида термов, возможных при данной кон: фигурации эквивалентных электронов (т. е. электронов с одинаковыми я и 1), необходимо считаться с принципом Паули — для эквивалентных электронов возможны лишь такие термы, для которых значения хотя бы одного квантового числа (т, или ms) обоих электронов не совпадают1). Этому требованию, очевидно, не удовлетворяет, например, терм 3Z). Действительно, L — 2 означает, что орбитальные моменты электронов «параллельны», следовательно, значения trti у этих электронов будут совпадать. ^Аналогично S = 1 означает, что спины электронов 'также «параллельны», вследствие чего совпадают и значения ms. В итоге все четыре квантовых числа (п, /, rrii и ms) у обоих электронов оказываются одинаковыми, что противоречит принципу Паули. Таким образом, терм 3D в системе из двух эквивалентных электронов реализоваться не может.
Чтобы установить возможные термы, согласующиеся с принципом Паули, используют следующий прием: в столбцах таблицы, помеченных значениями nti отдельно, взятого электрона, проставляют в виде стрелок значения ms (стрелка вверх означает тв = -fV2, стрелка вниз— ms = —У2 (см. табл. 7, составленную для двух эквивалентных р-электронов). В таблице содержатся все до* пустимые принципом-Паули сочетания значений т\ и тл обоих электронов. В тех случаях, когда обе стрелки попадают в один столбец (это означает, что mi обоих электронов одинаково), они направлены в противоположные ороны (ms должны быть разными). В следующих столбцах таблицы проставлены соответствующие данному сочетанию значения квантовых чисел ML и MS} равные алгебраической сумме чисел mt и ms. Совокупность допустимых значений ML и Ms позволяет установить допустимые сочетания значений L и 5. Одна из таких совокупностей, помеченная буквой Л в последнем столбце таблицы, соответствует сочетанию L = 2, S = О, т. е. терму lDt вторая совокупность, помеченная буквой Б, соответствует L = 1, S = 1, т. е. терму гР и, наконец» совокупность, помеченная буквой С, соответствует L — О, S = =-О, т. е. терму *5. Таким образом, из указанных выше шести формально возможных термов не противоречат принципу Паули только три: l5, 3Я, lD, причем терм 3Я является триплетом — онтюдразделяется на компоненты: 3Я2, 3Ri> 3Ro- Возникает вопрос, какой из этих термов соответствует основному состоянию, т. е. состоянию с наименьшей энергией. Ответ на этот вопрос дают два эмпирических правила Хунда.
1. Из термов, даваемых эквивалентными электронами, наименьшей энергии соответствует терм с наиболь-

Таблица 7
шим возможным значением 5 (т. е. терм с наибольшей мультиплетностыо) и с наибольшим возможным при таком S значением I.
2. Мультиплеты, образованные эквивалентными электронами, являются правильными (это значит, что с увеличением / возрастает энергия сбстояния), если заполнено не более половины оболочки, и обращенными (с увеличением / энергия убывает), если заполнено больше половины оболочки.
Из второго правила Хунда следует, что в случае, когда заполнено не более половины оболочки, наименьшей энергией обладает компонента мультиплета с / = |L — 5|, в протианом случае — компонента с / *= L + S.
В рассмотренном нами примере двух р-электронов наименьшей энергией обладает терм 3Р (у него наибольшее 5), а из, трех его компонент наименьшей энер-; гией обладает 3Ro> так как оболочка заполнена только на одну треть (в р:оболочке может находиться 6 электронов).
Отметим, что результирующие моменты заполненных оболочек равны нулю. Поэтому при определении с помощью правила' Хунда основного терма, атома следует рассматривать только незаполненную оболочку. Конфигурацией пр2 сверх заполненных оболочек обладают углерод (С), кремний (Si), германий (Ge), олово (Sn) и свинец (РЬ). У всех этих элементов основным является терм 3Ro (см. табл. 6).
Металлы, диэлектрики и полупроводники с точки зрения зонной теории твердых тел.
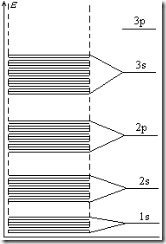 Нами
показано, что твердые тела имеют
многозонный спектр энергии. Зонная
теория твердых тел стала путеводной
звездой для ученых и инженеров работающих
в области твердотельной электроники,
она позволяет не только объяснить
удивительные свойства полупроводников
но и позволяет предсказать как их можно
радикально изменить. Представим себе
кристалл, состоящий из N одинаковых
элементов, каждый из которых содержит
z электронов. Все эти электроны размещаются
на энергетических уровнях соответствующих
зонам кристалла. В первую очередь
заполняются электронами зоны с наименьшей
энергией, это электроны находящиеся
непосредственно возле ядер, затем
заполняются зоны с более высокими
энергиями, пока не будут размещены все
zN электроны. На каждом энергетическом
уровне
Нами
показано, что твердые тела имеют
многозонный спектр энергии. Зонная
теория твердых тел стала путеводной
звездой для ученых и инженеров работающих
в области твердотельной электроники,
она позволяет не только объяснить
удивительные свойства полупроводников
но и позволяет предсказать как их можно
радикально изменить. Представим себе
кристалл, состоящий из N одинаковых
элементов, каждый из которых содержит
z электронов. Все эти электроны размещаются
на энергетических уровнях соответствующих
зонам кристалла. В первую очередь
заполняются электронами зоны с наименьшей
энергией, это электроны находящиеся
непосредственно возле ядер, затем
заполняются зоны с более высокими
энергиями, пока не будут размещены все
zN электроны. На каждом энергетическом
уровне
![]() свободного
(изолированного) атома могут находиться
2(2l+1) электронов: на s (l = 0) 2 электрона,
на p (l = 1) 6 электронов, на d (l = 2) 10 электронов.
При сближении атомов на месте одиночных
уровней
свободного
(изолированного) атома могут находиться
2(2l+1) электронов: на s (l = 0) 2 электрона,
на p (l = 1) 6 электронов, на d (l = 2) 10 электронов.
При сближении атомов на месте одиночных
уровней
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() образуются
энергетические зоны: 1s, 2s, 2p, 3s, 3p, 3d… В
каждой зоне N энергетических уровней,
значит s – зоны могут вместить 2N
электронов, p – зоны 6N электронов, d –
зоны 10N электронов и т.д. (смотри рисунок).
образуются
энергетические зоны: 1s, 2s, 2p, 3s, 3p, 3d… В
каждой зоне N энергетических уровней,
значит s – зоны могут вместить 2N
электронов, p – зоны 6N электронов, d –
зоны 10N электронов и т.д. (смотри рисунок).
В
зависимости от характера заполнения
электронами верхней зоны все твердые
тела делятся на три группы: металлы,
диэлектрики, и полупроводники. У
некоторых твердых тел самая верхняя
зона, содержащая электроны может быть
заполнена частично, т.е. у нее имеется
часть свободных уровней. Приложим к
такому кристаллу внешнее электрическое
поле, известно, что в конце длины
свободного пробега под действием
внешнего электрического поля, электроны
приобретают энергию от 10-4
до 10-8
эВ. Эта энергия значительно больше, чем
расстояние между соседними уровнями
зоны (10-22
эВ). В связи с этим электроны верхней
зоны переходят на свободные уровни с
более высокой энергией (смотри рисунок).
При
 этом
электрон пространственно смещается
по направлению против электрического
поля, что указано стрелкой. Если
смещающиеся электроны непрерывно
отводить от тела, что возможно в
электрической замкнутой цепи, то
квантовые переходы электронов, которые
указаны стрелкой, будут происходить
непрерывно долго, пока в цепи будет
источник внешнего поля. Таким образом,
твердые тела с указанным характером
заполнения верхней зоны будут хорошо
проводить электрический ток, такие
тела являются металлами.
При этом проводимость металла не
возрастает с ростом температуры,
наоборот, с понижением температуры
электропроводность увеличивается. При
комнатной температуре проводимость
“хороших” металлов
этом
электрон пространственно смещается
по направлению против электрического
поля, что указано стрелкой. Если
смещающиеся электроны непрерывно
отводить от тела, что возможно в
электрической замкнутой цепи, то
квантовые переходы электронов, которые
указаны стрелкой, будут происходить
непрерывно долго, пока в цепи будет
источник внешнего поля. Таким образом,
твердые тела с указанным характером
заполнения верхней зоны будут хорошо
проводить электрический ток, такие
тела являются металлами.
При этом проводимость металла не
возрастает с ростом температуры,
наоборот, с понижением температуры
электропроводность увеличивается. При
комнатной температуре проводимость
“хороших” металлов
![]() .
.
Представим себе кристаллы Na, их атомы имеют следующую электронную структуру: Na(z = 11) = 1s2 2s2 2p6 3s1. Видно, что уровень 3s содержит один валентный электрон. При образовании кристалла Na энергетические уровни , , , превращаются в зоны 1s, 2s, 2p, 3s. Последняя зона 3s будет содержать N электронов, а способна вместить 2N электронов, следовательно, последняя зона будет заполнена на половину, следовательно, кристаллы Na будут являться металлами. У некоторых кристаллов металлическая проводимость обусловлена тем, что самая верхняя зона, заполненная электронами перекрывается со следующей пустой зоной.
У
многих твердых тел самая верхняя зона
содержащая электроны может быть
заполнена полностью электронами, а
следующая за ней зона полностью пустая
и отделена от предыдущей зоны большим
промежутком запрещенных энергий
![]() .
Такие твердые тела получили название
диэлектриков
(изоляторов).
.
Такие твердые тела получили название
диэлектриков
(изоляторов).
 В
этом случае основная полностью
заполненная зона называется валентной
(V – зона), а следующая за ней пустая
зона разрешенных энергий называется
зоной проводимости (C – зона). Промежуток
запрещенных энергий, который разделяет
валентную зону и зону проводимости
называется запрещенной зоной. Ширина
этого промежутка
В
этом случае основная полностью
заполненная зона называется валентной
(V – зона), а следующая за ней пустая
зона разрешенных энергий называется
зоной проводимости (C – зона). Промежуток
запрещенных энергий, который разделяет
валентную зону и зону проводимости
называется запрещенной зоной. Ширина
этого промежутка
![]() ,где
,где
![]() -
дно зоны проводимости,
-
дно зоны проводимости,
![]() -
потолок валентной зоны. При T = 0 K0
диэлектрик не проводит электрический
ток. При повышении температуры
диэлектрика, электроны валентной зоны
начинают взаимодействовать с колебаниями
кристаллической решетки и получают от
нее энергию ~ KT, но некоторые электроны
получают значительно большую энергию.
Процесс передачи энергии электронам
– статистический. Тем неменее, число
электронов, которые получают от решетки
энергию
-
потолок валентной зоны. При T = 0 K0
диэлектрик не проводит электрический
ток. При повышении температуры
диэлектрика, электроны валентной зоны
начинают взаимодействовать с колебаниями
кристаллической решетки и получают от
нее энергию ~ KT, но некоторые электроны
получают значительно большую энергию.
Процесс передачи энергии электронам
– статистический. Тем неменее, число
электронов, которые получают от решетки
энергию
![]() ничтожно
мало. Значит, будет ничтожно мало число
электронов, которые способны перейти
за счет тепловых переходов из валентной
зоны в зону проводимости. Таким образом,
твердое тело с большой шириной запрещенной
зоны плохо проводит электрический ток,
их проводимость примерно равна
ничтожно
мало. Значит, будет ничтожно мало число
электронов, которые способны перейти
за счет тепловых переходов из валентной
зоны в зону проводимости. Таким образом,
твердое тело с большой шириной запрещенной
зоны плохо проводит электрический ток,
их проводимость примерно равна
![]() ,
в лучшем случае электропроводность
может быть активирована высокой
температурой. Исходя из зонной схемы
диэлектрика, можно сказать, что валентная
зона и зона проводимости не перекрываются.
,
в лучшем случае электропроводность
может быть активирована высокой
температурой. Исходя из зонной схемы
диэлектрика, можно сказать, что валентная
зона и зона проводимости не перекрываются.
Если
у твердого тела при T = 0 K0
самая верхняя зона полностью заполнена,
а следующая за ней зона проводимости
пустая и отделена от предыдущей зоны
не широким промежутком запрещенных
энергий
![]() ,
то твердое тело называется полупроводником.
Как видно принципиальной разницы между
диэлектриком и полупроводником нет.
При достаточно высоких температурах
у полупроводников могут иметь место
тепловые переходы из валентной зоны в
зону проводимости за счет взаимодействия
валентных электронов с ионами
кристаллической решетки. Электроны,
перешедшие из валентной зоны в зону
проводимости, могут участвовать в
переносе электрического тока. Появившиеся
свободные уровни в валентной зоне
(вакансии) будут также участвовать в
переносе электрического тока. Носителями
тока в валентной зоне являются дырки.
Таким образом, проводимость полупроводника
является активированной. При T = 0 K0
полупроводники как и диэлектрики не
проводят электрический ток. Чем меньше
,
то твердое тело называется полупроводником.
Как видно принципиальной разницы между
диэлектриком и полупроводником нет.
При достаточно высоких температурах
у полупроводников могут иметь место
тепловые переходы из валентной зоны в
зону проводимости за счет взаимодействия
валентных электронов с ионами
кристаллической решетки. Электроны,
перешедшие из валентной зоны в зону
проводимости, могут участвовать в
переносе электрического тока. Появившиеся
свободные уровни в валентной зоне
(вакансии) будут также участвовать в
переносе электрического тока. Носителями
тока в валентной зоне являются дырки.
Таким образом, проводимость полупроводника
является активированной. При T = 0 K0
полупроводники как и диэлектрики не
проводят электрический ток. Чем меньше
![]() ,
тем выше при прочих равных условиях
электропроводность полупроводника.
Электропроводность полупроводника
лежит в широком диапазоне значений:
,
тем выше при прочих равных условиях
электропроводность полупроводника.
Электропроводность полупроводника
лежит в широком диапазоне значений:
![]() .
.
