
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9 Соотношение неопределённостей Гейзенберга
- •Вопрос 10 .Волновая функция и ее статистический смысл
- •Вопрос 11 Стационарное уравнение Шрёдингера
- •Вопрос 12
- •Вопрос 14 Прохождение частицы сквозь потенциальный барьер, туннельный эффект
- •Вопрос 15 Квантовый гармонический осциллятор
- •Вопрос 16 Решение уравнения Шрёдингера
- •Вопрос 17 Квантование энергии электрона в атоме
- •Линейчатый спектр атома водорода
- •1. Орбитальный механический момент импульса электрона
- •Вопрос 19
- •Вопрос 20
- •Структура периодической системы
- •Значение периодической системы
- •Вопрос 21 Поглощение, спонтанное и вынужденное излучения
- •Эйнштейна коэффициенты
- •Вопрос 22
- •Принцип действия лазера
- •Вопрос 23
- •1. Классическая теория теплоёмкости. Модель независимых осцилляторов
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •§ 77. Периодическая система элементов Менделеева
- •Вопрос 29
- •Вопрос 30
- •13.Температурная зависимость электропроводимости п/п-ов.
- •Вопрос 32
- •Масса и энергия связи ядра
- •Вопрос 33
- •Гамма-лучи
- •Бета-лучи
- •Альфа-частицы
- •Законы сохранения в ядерных реакциях
- •Закон сохранения энергии
- •Закон сохранения импульса
- •Закон сохранения момента импульса
- •Другие законы сохранения
- •Вопрос 35
- •Вопрос 36
Вопрос 16 Решение уравнения Шрёдингера
Решение уравнения Шрёдингера для водородного атома использует факт, что кулоновский потенциал является изотропным, то есть не зависит от направления в пространстве, другими словами, обладает сферической симметрией. Хотя конечные волновые функции (орбитали) не обязательно сферически симметричны, их зависимость от угловой координаты следуют полностью из изотропии основного потенциала: собственные значения оператора Гамильтона можно выбрать в виде собственных состояний оператора углового момента. Это соответствует тому факту, что угловой момент сохраняется при орбитальном движении электрона вокруг ядра. Отсюда следует, что собственные состояния гамильтониана задаются двумя квантовыми числами углового момента l и m (целые числа). Квантовое число углового момента l может принимать значения 0, 1, 2… и определяет величину углового момента. Магнитное квантовое число может принимать m = −l, …, +l; оно определяет проекцию углового момента на (произвольно выбранную) ось z.
В дополнение к математическим выражениям для волновых функций полного углового момента и проекции углового момента, нужно найти выражение для радиальной зависимости волновой функции. В потенциале 1/r радиальные волновые функции записываются с использованием полиномов Лагерра). Это приводит к третьему квантовому числу, которое называется основным квантовым числом n и может принимать значения 1, 2, 3… Основное квантовое число в атоме водорода связано с полной энергией атома. Заметим, что максимальное значение квантового числа углового момента ограничено основным квантовым числом: оно может изменяться только до n − 1, то есть l = 0, 1, …, n−1.
Из-за сохранения углового момента состояния с одинаковыми l, но различными m в отсутствие магнитного поля имеют одну и ту же энергию (это выполняется для всех задач с аксиальной симметрией). Кроме того, для водородного атома состояния с одинаковыми n, но разными l также вырождены (то есть имеют одинаковую энергию). Однако это свойство — особенность лишь атома водорода (и водородоподобных атомов), оно не выполняется для более сложных атомов, которые имеют (эффективный) потенциал, отличающийся от кулоновского (из-за присутствия внутренних электронов, экранирующих потенциал ядра).
Если
мы примем во внимание спин
электрона, то появится последнее,
четвёртое квантовое число, определяющее
состояния атома водорода — проекция
углового момента собственного вращения
электрона на ось Z.
Эта проекция может принимать два
значения. Любое собственное состояние
электрона в водородном атоме полностью
описывается четырьмя квантовыми
числами. Согласно обычным правилам
квантовой механики, фактическое
состояние электрона может быть любой
суперпозицией
этих состояний. Это объясняет также,
почему выбор оси Z
для квантования
направления вектора углового момента
является несущественным: орбиталь для
данных l
и
![]() полученных
для другой выделенной оси
полученных
для другой выделенной оси
![]() всегда
представляется как подходящая
суперпозиция различных состояний с
разными m
(но тем же самым l),
которые были получены для Z.
всегда
представляется как подходящая
суперпозиция различных состояний с
разными m
(но тем же самым l),
которые были получены для Z.
Рассмотрим
сейчас решение уравнения Шрёдингера
для атома водорода. Так как потенциальная
функция электрона в атоме водорода
имеет вид
![]() где
e —
заряд электрона (и протона), r —
радиус-вектор,
то уравнение
Шрёдингера
запишется следующим образом:
где
e —
заряд электрона (и протона), r —
радиус-вектор,
то уравнение
Шрёдингера
запишется следующим образом:
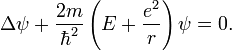
Здесь
ψ —
волновая
функция
электрона в системе отсчёта протона,
m —
масса электрона,
![]() —
постоянная
Планка,
E —
полная энергия электрона,
—
постоянная
Планка,
E —
полная энергия электрона,
![]() —
оператор
Лапласа.
Так как потенциальная функция зависит
от r,
а не от координат по отдельности, удобно
будет записать лапласиан в сферической
системе координат
—
оператор
Лапласа.
Так как потенциальная функция зависит
от r,
а не от координат по отдельности, удобно
будет записать лапласиан в сферической
системе координат
![]() В
ней он выглядит следующим образом:
В
ней он выглядит следующим образом:
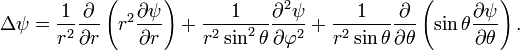
Уравнение Шрёдингера в сферических координатах:
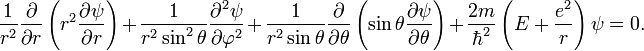
В
этом уравнении
—
функция трёх переменных
Разделим
его на три более простых уравнения. Для
этого представим функцию
![]() как
произведение трех функций:
как
произведение трех функций:
![]() Эти
функции будем обозначать просто
Эти
функции будем обозначать просто
![]() Тогда
Тогда
![]()
После подстановки значений частных производных в уравнение Шрёдингера получим:
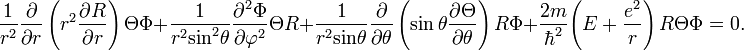
Умножим
уравнение на
![]()
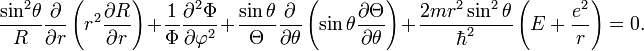
Второе слагаемое тут зависит только от φ. Перенесём его в правую часть равенства.
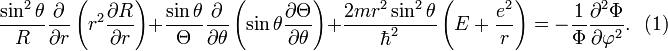
Равенство
возможно, когда обе части равны какой-то
постоянной величине. Обозначим её
![]() Следовательно,
Следовательно,
![]()
Решением этого уравнения являются функции
![]()
Угол
φ
может изменяться от 0 до 2π.
Функция
![]() должна
быть периодической с периодом 2π.
Это возможно, только если
должна
быть периодической с периодом 2π.
Это возможно, только если
![]() Таким
образом, из решения уравнения Шрёдингера
получаем значение одного из квантовых
чисел (конечно, из него можно получить
их все). Число
Таким
образом, из решения уравнения Шрёдингера
получаем значение одного из квантовых
чисел (конечно, из него можно получить
их все). Число
![]() называется
магнитным
квантовым числом.
называется
магнитным
квантовым числом.
Далее,
интегрируя квадрат модуля функции
от
0 до 2π
и приравнивая полученное выражение к
единице, получим, что
![]()
Далее
рассмотрим левую часть уравнения (1).
Она, конечно, равна
![]()
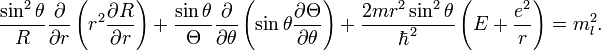
Разделим
уравнение на
![]()
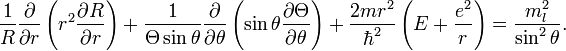
После
аналогичного вышеуказанному перенесению
второго слагаемого в правую часть и
обозначения величины, которой равны
эти части, через
![]() получаем
получаем
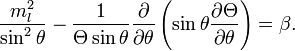
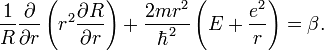
Решение этих двух последних уравнений приводит к значениям l и n соответственно. Три квантовых числа в совокупности полностью описывают состояния электрона в атоме водорода.
Модуль
полной энергии электрона в стационарном
состоянии в атоме водорода обратно
пропорционален
![]() Число
n
называется главным
квантовым числом.
Оно может иметь значения от 1 до
Число
n
называется главным
квантовым числом.
Оно может иметь значения от 1 до
![]() Его
связь с энергией см. ниже.
Его
связь с энергией см. ниже.
Число l называется азимутальным квантовым числом и определяет орбитальный момент количества движения электрона и форму электронного облака; может иметь значения от 0 до n − 1 (n здесь относится к энергетическом уровню, на котором находится рассматриваемый электрон).
Магнитное
квантовое число
определяет
проекцию орбитального момента количества
движения на выбранную ось в магнитном
поле. Эта проекция равна
![]()
Квантовые числа – целые или дробные числа, определяющие возможные значения физических величин, характеризующих квантовую систему (молекулу, атом, атомное ядро, элементарную частицу). Квантовые числа отражают дискретность (квантованность) физических величин, характеризующих микросистему. Набор квантовых чисел, исчерпывающе описывающих микросистему, называют полным. Так состояние электрона в атоме водорода определяется четырьмя квантовыми числами: главным квантовым числом n (может принимать значения 1, 2, 3, …), определяющим энергию Еn электрона (Еn = -13.6/n2 эВ); орбитальным квантовым числом l = 0, 1, 2, …, n – 1, определяющим величину L орбитального момента количества движения электрона (L = ћ[l(l + 1)]1/2); магнитным квантовым числом m < ± l , определяющим направление вектора орбитального момента; и квантовым числом ms = ± 1/2, определяющим направление вектора спина электрона.
Основные квантовые числа
n |
Главное
квантовое число: n = 1, 2, …
|
j |
Квантовое
число полного углового момента. j
никогда не бывает
отрицательным
и может быть целым (включая ноль) или
полуцелым
в зависимости от свойств
рассматриваемой системы. Величина
полного углового
момента J связана
с j соотношением
J2 = ћ2j(j + 1).
|
l |
Квантовое число орбитального углового момента l может принимать только целые значения: l = 0, 1, 2, … ∞. Величина орбитального углового L момента связана с l соотношением L2 = ћ2l(l + 1). |
m |
Магнитное квантовое число. Проекция полного, орбитального или спинового углового момента на выделенную ось (обычно ось z) равна mћ. Для полного момента mj = j, j-1, j-2, …, - (j-1), - j. Для орбитального момента ml = l, l-1, l-2, …, -(l-1), -l. Для спинового момента электрона, протона, нейтрона, кварка ms = ±1/2 |
s |
Квантовое число спинового углового момента s может быть либо целым, либо полуцелым. s - неизменная характеристика частицы, определяемая ее свойствами. Величина спинового момента S связана с s соотношением S2 = ћ2s(s + 1). |
P |
Пространственная четность. Она равна либо +1, либо -1 и характеризует поведение системы при зеркальном отражении. P = (-1)l. |
Существование сохраняющихся (неизменных во времени) физических величин для данной системы тесно связано со свойствами симметрии этой системы. Так, если изолированная система не изменяется при произвольных поворотах, то у неё сохраняется орбитальный момент количества движения. Это имеет место для атома водорода, в котором электрон движется в сферически симметричном кулоновском потенциале ядра и поэтому характеризуется неизменным квантовым числом l. Внешнее возмущение может нарушать симметрию системы, что приводит к изменению самих квантовых чисел. Фотон, поглощенный атомом водорода, может “перебросить” электрон на другую орбиту с другими значениями квантовых чисел. Помимо квантовых чисел, отражающих пространственно-временную симметрию микросистемы, существенную роль у частиц играют так называемые внутренние квантовые числа. Ряд из них, такие как спин и электрический заряд, сохраняются во всех взаимодействиях, другие в некоторых взаимодействиях не сохраняются. Так кварковое квантовое число странность, сохраняющееся в сильном взаимодействии, не сохраняется в слабом взаимодействии, что отражает разную природу этих взаимодействий. Внутренним квантовым числом для кварков и глюонов является также цвет. Цвет кварков может принимать три значения, цвет глюонов – восемь.
