
- •1.Механическое движение
- •2. Линейная скорость
- •3.Линейное ускорение
- •4. Угловая скорость и ускорение
- •5. Связь между линейными и угловыми .
- •6. Основные понятия и величины динамики
- •8. Закон сохранения импульса
- •9. Закон всемирного тяготения
- •10. Вращающий момент и момент инерции
- •11. Основное уравнение динамики вращательного движения
- •12. Кинетическая и потенциальная энергия
- •13. Работа переменной силы. Мощность.
- •14. Упругая деформация . Закон Гука. Сила трения.
- •16. Механические волны. Уравнение плоской бегущей волны.
- •17. Звуковые волны
- •18. Термодинамические параметры
- •19. Уравнение состояния газов
- •20. Изопроцессы
- •21. Основное уравнение молекулярнокинетической теории газов
- •23. Степени свободы молекул. Работа расширения газа.
- •24. Теплоемкость
- •25. Принцип действия тепловых и холодильных машин
- •26. Второй и третий закон термодинамики
- •27. Диффузия. Коэффициент диффузии.
- •28. Теплопроводность. Коэффициент теплопроводности.
- •29. Вязкость. Коэффициент вязкости.
- •30. Понятие фазы и структуры. Газообразное состояние вещества.
- •31. Жидкое состояние веществ
- •32. Поверхностное натяжение жидкости
- •33. Явление смачивания
- •34. Капиллярные явления
- •35. Твердые тела
- •36. Кристаллическое состояние веществ
- •37. Изменение агрегатного состояния веществ
- •38. Закон сохранения заряда
- •39. Взаимодействие зарядов. Закон Кулона
- •40. Электростатическое поле и напряженность
- •41. Принцип суперпозиции электростатического поля.
- •42. Разность потенциалов и напряжения
- •43. Проводники и диэлектрики в электрическом поле.
- •44. Диэлектрики. И их основные виды.
- •45. Поляризация диэлектриков
- •46. Диэлектрическая восприимчивость и диэлектрическая проницаемость.
- •47. Сегнетоэлектрики, пьезоэлектрики, пироэлектрики.
- •48. Электроемкость проводников.
- •49. Конденсаторы. Виды конденсаторов.
- •51. Постоянный электрический ток и ток проводимости.
- •52. Источник тока. Электродвижущая сила.
- •53. Закон Ома в интегральной форме.
- •55. Последовательное и // соединение проводников.
- •57. Закон Джоуля-Ленца в интегральной форме.
- •59. Основы теории проводимости метпллов.
- •60. Зависимость сопротивления металлов от t°
- •61. Работа выхода. Контактная разность потенциалов.
- •62. Электронная эмиссия. Виды эмиссии.
- •63. Термоэлектрические явления.
- •64. Электрический ток в жидкостях
- •65. Электрический ток в газах
- •66. Напряжение пробоя. Виды самостоятельного разряда в газах.
- •68. Полупроводники. Собственные и примесные полупроводники.
- •69. Зависимость проводимости полупроводников от t°
- •70. Магнитная индукция. Закон Ампера.
- •71. Контур с током. Направление и магнитный момент поля.
- •72. Напряженность магнитного поля
- •73. Поток вектора магнитной индукции
- •74. Движение z в магнитном поле и сила Лоренца
- •75. Эффект Холла
- •76. Явление электромагнитной индукции. Индукционный ток.
- •77. Применение электромагнитной индукции
- •78. Самоиндукция и взаимоиндукция
- •80. Типы магнетиков. Диамагнетики, парамагнетики.
- •81. Ферромагнетики и их магнитные характеристики.
- •82. Электромагнитное поле. Электромагнитные волны.
- •83. Генерация электромагнитных волн.
- •84. Электромагнитная природа света. Тепловое излучение и люминесценция.
- •85. Отражение и преломление света.
- •86. Поляризация света. Получение поляризованного света.
- •87. Поляризация света при отражении и преломлении.
- •88. Явление двулучепреломления
- •89. Вращение плоскости поляризации.
- •90. Дисперсия света
- •91. Спектральный анализ.
- •92. Тонкие линзы.
- •93. Оптические приборы.
- •94. Основные фотометрические величины.
- •95. Интерференция света.
- •96. Дифракция света.
- •97. Дифракционная решетка.
- •98. Поглощение и рассеяние света.
- •99. Тепловое излучение. Закон Стефана – Больцмана.
- •100. Фотоэлектронный эффект. Закон внешнего фотоэффекта.
- •101. Уравнение Эйнштейна для внешнего фотоэффекта.
- •102. Строение атома. Постулаты Бора.
- •103. Рентгеновские лучи. Тормозное и характеристическое рентгеновское излучение.
- •104. Дифракция рентгеновского излучения.
36. Кристаллическое состояние веществ
Кристаллы – твердые тела, которые ограничены гранями, которые пересекаются под определенными углами. Состоят их довольно маленьких произвольно ориентированных кристалликов.
Типы:
Атомные
Молекулярные
Ионные
Металлические
Атомные – формируются из атомов, связанных между собой ковалентными неполярными связями (алмаз).
Молекулярные – состоят из молекул, которые объединяются в группы за счет электростатических, Ван-дер-Ваальсовых и др. взаимодействий (органические соединения).
Ионные – решетки состоят из разноименно заряженных ионов, которые удерживаются в структуре за счет электростатического притяжения (оксиды, соли…).
Металлические – решетки образуются в том случае, если атомы сильно сближаются, что приводит к перекрытию внешних электронных оболочек.
Структуру кристалла принято изображать в виде решетки, в которой находятся те или иные структурные единицы. Каждая решетка характеризуется определенными постоянными. Это расстояние между центрами структурных единиц вдоль направлений характеристических осей.
Решетки классифицируют по геометрической закономерности расположения структурных единиц в пространстве, а также по наличию тех или иных элементов симметрии. Все кристаллические решетки делят на 7 типов (сингонии): кубическая, тетрагональная, гексагональная, тригональная, ромбическая, моноклинная, триклинная. Ячейки отличают не только сингониями, но возможным расположением атомов в узлах, по граням и в объеме решетки.
В случае соединений сложного состава общая структура образуется сочетанием решеток, сформированных отдельными элементами (NaCl).
37. Изменение агрегатного состояния веществ
Большинство химических соединений могут существовать в трех фазовых состояниях, которые совпадают с агрегатными состояниями.
Переходы вещества из одного состояния в другое сопровождается поглощением или выделением энергии, а также изменением объема – фазовые переходы первого рода.
Фазовые переходы второго рода – не сопровождаются изменением агрегатного состояния, характерны для твердых кристаллических веществ (алмаз-графит).
Переход вещества из одного состояния в другое сопровождается усилением связи между атомами, уменьшением поступательного , вращательного, колебательного движения атомов, а избыток этой энергии выделяется в виде теплоты. При плавлении все наоборот.
В случае кристаллической жидкости в начале образуются микроскопические кристаллики, потом постепенно растут за счет присоединения к их поверхности атомов. Существуют переходы из твердого состояния в газообразное, минуя жидкое. В случае фазовых переходов 2-го рода t°, при которой они происходят – точка Кюри.
38. Закон сохранения заряда
Заряды: положительные, отрицательные. Под действием внешних сил атомы могут терять или приобретать электроны, при этом превращаются в положительно или отрицательно заряженные ионы. Заряды могут существовать в виде электронов, либо в виде ионов.
При рассмотрении электронных свойств, наименьшим зарядом считают заряд, равный +/- 1,6 10-19 Кл.
Любое
тело можно зарядить любым количеством
заряда, причем в процессе заряжения ,
заряд тела будет меняться дискретно
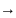 Q=+/-
n
1,6
10-19
Кл.
Q=+/-
n
1,6
10-19
Кл.
Заряды разных знаков компенсируют друг друга. Тело с нулевым зарядом просто содержит одинаковое количество отрицательных и положительных зарядов.
1-ая версия закона: заряды не создаются и не исчезают, но могут передаваться от одного тела к другому, либо перемещаться внутри тела.
2-ая версия: в изолированной системе ∑ зарядов с течением времени остается неизменной.
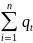 =
const
=
const
