
- •1.Механическое движение
- •2. Линейная скорость
- •3.Линейное ускорение
- •4. Угловая скорость и ускорение
- •5. Связь между линейными и угловыми .
- •6. Основные понятия и величины динамики
- •8. Закон сохранения импульса
- •9. Закон всемирного тяготения
- •10. Вращающий момент и момент инерции
- •11. Основное уравнение динамики вращательного движения
- •12. Кинетическая и потенциальная энергия
- •13. Работа переменной силы. Мощность.
- •14. Упругая деформация . Закон Гука. Сила трения.
- •16. Механические волны. Уравнение плоской бегущей волны.
- •17. Звуковые волны
- •18. Термодинамические параметры
- •19. Уравнение состояния газов
- •20. Изопроцессы
- •21. Основное уравнение молекулярнокинетической теории газов
- •23. Степени свободы молекул. Работа расширения газа.
- •24. Теплоемкость
- •25. Принцип действия тепловых и холодильных машин
- •26. Второй и третий закон термодинамики
- •27. Диффузия. Коэффициент диффузии.
- •28. Теплопроводность. Коэффициент теплопроводности.
- •29. Вязкость. Коэффициент вязкости.
- •30. Понятие фазы и структуры. Газообразное состояние вещества.
- •31. Жидкое состояние веществ
- •32. Поверхностное натяжение жидкости
- •33. Явление смачивания
- •34. Капиллярные явления
- •35. Твердые тела
- •36. Кристаллическое состояние веществ
- •37. Изменение агрегатного состояния веществ
- •38. Закон сохранения заряда
- •39. Взаимодействие зарядов. Закон Кулона
- •40. Электростатическое поле и напряженность
- •41. Принцип суперпозиции электростатического поля.
- •42. Разность потенциалов и напряжения
- •43. Проводники и диэлектрики в электрическом поле.
- •44. Диэлектрики. И их основные виды.
- •45. Поляризация диэлектриков
- •46. Диэлектрическая восприимчивость и диэлектрическая проницаемость.
- •47. Сегнетоэлектрики, пьезоэлектрики, пироэлектрики.
- •48. Электроемкость проводников.
- •49. Конденсаторы. Виды конденсаторов.
- •51. Постоянный электрический ток и ток проводимости.
- •52. Источник тока. Электродвижущая сила.
- •53. Закон Ома в интегральной форме.
- •55. Последовательное и // соединение проводников.
- •57. Закон Джоуля-Ленца в интегральной форме.
- •59. Основы теории проводимости метпллов.
- •60. Зависимость сопротивления металлов от t°
- •61. Работа выхода. Контактная разность потенциалов.
- •62. Электронная эмиссия. Виды эмиссии.
- •63. Термоэлектрические явления.
- •64. Электрический ток в жидкостях
- •65. Электрический ток в газах
- •66. Напряжение пробоя. Виды самостоятельного разряда в газах.
- •68. Полупроводники. Собственные и примесные полупроводники.
- •69. Зависимость проводимости полупроводников от t°
- •70. Магнитная индукция. Закон Ампера.
- •71. Контур с током. Направление и магнитный момент поля.
- •72. Напряженность магнитного поля
- •73. Поток вектора магнитной индукции
- •74. Движение z в магнитном поле и сила Лоренца
- •75. Эффект Холла
- •76. Явление электромагнитной индукции. Индукционный ток.
- •77. Применение электромагнитной индукции
- •78. Самоиндукция и взаимоиндукция
- •80. Типы магнетиков. Диамагнетики, парамагнетики.
- •81. Ферромагнетики и их магнитные характеристики.
- •82. Электромагнитное поле. Электромагнитные волны.
- •83. Генерация электромагнитных волн.
- •84. Электромагнитная природа света. Тепловое излучение и люминесценция.
- •85. Отражение и преломление света.
- •86. Поляризация света. Получение поляризованного света.
- •87. Поляризация света при отражении и преломлении.
- •88. Явление двулучепреломления
- •89. Вращение плоскости поляризации.
- •90. Дисперсия света
- •91. Спектральный анализ.
- •92. Тонкие линзы.
- •93. Оптические приборы.
- •94. Основные фотометрические величины.
- •95. Интерференция света.
- •96. Дифракция света.
- •97. Дифракционная решетка.
- •98. Поглощение и рассеяние света.
- •99. Тепловое излучение. Закон Стефана – Больцмана.
- •100. Фотоэлектронный эффект. Закон внешнего фотоэффекта.
- •101. Уравнение Эйнштейна для внешнего фотоэффекта.
- •102. Строение атома. Постулаты Бора.
- •103. Рентгеновские лучи. Тормозное и характеристическое рентгеновское излучение.
- •104. Дифракция рентгеновского излучения.
21. Основное уравнение молекулярнокинетической теории газов
Это
уравнение определяет давление газа
через количество молекул в V,
m
молекул и их среднюю квадратичную
скорость движения: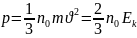
Абсолютная
t°
пропорциональна средней квадратичной
энергии поступательного движения
молекул. Зависимость средней кинетической
энергии молекул от t°:
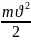 =
=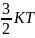 ,
K-
постоянная Боульмана (показывает какую
энергию необходимо сообщить одной
частице, чтобы ее t°
увеличилась на 1° Кельвина).
,
K-
постоянная Боульмана (показывает какую
энергию необходимо сообщить одной
частице, чтобы ее t°
увеличилась на 1° Кельвина).
Давление газа пропорционально концентрации по абсолютной t°:
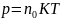
22. 1-й закон термодинамики
Закон сохранения энергии – энергия любой изолированной системы остается неизменной; работа, совершенная системой и переданная ей теплота в сумме равны внутренней энергии системы.
Теплота, переданная системе в процессе изменения ее состояния, расходуется на изменение внутренней энергии и на совершение работы против внешних сил: dQ = dU+dA (Q – теплота; U – внутренняя энергия; А – работа).
При изохорическом процессе V = 0, т.е. газ не совершает внешней работы и вся теплота расходуется на увеличение внутренней энергии.
При изобарическом процессе p=const; энергия, передаваемая газу, тратится как на увеличение внутренней энергии, так и на совершение внешней работы.
При изотермическом процессе изменение внутренней энергии = 0 и вся теплота тратится на работу.
Адиабатическое сжатие газа соответствует отрицательной внешней работе и увеличению внутренней энергии, т. е. газ нагревается.
23. Степени свободы молекул. Работа расширения газа.
Молекулы – системы материальных точек, которые совершают поступательные, вращательные и колебательные движения.
Число независимых координат, которые полностью определяют положение тела в пространстве – число степеней свободы.
При движении точки в одной плоскости по прямой линии необходимо знать 1 координату, т.е. точка имеет 1 степень свободы. Если точка движется в плоскости произвольно ее положение определяют 2 координатами…
Положение точки в пространстве определяют 3 координатами, одноатомные молекулы обладают числом степеней свободы, равное 3. Для двухатомной молекулы к 3 координатам добавляется вращение вокруг 2 осей, и число степеней свободы = 5.
Закон распределения энергии: статически, в среднем на каждую степень свободы приходится одинаковая энергия, равная ½ КТ, таким образом средняя кинетическая энергия любой молекулы: Ек = ½ КТi = i/2 КТ
Работа расширения газа
Если система расширяется, V увеличивается и внешняя работа считается положительной, т. е. тело совершает работу против внешних сил, а если система/тело сжимаются, то внешние силы совершают работу над ними и работа отрицательна.
При изохорическом процессе V = const и внешняя работа = 0.
При изобарическом процессе работа определяется: A = p(V2-V1)
При изотермическом процессе:
A
=
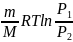
24. Теплоемкость
Связана с процессами нагрева и охлаждения веществ. Бывает молярная и удельная.
Теплота, переданная телу:
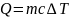 ,
,
 - увеличение t°,
c
– удельная теплоемкость.
- увеличение t°,
c
– удельная теплоемкость.
Удельная теплоемкость – величина, численно равная теплоте, которую необходимо сообщить единице массы тела для увеличения t° на 1° Кельвина.
Молярная теплоемкость – количество теплоты, которую необходимо затратить на нагревание 1 моля на 1° Кельвина.
C
=
 ,
(C
– молярная теплоемкость)
,
(C
– молярная теплоемкость)
Для идеальных газов C зависит от вида процесса:
Изобарический: Ср = R(
 +1)
+1)Изохорический: Cv =
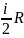
Изохорический наиболее энергетически выгоден.
