- •Внутрикомплексные соединения
- •Ионная сила раствора
- •Перманганатометрия
- •Хроматометрия
- •Иодометрия
- •Кислотно-основное титрование
- •Электродный потенциал.
- •Кулонометрическая генерация титранта
- •32. Потенциометрия. Разновидности метода. Типы электродов в потенциометрии.
- •33. Потенциометрическое титрование. Способы определения конечной точки титрования.
- •34. Амперометрическое титрование. Кривые титрования.
- •35. Атомно-эмиссионный анализ. Источники атомизации и возбуждения. Качественный и количественный анализ. Уравнение Ломакина-Шайбе.
- •37. Метод молекулярной абсорбционной спектроскопии (фотоколориметрия)
- •38. Электрохимические методы анализа. Общая характеристика и классификация электрохимических методов.
- •40. Прямая потенциометрия. Уравнение Нернста. Индикаторные электроды. Ионометрия : определение pH, ионов щелочных металлов, галогенид-ионов.
Электродный потенциал.
Основные электрические параметры электрохимических ячеек – сила тока (ее измеряют в амперах, A) и потенциал (измеряемый в вольтах, В). Сила тока определяется скоростью электродных реакций, а потенциал – химической энергией протекающих в ячейке процессов. Он равен энергии (измеряемой в джоулях, Дж), отнесенной к количеству электричества (измеряемому в кулонах, Кл), т.е. 1 В = 1 Дж/Кл. Следовательно, потенциал элемента (электродвижущая сила, ЭДС) – это мера энергии, вырабатываемой в ходе протекающих в нем реакций. Если внешняя цепь разомкнута, то никакие электродные реакции не идут.
Потенциал гальванического элемента при разомкнутой внешней цепи дает информацию о термодинамике его реакций. Потенциал элемента, представленного на рис. 1, при концентрациях растворов 1 М и температуре 25 С – его стандартный потенциал E – равен 1,10 В. Соответствующая ему энергия, термодинамический потенциал Гиббса, G, определяется выражением
![]()
где n – число электронов, переносимых в ходе реакции (в данном случае 2), F – число Фарадея (96 485 Кл/моль). Потенциал гальванического элемента равен разности потенциалов двух его полуэлементов, т.е. разности его электродных потенциалов. Электродные потенциалы измеряют относительно потенциала электрода сравнения, который условно принимается за нуль (см. таблицу). По соглашению в качестве стандартного электрода выбран нормальный водородный электрод (н.в.э.); он представляет собой платиновую пластинку, которая покрыта платиновой чернью, насыщенной газообразным водородом при давлении 1,01105 Па (1 атм.), и погружена в раствор, содержащий ионы H+ с термодинамической активностью a = 1. Схематически этот электрод можно представить в виде Pt/H2 (1,01105 Па)/H+(a = 1). На нем протекает реакция 2H+ + 2e– H2. Для определения стандартного потенциала медного электрода Cu/Cu2+ собирают следующий гальванический элемент:
![]()
и для полуреакции Cu2+ + 2e– Cu измерение дает
![]()
Аналогично для полуэлемента Zn/Zn2+, в котором протекает реакция Zn2+ + 2e– Zn, получают
![]()
Разность этих двух стандартных электродных потенциалов равна стандартному потенциалу элемента Zn–Cu.
На самом деле водородный электрод редко используют при потенциометрических измерениях, поскольку он представляет собой некую идеальную систему, трудно реализуемую на практике. Гораздо чаще применяют более удобные в работе и компактные электроды сравнения различных типов, имеющие определенное, тщательно измеренное значение потенциала относительно н.в.э. Обычно пользуются каломельным электродом (к.э.), состоящим из металлической ртути, хлорида ртути (каломели) и раствора хлорида калия: Hg /Hg2Cl2 /KCl. На электроде протекает следующая реакция:
![]()
Потенциал к.э. зависит от концентрации ионов ртути, а последняя – от концентрации раствора KCl. Для насыщенного раствора KCl E (к.э.)ср = 0,2412 В (н.в.э) при 25 С.
Таблица undefined
Отметим, что вещество некоторых электродов не входит в уравнение соответствующей реакции. Так, реакция
![]()
на самом деле протекает на платиновом электроде в ячейке Pt/Fe3+, Fe2+. Платиновый электрод инертен и лишь обеспечивает контакт с электролитом, содержащим окисленную и восстановленную формы элемента (в данном случае ионы двух- и трехвалентного железа). Такую же роль играет платиновый электрод в н.в.э.
Таблицы электродных потенциалов позволяют рассчитать ЭДС гальванического элемента исходя из его электродных потенциалов. С их помощью можно также предсказать, будет ли протекать та или иная окислительно-восстановительная реакция. О стандартном электродном потенциале можно говорить лишь в том случае, когда активность компонентов – участников реакции равна 1, т.е. их концентрация в растворе близка к 1М. Электродный потенциал Е зависит от концентрации окисленной и восстановленной форм в растворе и связан с ними и стандартным потенциалом E уравнением Нернста. Для обобщенной реакции
ox + ne– = red
это уравнение имеет вид
![]()
где R – универсальная газовая постоянная, T – абсолютная температура, [ox] и [red] – активности окисленной и восстановленной форм. Активности чистых твердых веществ и жидкостей считаются равными 1. При 25 C RT/F = 0,025 В. Измеряя электродные потенциалы относительно потенциала электрода сравнения, можно с помощью уравнения (10) определять концентрации веществ в растворе; этот метод называется потенциометрией.
26. медный и серебряный кулонометры. Определение количества электричества
|
Титрационный кулонометр В. А. Кистяковского. |
Серебряный кулонометр состоит из платинового тигля, служащего одновременно емкостью для электролита и катодом. Тигель помещают на металлическую подставку, служащую токоподводом к нему. Серебряный анод помещают в по-ристый фарфоровый тигель, служащий пористой диафрагмой, предохраняющей катод от попадания на него мелких частичек серебра, которые могут осыпаться с анода. Электролитом в серебряном кулонометре служит 10 - 20 % - ный раствор азотнокислого серебра. [1]
|
Медный кулонометр. |
Серебряный кулонометр состоит из платинового тигля, служащего одновременно емкостью для электролита и катодом. Тигель помещают на металлическую подставку, являющуюся токоподводом к нему. [2]
Работа серебряного кулонометра основана на осаждении металлического серебра на платиновом катоде из раствора азотнокислого серебра. [3]
|
Конструкции электрохимических кулонометров. |
Преимущество серебряного кулонометра перед медным состоит в том, что серебро имеет в три раза больший электрохимический эквивалент и не окисляется на воздухе. Недостатком является рыхлость осадка серебра, который легко осыпается при неаккуратном промывании, а иногда дает слишком высокие результаты, что объясняется осаждением серебряной пыли и включениями маточного ра-створа. [4]
Действие серебряного кулонометра Ричардса, представляющего собой электрохимическую систему ( -) Ag AgNOs ( aq) Ag (), основано на взвешивании массы серебра, осевшей на катоде во время электролиза. [5]
|
Электрохимический датчик давления.| Электрохимический интегратор. |
В серебряном кулонометре в качестве электролита применяется 10 % - ный нейтральный раствор нитрата серебра. [6]
В серебряном кулонометре с платиновым катодом и серебряным анодом в качестве раствора электролита используют раствор соли серебра, например нитрата серебра. При прохождении через кулонометр тока серебро выделяется на катоде. Серебряный анод электрорастворяясь, постепенно пополняет убыль серебра ( I) из раствора электролита. [7]
В серебряном кулонометре обычного типа используется реакция осаждения металлического серебра на инертном катоде ( рис. С. Этот кулонометр состоит из стеклянного пористого тигля А с пористостью № 3, который опирается на стеклянную рамку В так, что раствор свободно проходит через пористый диск. Катод сделан из платиновой фольги ( поверхность 1 см2), к которой припаяна платиновая проволочка, анод представляет собой спираль из толстой серебряной проволоки. Перед проведением эксперимента электроды и тигель очищают и промывают. Катод и тигель высушивают в термостате при температуре 150 С до постоянного веса. [8]
С помощью серебряного кулонометра они точно определяют количество электричества, необходимое для проведения электролиза титрованного раствора. [9]
Раствор из серебряного кулонометра выливают в мерную колбочку емкостью 100 мл ( не взвешенную), следя за тем, чтобы граница слоя кислоты приблизилась к серебру электрода, но не достигла его, и, доведя объем раствора в мерной колбе до 100 мл, титруют несколько проб. [10]
|
Серебряный кулоно-метр.| Йодный кулонометр. К - катод платино-иридиевые. |
Наиболее точным прибором считается серебряный кулонометр ( рис. 69), в котором по весу чистого серебра, выделяющегося из водного раствора AgNO3 за время электролиза, рассчитывают количество электричества. [1]
В течение того же времени в серебряном кулонометре, включенном последовательно в цепь и содержащем раствор AgNO3, на катоде выделилось 52 56 г металлического серебра. [2]
Можно устанавливать титры кислот, едкого натра и роданида калия при помощи серебряного кулонометра, измеряя количество электричества, необходимого для полного электролиза этих растворов. Для электролиза соляной кислоты применяют платиновый катод и серебряный анод; когда вся кислота разложена, раствор становится нейтральным, дальнейшее продолжение электролиза ( нейтральной соли) приводит к образованию щелочи. [3]
При пропускании электрического тока через электролизер, наполненный раствором хлорида калия, и серебряный кулонометр на катоде кулонометр а выделилось 0 54 г серебра. [4]
Через три кулонометра ( один серебряный, два из неизвестных металлов) пропустили определенное количество электрического тока, в результате чего масса катода серебряного кулонометра увеличилась на 4 32 г, а масса двух других кулонометров увеличилась соответственно на 1 30 и 2 24 г. Определить, из каких металлов сделаны кулоно-метры. [5]
Широко применяются весовые ( серебряный, медный) и объемные ( ртутный, газовые) ку-лонометры. В серебряном кулонометре анод изготовлен из платины или серебра, а катод только из серебра. Анод отделен от катода диафрагмой. [6]
|
К расчетному определению количества электричества для кулоно-метрии при постоянном потенциале.| Установка для ку-лонометрического титрования при контролируемой силе тока. |
Если есть необходимость в измерении больших количеств электричества, применяются кулонометры, в которых количество прошедшего через них электричества оценивается по весу выделившегося на катодах электролизеров металла. Сюда относятся так называемые медные и серебряные кулонометры. [7]
Работа таких кулонометров основана на осаждении металла на катоде при прохождении тока через электролизер. Один кулон электричества осаждает 1 118 мг серебра в серебряном кулонометре или 0 329 мг меди в медном ку-лонометре. По окончании электролиза электрод промывают, сушат и взвешивают. Серебряный кулонометр имеет ряд преимуществ перед медным, так как электрохимический эквивалент серебра в три раза больше и оно не окисляется на воздухе. [8]
Измерение количества электричества, эквивалентного содержанию окисляемого или восстанавливаемого вещества, надлежащего определению, можно выполнить с помощью либо химического кулонометра, либо интегратора ток - время, соединенных последовательно с кулонометрической ячейкой. Химические кулонометры представляют собой электрохимические ячейки, в которых протекают определенные реакции с 100 % - ной эффективностью тока, В серебряном кулонометре серебро выделяется количественно из раствора нитрата серебра на платиновом катоде, который взвешивают, определяя таким образом количество металлического серебра и эквивалентное ему количество электричества в Кл, прошедшее через раствор в процессе электролиза. В водородно-кислородном кулонометре с двумя платиновыми электродами происходит электролиз разбавленного водного раствора сульфата калия. Вода окисляется до кислорода на аноде, в то время на катоде образуется газообразный водород. Эти газы собирают вместе в закрытую камеру, помещенную над раствором сульфата калия, измеряют их объем при известной температуре и давлении и затем вычисляют количество электричества. Иногда вместо раствора сульфата калия подвергают электролизу раствор гидразинсульфата; в этом случае у анода образуется газообразный азот. [9]
Сравнение уравнений (11.16) и (11.17) показывает, что профиль кривой распределения диффундирующей активности не меняется, смещаясь в кристалле в направлении Е со скоростью цЕ, откуда и следует вышесказанное. Средняя напряженность электрического поля определяется из геометрии опыта, величины о и величины заряда, прошедшего через образец, измеряемого хотя бы с помощью серебряного кулонометра. [10]
|
Схема счетчика машинного времени.| Схема счетчика машинного времени. Время отсчитывают по удлинению медного катода в капилляре. |
По виду выходной величины и способу ее отсчета различают электрохимические интеграторы с электрическим и неэлектрическим отсчетом. В качестве таких интеграторов могут служить электрохимические кулоно-метры, например серебряные или медные. Серебряный кулонометр состоит из платинового катода и серебряного анода. [11]
Раствор, содержащий 0 182 % КОН, был подвергнут электролизу между платиновыми электродами. В серебряном кулонометре за время электролиза выделилось количество серебра, эквивалентное 0 031 г КОН. [12]
Раствор НС1 был подвергнут электролизу в приборе для определения чисел переноса с платиновыми электродами. В серебряном кулонометре, включенном последовательно, выделился осадок серебра, эквивалентный 0 083 моль ионов хлора. [13]
В классическом методе определения количества электричества используется химический кулонометр. Для этого электролитический элемент, содержащий неизвестный раствор, соединяется последовательно с другим элементом, конструкция которого такова, что он позволяет точно измерить электрохимическое действие тока. Одним из наиболее точных приборов является серебряный кулонометр; он состоит из анода, изготовленного из чистого серебра и подвешенного внутри платинового тигля, играющего роль катода. Серебряный анод окружен пористым стаканом для улавливания частичек серебра, отделяющихся от анода. Платиновый тигель тщательно промывают, высушивают и взвешивают как до эксперимента, так и после него. [1]
Электрохимические кулонометры представляют собой электролизеры, в которых определяют массу продукта, образующегося в растворе или выделяющегося на электроде ( электродах) со 100 % - ной эффективностью. По массе образовавшегося продукта рассчитывают Q. В зависимости от природы реакции и способа определения массы выделившегося продукта электрохимические кулонометры подразделяются на гравиметрические, титрационные, газовые, спектрофотометрические и др. Среди них высокой точностью отличается серебряный кулонометр. Однако он неудобен в работе из-за рыхлости образующегося на катоде осадка частиц серебра, которые осыпаются при промывании электрода. [2]
Работа таких кулонометров основана на осаждении металла на катоде при прохождении тока через электролизер. Один кулон электричества осаждает 1 118 мг серебра в серебряном кулонометре или 0 329 мг меди в медном ку-лонометре. По окончании электролиза электрод промывают, сушат и взвешивают. Серебряный кулонометр имеет ряд преимуществ перед медным, так как электрохимический эквивалент серебра в три раза больше и оно не окисляется на воздухе. [3]
Серебряный кулонометр состоит из платинового тигля, служащего одновременно емкостью для электролита и катодом. Тигель помещают на металлическую подставку, служащую токоподводом к нему. Серебряный анод помещают в по-ристый фарфоровый тигель, служащий пористой диафрагмой, предохраняющей катод от попадания на него мелких частичек серебра, которые могут осыпаться с анода. Электролитом в серебряном кулонометре служит 10 - 20 % - ный раствор азотнокислого серебра. [4]
Кулонометрия - сравнительный метод, в котором в аналитических целях непосредственно используются законы Фарадея: измеряется количество электричества, прошедшего через электролитическую ячейку. Этот метод можно применять лишь в тех случаях, когда точно известен электродный процесс и когда основная реакция не сопровождается никакими побочными процессами. Конечная точка устанавливается с помощью подходящей химической реакции, например, при определении кислоты пригоден обычный кислотно-основной индикатор. Они работали с серебряным кулонометром и определяли титры стандартных растворов соляной и серной кислот, роданидов, гидразина, гидроокиси натрия и гидроксиламина. [5]
Метод измерения чисел переноса в твердых телах описан в работах Тубандта и др. [9, 16-18], где приведено большое количество данных, полученных до настоящего времени. Метод Тубандта является видоизменением классического метода, используемого для растворов, и числа переноса ионов определяются из наблюдаемых изменений концентрации ионов около электродов. Исследуемые твердые тела прессуются в виде плоских цилиндрических таблеток, которые после взвешивания располагаются в виде небольшого столбика ( под давлением) между металлическими электродами. Через них пропускается ток, причем количество электричества измеряется серебряным кулонометром, включенным последовательно. В конце опыта ячейка разбирается и отдельные таблетки снова взвешиваются. [6]
Количество электричества, прошедшее через электролитическую ячейку, можно определить, построив кривую зависимости тока от времени: оно равно площади под кривой. Для этого пользуются градуированным гальванометром с малой постоянной времени или химическим кулономет-ром. Последний представляет собой электролитическую ячейку, соединенную последовательно с экспериментальной ячейкой, так что через обе ячейки проходит одинаковое количество электричества. На катоде или аноде ( или на обоих электродах) кулонометра химическая реакция должна протекать со 100 % - ным выходом по току и должна быть такой, чтобы ее можно было легко и точно рассчитать. Осаждение серебра на катоде серебряного кулонометра ( см.), анодное растворение серебра ( см. число Фарадея) и реакция 2е 12 2Г в йодном кулонометре ( см.) - все они удовлетворяют этим требованиям. При малых количествах электричества более чувствителен колориметрический метод. [7]
В процессе электролиза сила тока уменьшается по экспоненциальной зависимости; следовательно, значение Q можно определить при помощи интегрирования. Самый простой метод определения Q основан на использовании кулонометра, который включается в цепь с реакционной ячейкой. Сам кулонометр представляет собой электролизер, позволяющий получать продукт ( со 100 % - ным выходом по току), количество которого можно точно измерить. Обычно используют три типа кулонометров - серебряные, медные и газовые. Прохождение одного кулона электричества вызывает осаждение 1 118 мг серебра в серебряном кулонометре, 0 659 мг меди в медном кулонометре и выделение 0 1739 мл газа в водородно-кислород-ном кулонометре. Значение можно определить с точностью до долей кулона, так как точность взвешивания составляет доли миллиграмма. Следовательно, рассматриваемый метод обладает высокой чувствительностью и точностью. [8]
27.
Кулонометрическое титрование
Кулонометрическое титрование основано на электрохимическом получении титранта (электрогенерировании титранта) с последующей реакцией его с анализируемым веществом. Если титрант электрогенерируется непосредственно в растворе анализируемого вещества, то такое титрование называется кулонометрическим титрованием с внутренней генерацией. Если титрант получают электрогенерированием в отдельном сосуде, а затем подают его в анализируемый раствор, такое титрование называют кулонометрическим титрованием с внешней генерацией. Этот вид титрования используется очень редко.
Кулонометрическое титрование всегда проводят в амперостатическом режиме и применяют большие токи для электролиза, что позволяет выполнять кулонометрическое титрование экспрессно. Затраченное количество электричества на генерацию титранта будет эквивалентно содержанию анализируемого вещества в анализируемой пробе.
Рассмотрим процесс кулонометрического титрования на примере определения церия (IV). В ячейку для титрования помещают точный объем раствора церия и вводят избыток соли железа (III). В раствор погружают два плановых электрода и подсоединяют их к источнику постоянного тока.
После подачи на электроды напряжения на катоде начнут восстанавливаться ионы железа (III):
Fe3+ + е → Fe2+
Ионы Се4+ при этом восстанавливаться не будут, так как в растворе находится большой избыток ионов Fe3+
Образовавшиеся ионы Fe2+ сейчас же вступают в титриметрическую peaкцию с Се4+ :
Се4+ + Fe2+ → Fe3+ + Се3+
Этот процесс будет продолжаться до тех пор, пока все ионы церия (IV) не будут оттитрованы. Момент эквивалентности определяют обычными индикаторным, потенциометрическим, амперометрическим методами.
Количество электричества, затраченное на электрогенерирование титранта в виде ионов Fe2+ будет эквивалентно содержанию ионов церия (IV) в анализируемой пробе.
Кулонометрическое титрование имеет существенное преимущество перед обычным титрованием. Его применение исключает необходимость приготовления и стандартизации титранта, становится возможным применение нестойких титрантов: серебра (I), олова (II), меди (II), титана (III) и др.
Кулонометрически может быть выполнен любой вид титрования: кислотно-основное, осадительное, комплексонометрическое, окислительно-восстановительное. Метод кулонометрического титрования по точности и чувствительности превосходит другие методы титрования. Он пригоден для титрования очень разбавленных растворов концентрацией до 10-6 моль/дм3 , а погрешность определений не превышает 0,1-0,05 %.
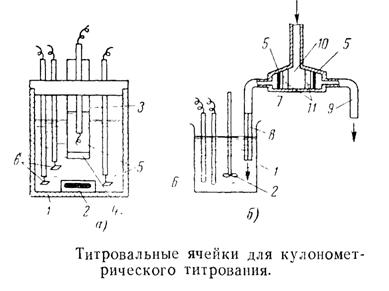
Типичная ячейка для кулонометрического титрования с внутренней генерацией титранта представлена па рис. 26,а. В титровальной ячейке / находятся магнитная мешалка 2, трубка 3 с пористой перегородкой 4, генераторные электроды 5, а также индикаторные электроды 6.
Титровальная ячейка для кулонометрического титрования с внешней генерацией титранта отличается тем, что она комплектуется специальным электролизером, где генерируется титрант. В титровальную ячейку / тигрант поступает из электролизера 7, где он генерируется при пропускании тока через электроды 5. Электроды разделены от входной камеры 10, куда поступает генерируемый реагент, пористыми перегородками //. Титрант в титровальную ячейку направляется через капиллярную трубку 8, а второй компонент, получающийся при электролизе, через трубку 9 сбрасывается в слив. Титровальная ячейка оснащена мешалкой 2 и электродами 6 для индикации конечной точки титрования.
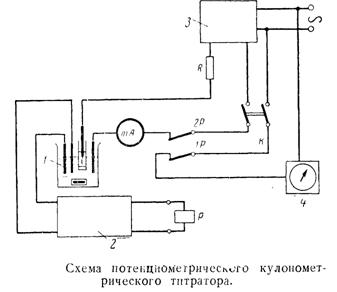
На рис. 27 показана упрощенная схема кулонометрического полуавтоматического титратора с внутренней генерацией титранта.
29
Индикаторная система служит для индикации конечной точки титрования (к.т.т.). Наиболее часто для этой цели используют амперометрический и потенциометрический методы. В ячейку вводят индикаторные электроды: два платиновых электрода (при амперометрической индикации) или платиновый и каломельный электроды (при потенциометрической индикации). Силу тока или разность потенциалов измеряют соответствующими приборами, входящими в комплект установки для титрования (блок индикации). Иногда для определения к.т.т. используют фотометрический метод, помещая ячейку в кюветное отделение фотоэлектроколориметра и измеряя светопоглощение в ходе титрования. В отдельных случаях конец титрования устанавливают визуально, например, по появлению окраски раствора, вызванной избытком титранта. Приборостроительная промышленность серийно выпускает кулонометрические титраторы, в которых для индикации конечной точки титрования используется амперометрический или потенциометрический методы.
30.