
- •Внутрикомплексные соединения
- •Ионная сила раствора
- •Перманганатометрия
- •Хроматометрия
- •Иодометрия
- •Кислотно-основное титрование
- •Электродный потенциал.
- •Кулонометрическая генерация титранта
- •32. Потенциометрия. Разновидности метода. Типы электродов в потенциометрии.
- •33. Потенциометрическое титрование. Способы определения конечной точки титрования.
- •34. Амперометрическое титрование. Кривые титрования.
- •35. Атомно-эмиссионный анализ. Источники атомизации и возбуждения. Качественный и количественный анализ. Уравнение Ломакина-Шайбе.
- •37. Метод молекулярной абсорбционной спектроскопии (фотоколориметрия)
- •38. Электрохимические методы анализа. Общая характеристика и классификация электрохимических методов.
- •40. Прямая потенциометрия. Уравнение Нернста. Индикаторные электроды. Ионометрия : определение pH, ионов щелочных металлов, галогенид-ионов.
1.
Расчет результатов титриметрического анализа основан на принципе эквивалентности, в соответствии с которым вещества реагируют между собой в эквивалентных количествах.
Если определяемое вещество A реагирует с раствором титранта B по уравнению
νAA + νBB → Продукты реакции,
то эквивалентными массами веществ будут νAM(A) и νBM(B), где M(A) и M(B) – молярные массы веществ A и B, а νA и νB – стехиометрические коэффициенты.
Уравнению реакции можно придать вид
A + (νB/νA)B → Продукты реакции ,
где νA>νB, что означает, что одна частица вещества A будет эквивалентна νB/νA частиц вещества B.
Отношение νB/νA обозначают символом fэ и называют фактором эквивалентности вещества B
fэ(B) = νB/νA..
Фактор эквивалентности является безразмерной величиной, равной или меньшей единицы.
Величину νB/νAB или равную ей fэ(B)B называют эквивалентом вещества B.
Эквивалентом называется реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
При использовании термина "эквивалент" всегда необходимо указывать, к какой конкретной реакции он относится.
Под условной частицей понимаются как реально существующие частицы (молекулы, ионы, электроны и т.д.), так и доли таких частиц (например,1/2 иона) или их группы.
Единицей количества вещества эквивалента является моль. Например, в реакции
NaOH + 1/2 H2SO4 → 1/2 Na2SO4 + H2O
fэ(NaOH)=1; fэ(H2SO4)=1/2
Эквивалент серной кислоты в этой реакции будет составлять половину молекулы (условная частица)
fэ(H2SO4) H2SO4 = 1/2 H2SO4
Для реакции
H3PO4 + KOH → KH2PO4 + H2O
fэ(H3PO4)=1; fэ(H3PO4) H3PO4 = H3PO4 ,
а для реакции
H3PO4 + 3 KOH → K3PO4 + 3H2O
fэ(H3PO4)=1/3; fэ(H3PO4) H3PO4 = 1/3 H3PO4.
В полуреакции
MnO4- + 8H+ + 5e → Mn2+ + 4 H2O
fэ(KMnO4)=1/5; fэ(KMnO4) KMnO4 = 1/5 KMnO4 ,
но в полуреакции
MnO4- + 4H+ + 3e → MnO2 + 2H2O
fэ(KMnO4)=1/3; fэ(KMnO4) KMnO4 = 1/3 KMnO4.
Фактор эквивалентности и эквивалент данного вещества являются не постоянными величинами, а зависят от стехиометрии реакции, в которой они принимают участие. Таким образом,
Фактор эквивалентности – это число, обозначающее, какая доля реальной частицы вещества X эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в реакции окисления-восстановления.
Важное значение в титриметрическом анализе имеет понятие молярной массы эквивалента.
Молярной массой эквивалента (Mэ) вещества X называют массу одного моля эквивалента этого вещества, равную произведению фактора эквивалентности на молярную массу вещества X. Для молярной массы эквивалента в литературе встречается также термин "эквивалентная масса".
Таким образом, молярная масса эквивалента – это масса авогадрова числа эквивалентов (вообще говоря, условных частиц): Mэ=fэM, гдеM – молярная масса вещества (масса авогадрова числа молекул, т.е. реальных частиц). Следовательно, масса вещества может быть выражена из соотношений m=νM=νMэ/fэ=nMэ, где n=ν/fэ – количество вещества эквивалента.
Отношение количества вещества эквивалента в растворе к объему раствора называется молярной концентрацией эквивалента: C(fэ(X)X)=n(fэ(X)X)/V.
Например, C(1/2 H2SO4) = 0,1 моль/л.
Вместо обозначения единицы измерения моль/л допускается сокращение "н", происхождение которого связано с тем, что молярную концентрацию эквивалента называют также нормальной концентрацией. Например, 1н. H2SO4, т.е. 1 моль эквивалента H2SO4 на литр раствора. При использовании молярной концентрации эквивалента следует указывать реакцию, в которой применяется раствор данной нормальности, или приводить фактор эквивалентности.
2.
БУФЕРНЫЕ РАСТВОРЫ
БУФЕРНЫЕ РАСТВОРЫ – растворы, концентрация ионов водорода (рН) которых не изменяется от прибавления ограниченных количеств сильной кислоты или щелочи (см. водородный показатель). Они состоят из смеси раствора слабой кислоты и ее соли сильного основания или, наоборот, — слабого основания и его соли сильной кислоты, например: СН3СOOН+СН3СOONa — ацетатный буфер, NH4OH+NHCl — аммиачный буфер. Действие Б.р. определяется наличием двух взаимосвязанных равновесных систем — диссоциацией и гидролизом. Для определения пределов действия Б.р. вводится понятие буферная емкость, измеряемая количеством сильной кислоты или основания (в г-экв), которое надо добавить к 1 л Б.р., чтобы сместить рН на единицу. Максимальная буферная емкость соответствует содержанию компонентов в эквивалентных количествах. В маломинерализованных природных водах буферность в основном создается карбонатами, т.е. свободной угольной кислотой и ее солями сильных оснований (Ca, Mg, Na). В морских водах в образовании буферности участвует и боратный буфер. Буферная емкость морской воды при 0оС в 11 раз выше, чем у раствора NaCl с концентрацией 35о/оо и в 9 раз выше, чем у дистиллированной воды. При 30оС превышение составляет соответственно 25 и 19 раз. Такое увеличение буферной емкости морской воды с температурой связано с усилением диссоциации и гидролиза компонентов, составляющих буферность. У дистиллированной воды буферность несколько выше, чем у раствора NaCl за счет лучшей растворимости СO2. Поскольку величина рН зависит не от концентраций компонентов, а от их соотношения, то при разбавлении Б.р. она остается постоянной. В то же время, несмотря на высокую буферную емкость природных вод, процессы фотосинтеза (см.) или дыхания сильно влияют на величину рН, так как при этом меняются соотношения между концентрациями СO2 и НСO3–. Б.р. играют важную роль в живых организмах. Можно добавить, что строго фиксированные величины рН в различных органах высших животных и человека, как правило, поддерживаются не одним, а целой системой Б.р., например, в крови — буферными растворами на основании карбонатов и фосфатов. Кислые или щелочные стоки, попадающие в водоем, могут быть нейтрализованы карбонатной буферной системой природных вод. Это же способствует поддержанию постоянства рН воды при введении реагентов в процессе обработки воды. При биологической очистке сточных вод (см.) оптимальные величины рН для нормального протекания процессов жизнедеятельности микроорганизмов поддерживаются наличием буферных систем (карбонатной, аммонийной и фосфатной систем). Кроме того, Б.р. широко используются при химическом анализе воды (см.).
Значение pH буферного раствора можно рассчитать по формуле:
![]() ,
,
где ![]() это
отрицательный десятичный логарифм от
константы диссоциации кислоты
это
отрицательный десятичный логарифм от
константы диссоциации кислоты ![]()
3.
Хелаты - также внутрикомплексные или циклические комплексные соединения — клешневидные комплексные соединения, образуются при взаимодействии ионов металлов с полидентатными (то есть имеющими несколько донорных центров) лигандами. Хелаты содержат центральный ион (частицу) — комплексообразователь и координированные вокруг неголиганды. Внутренняя сфера хелата состоит из циклических группировок, включающих комплексообразователь.
Иногда разделяют понятия хелатного и внутрикомплексного соединения. Второе определение применяют в случае, когда атом-комплексообразователь замещает протон лиганда в соединении.
Хелаты используют в химии для разделения, концентрирования и аналитического определения различных элементов. В медицине и сельском хозяйстве - для введения в пищу микроэлементов (Fe, Cu, Mn и т.д.), благодаря высокой усваиваемости хелатных комплексов по сравнению со свободными ионами металлов.
Пример
Аминоуксусная кислота (глицин) может реагировать с гидроксидом меди с образованием сине-фиолетового прочного комплекса, растворимого в воде:
Cu(OH)2 + 2 NH2CH2COOH = [Cu(NH2CH2COO)2] + 2H2O
Лиганд NH2CH2COO− (глицинат-ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем — через атом кислорода карбоксильной группы и через атом азота аминогруппы.
Внутренняя сфера комплекса содержит два замкнутых пятичленных цикла, в связи с чем полученный комплекс отличается высокой устойчивостью. Константа образования диглицинатомеди(II) β2 равна 1,8·1015.
Внутрикомплексные соединения
Комплексные соединения, образуемые различными катионами с органическими реагентами, относятся к типу внутрикомплексных солей и имеют большое значение в аналитической химии. Причина этого – их большая устойчивость по сравнению с неорганическими комплексами и более интенсивная окраска.
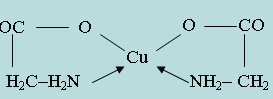
Основоположниками применения органических аналитических реактивов являются М. А. Ильинский, применивший α-нитрозо- β-нафтол для обнаружения кобальта, и Л. А. Чугаев, синтезировавший и применивший в анализе диметилглиоксим для обнаружения и количественного определения никеля. Координационная связь обозначена стрелкой, направленной к центральному атому-комплексообразователю. Подобной внутриком-плексной солью является соединение Ni2+ с диметилглиоксимом (рис. 5.3.1.). Для образования внутрикомплексных соединений требуется участие органических реагентов, которые содержат определенные атомные группы, обладающие кислотными свойствами. Такими группами являются: -COOH, -OH, =NOH, =NH, -NH2, -SO3H и др. Ион-комплексообразователь может вытеснять водород из таких групп органического соединения, образуя обычную валентную связь. Если же в молекуле органического соединения, наряду с одной из подобных групп, присутствует другая группа, играющая роль лиганда для данного катиона (-NH2, =NH, =CO, -OH, =S и др.), то катион, замещая атом водорода в кислотной группе, может образовывать координационную связь с группой лиганда. Получающиеся при этом соли называются внутрикомплексными. Внутрикомплексные соединения – соединения, в которых лиганд связан с комплексообразователем одновременно ионными и координационными связями. Например, при взаимодействии аминоуксусной кислоты NH2 - CH2 - COOH с ионами Cu2+ образуется соединение циклической структуры:
Координационная связь обозначена стрелкой, направленной к центральному атому-комплексообразователю. Подобной внутрикомплексной солью является соединение Ni2+ с диметилглиоксимом (рис. 9.3).
Таким образом, наряду с замещением двух атомов водорода в кислотных группах = NOH двух молекул диметилглиоксима, Ni2+-ион соединяется также координационной связью с атомами азота еще двух указанных групп. Из приведенных примеров видно, что молекулы внутрикомплексных солей имеют циклическое (кольцеобразное) строение. Комплексные соединения, имеющие циклическую структуру, называют хелатами. Частным случаем их являются внутрикомплексные соединения. Наиболее устойчивые внутрикомплексные соединения с пяти- и шестичленными кольцами.
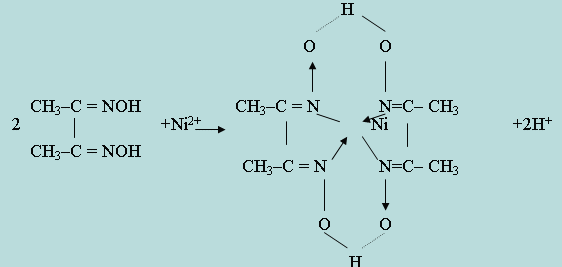
Рис.9.3 Уравнение реакции образования никеля с диметилглиоксимом
Широкое применение в практике химического анализа получили органические вещества, образующие с большинством катионов прочные растворимые комплексы. Эти вещества называются комплексонами. Комплексоны представляют собой многоосновные органические кислоты (или их соли), содержащие аминогруппы. Например, этилендиаминтетрауксусная кислота:
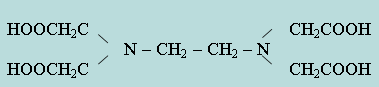
Двунатриевая соль этой кислоты, или комплексон III (трилон Б), образует растворимые комплексы со всеми двух-, трех- и четырехзарядными катионами при различных рН раствора. Большое применение комплексоны получили в количественном анализе.
Хелаты чаще всего имеют тетраэдрич. и октаэдрич. конфигурации; в случае отсутствия кратных связей в мостике наиб, устойчивы 5- и 6-членные циклы (правило циклов Чугаева). Диоксид метил ендифосфина образует устойчивый 6-членный цикл ф-лы IX. С увеличением длины углеводородного мостика при переходе к диоксиду этилендифосфи-на последний выступает в роли мостиковой группы (ф-ла X) и хелатный цикл не образуется. Наличие кратной связи в диоксиде цис-винилендифосфина приводит к устойчивости семичленного цикла XI.
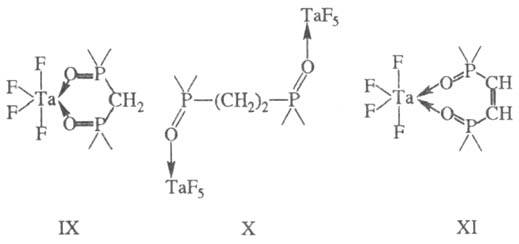
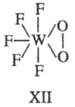
4-членные циклы при тетраэдрич. и октаэдрич. координации центр, иона являются более напряженными и менее прочными. 3-членные хелатные циклы известны для перок-сид-аниона, когда последний занимает два координационных места в экваториальной плоскости пентагональной бипирамиды (ф-ла ХП).
КОМПЛЕКСОНОМEТРИЯ (хелатометрия), титриметрический метод анализа, основанный на образовании прочных внутрикомплексных соед. (хелатов) между катионами металлов и комплексонами. наиб. часто применяют иминодиуксусную, нитрилотриуксусную (комплексен I) и этилендиаминтетрауксусную (комплексен II) к-ты, динатриевую соль последней (комплексов III, ЭДТА), а также 1,2-диаминоциклогексантетрауксусную к-ту (комплексен IV). Конечную точку титрования устанавливают визуально по изменению окраски комплексонометрич. индикаторов(металлоиндикаторов), а также потенциометрически, фотометрически, амперометрически или др. методами. При прямом титровании к р-ру исследуемого иона небольшими порциями добавляют стандартный р-р комплексона. Таким образом определяют ионы Са, Sr, Ba, Cu, Mg, Mn, Zn и др. При анализе кинетически инертных акваионов применяют обратное титрование: к р-ру исследуемого иона добавляют точный объем стандартного р-ра комплексона, избыток к-рого (после нагревания) оттитровывают стандартным р-ром к.-л. катиона, взаимодействующего с металлоиндикатором. Так можно определять любые катионы, образующие более устойчивые хелаты с комплексонами (комплексонаты), чем катионтитранта; при этом константы устойчивости должны различаться не менее чем на 7 порядков. Метод обратного титрования менее точен, т. к. ошибки возможны при установлении концентраций р-ров не только комплексона, но и катиона. Для определения ионов М, не взаимодействующих с металлоиндикаторами, применяют вытеснительное титрование: к анализируемому р-ру прибавляют в избытке точный объем стандартного р-ра комплексоната (иногда др. комплексного соед.) иона М', к-рый образует менее устойчивые комплексные соед., чем определяемый ион М. Ионы М', вытесняющиеся в кол-ве, эквивалентном кол-ву ионов М, оттитровывают стандартным р-ром комплексона в присут. металлоиндикатора.Концентрацию ионов, не взаимодействующих с комплексонами, устанавливают косвенным методом. Напр., при определении анионов их сначала осаждают стандартным р-ром подходящего катиона, избыток к-рого оттитровывают р-ром комплексона. Комплексоны - неизбирательные реагенты.Селективность комплексонометрии повышают разл. приемами: уменьшением рН среды, выделением (осаждением, экстракцией) определяемогоиона, маскированием, изменением степени окисления катиона и т.д. При титровании в кислой среде условная константа устойчивости комплексоната определяемого иона должна быть /108. Титрованию не мешают ионы, условная константа устойчивости комплексонатов к-рых на 6 и более порядков меньше. Многообразие приемов комплексонометрии дает возможность определять практически все катионы и анионы. Метод широко применяют при анализе прир. и пром. объектов. По правильности и воспроизводимости комплексонометрия несколько уступаетгравиметрии, но значительно превосходит ее по экспрессности. В зависимости от способа индикации конечной точки можно титровать р-ры исследуемого в-ва с концентрацией 10-4-10-1 М.
4.




5.






6.
Химическое равновесие в гомогенных системах
Общие закономерности, вытекающие из второго закона термодинамики, применимы к химическим превращениям и дают возможность установления условий химического равновесия. Наиболее простым случаем является равновесие при химических реакциях в однородных средах, например в смесях газов или в растворах, которые не сопровождаются фазовыми переходами. Такие реакции, где и исходные вещества и продукты находятся в одной фазе, называются гомогенными.
Существование химического равновесия означает, что реакции не идут до конца, т.е. до исчезновения исходных веществ и полного превращения их в продукты реакции. В некоторых случаях, однако, равновесия могут быть значительно смещены в одну сторону, например, в сторону конечных продуктов, и поэтому концентрации исходных веществ настолько малы, что не поддаются экспериментальному определению. Это, в частности, имеет место при высокотемпературном разложении органических веществ (крекинг нефти). Вообще химические реакции могут протекать как в прямом, так и в обратном направлениях. Можно изменить направление реакции, изменяя условия ее протекания, например температуру.
С практической точки зрения для каждой конкретной химической реакции важно знать, в какую сторону и в какой степени сдвинуто равновесие. Это дает информацию о возможности осуществления реакций, их максимально достижимом выходе в том или ином технологическом процессе. Для решения подобных задач необходимо научиться количественно характеризовать состояние равновесия и найти параметры, от которых оно зависит.
Например, при конверсии природного газа, широко применяемой в металлургии, направление реакции СН4г + Н2ОГ ←→ СОг+3Н2гсущественно зависит от температуры. При относительно низких температурах оно смещено в сторону СН4 и Н2O, а при высоких в смеси преобладают восстановительные газы СО и Н2.
Во многих случаях в промышленной практике для ускорения достижения равновесия применяют катализаторы. Так, при синтезе аммиака смесь азота и водорода в определенном соотношении пропускают над катализатором. При этом устанавливается равновесие, характеризуемое определенным составом газовой смеси N2-Н2-NH3, который зависит от температуры, давления и исходных концентраций реагирующих веществ. Следует, однако, иметь в виду, что состояние равновесия при данных условиях не зависит от присутствия катализатора. Если бы это было не так, то могло бы существовать два разных состояния равновесия - с катализатором и без него при одних и тех же значениях всех термодинамических параметров. Это противоречило бы второму закону термодинамики.
Рассмотрим равновесие газовых реакций в общем виде:
Aг + 2Bг ←→ 3Dг. (III.10)
В какую сторону пойдет эта реакция в системе, предоставленной самой себе, при постоянных температуре и общем давлении при тех или иных начальных концентрациях реагирующих веществ? Для ответа на этот вопрос следует использовать общее условие равновесия, заключающееся в минимуме свободной энергии Гиббса. Из него следует, что при равновесии изменение ΔG = 0. Это означает равенство сумм энергий Гиббса исходных веществ и продуктов реакции. В рассматриваемом случае
ΔG = 3Gd - 3Gb - Ga = 0. (III.11)
Очевидно, если бы значение ΔG отличалось от нуля, то реакция (III.10) протекала самопроизвольно в том направлении, котором убывала бы энергия Гиббса системы.
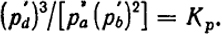
Парциальные давления реагирующих газов при равновесии связаны между собой определенным соотношением, которое является выражением закона действующих масс. При постоянной температуре это дробь, числитель которой есть произведение парциальных давлений веществ, образующихся при реакции, а знаменатель - произведение парциальных давлений исходных веществ. Показателями степеней при парциальных давлениях являются стехиометрические коэффициенты, в которых данные вещества вступают в реакцию. При равновесии такая дробь есть величина постоянная и называется константой равновесияКр.
Из уравнения (III.15) видно, что величина Кp дает количественную оценку равновесия. Если ее численное значение велико, то равновесие реакции сдвинуто в сторону образования продуктов реакции, если оно мало, то в смеси преобладают исходные вещества.
Принцип Ле Шателье: если на систему, находящуюся в равновесии оказывают воздействие извне, то равновесие смещается в сторону той реакции (прямой или обратной), которая ослабляет это воздействие.
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учетом различных взаимодействий между ними в растворе, то есть с учетом отклонения поведения системы от модели идеального раствора.
Активность была предложена в 1907 году Льюисом как новая переменная, применение которой вместо концентрации позволяет использовать для описания свойств реальных растворов относительно простые уравнения, полученные для идеальных систем. Альтернативой этому пути является использование более сложных уравнений, учитывающих взаимодействие между частицами (см., например, уравнение Ван-дер-Ваальса).
Активность
отличается от общей концентрации на
некоторую величину. Отношение активности
(![]() )
к общей концентрации вещества в растворе
называется коэффициентом
активности:
)
к общей концентрации вещества в растворе
называется коэффициентом
активности:
![]()
Коэффициент активности служит мерой отклонения поведения раствора (или компонента раствора) от идеального. Отклонения от идеальности могут быть обусловлены различными химическими и физическими причинами — дипольные взаимодействия, поляризация, образование водородных связей, ассоциация, диссоциация, сольватация и др.[1]
Исходя из понятия химического потенциала, активность компонента в растворе можно определить как величину, которую нужно подставить в выражения для химического потенциала компонента в идеальном растворе:
![]()
![]()
(где ![]() —
химический потенциал чистого
—
химический потенциал чистого ![]() -го
компонента) вместо мольной доли x, для
того, чтобы получить действительное
значение химического потенциала
-го
компонента в реальном растворе:
-го
компонента) вместо мольной доли x, для
того, чтобы получить действительное
значение химического потенциала
-го
компонента в реальном растворе:
![]()
![]()
где ![]() —
стандартный химический потенциал.[2]
—
стандартный химический потенциал.[2]
Размерность
и величина активности зависит от
используемого способа выражения
концентрации — если ![]() (активность
при выражении концентрации как мольной
доли) величина безразмерная, то
(активность
при выражении концентрации как мольной
доли) величина безразмерная, то ![]() и
и ![]() (для
молярности и моляльности соответственно) —
размерные величины, выражаются в моль/л
и моль/кг.
(для
молярности и моляльности соответственно) —
размерные величины, выражаются в моль/л
и моль/кг.
Коэффициент
активности в общем случае может быть
как больше, так и меньше единицы (при
этом говорят о положительных или
отрицательных отклонениях от идеального
поведениясоответственно,
или о положительных и отрицательных
отклонениях от закона
Рауля).
Возможны и знакопеременные отклонения
от идеального поведения (то есть
коэффициент активности меньше единицы
при одних концентрациях, и больше —
при других). Так, например, для железа в
системе Fe-S при 1300 °C в[3] рекомендуются
коэффициенты активности от 0,004 при ![]() до
1,47 при
до
1,47 при ![]() .
.
