
- •Предмет и задачи кристаллохимии.
- •4. Вывод уравнения Вульфа-брегга, его использование.
- •Применение
- •5. Методы рентгеновской съёмки кристаллов.
- •6. Метод Дебая-Шеррера в рса, его использование.
- •15.Основные типы кристалличетских структур. Примеры.
- •19. Строение и свойства силикатов. Цеолиты
- •20. Полиморфизм. Различие в строение полиморфных модификаций.
- •21. Изоморфизм. Твердые растворы замещения, твердые растворы внедрения.
- •24. Реальные кристаллы. Дефекты кристаллических решеток.
- •26. Классификация кристаллических структур.
6. Метод Дебая-Шеррера в рса, его использование.
МЕТОД ПОРОШКА— один из методов рентгеноструктурного анализа м-лов. Для исследования берут тонкий порошок к-лов, из которого изготовляют спрессованный столбик.
В Д.— Ш. м. тонкий пучок монохроматич. рентг. излучения падает на образец, к-рый рассеивает излучение вдоль образующих соосных конусов с углом раствора q (рис. 1).
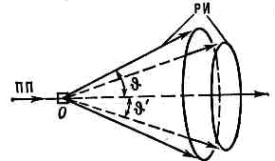
Рис. 1. Рассеяние первичного рентг. излучения ПП на поликрист. образце 0. Рассеянное излучение РИ направлено к ПП под углами q и q'.
При этом излучение рассеивается только теми кристалликами, к-рые ориентированы в пр-ве так, что для них при данной длине волны излучения выполняется Брэгга — Вульфа условие. Поскольку это условие может одновременно выполняться для неск. семейств кристаллографич. плоскостей, то возникает совокупность дифракц. конусов с различными углами раствора 2q. Для того чтобы все кристаллики последовательно вывести в отражающее положение, образец равномерно вращают вокруг оси, перпендикулярной направлению первичного пучка. Рассеянное излучение можно регистрировать на фотоплёнке (дебаеграмма) в цилиндрич. (дебаевской) рентгеновской камере (рис. 2). В рентгеновскомдифрактометредифракц. максимумы регистрируются фотоэлектрич. или ионизац. приёмником
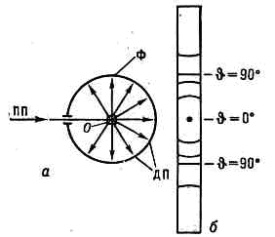
Рис. 2. Схема получения дебаеграммы б в цилиндрич. дебаевской камере а (0 — образец, ПП — первичный рентг. пучок). На дебаеграмме б видны полосы, оставляемые на фотоплёнке Ф дифракц. пучками ДП.
Преимущества М. п.: документальность анализа, простота, использование для анализа порошка, а не монокристаллов, малое количество вещества, необходимое для анализа (1—2 мг); вещество после анализа сохраняется. М. п. позволяет определить параметры кристаллической решетки м-лов высшей, средней и отчасти низшей категории. С большой точностью М. п. дает возможность производить фазовый анализ, т. е. определять минеральный состав руд, г. п. (марганцовые руды, глины и т. д.). М. п. изучают изоморфные смеси м-лов. Он широко используется при изучении металлов и сплавов, диаграмм состояния. М. п. определяют кристаллические ориентировки (текстуры), а также число кристалликов размером от 1 до 100 μ. М. п. применяется при измерении внутренних напряжений в кристаллической структуре.
12. Ван-дер-Ваальсовы силы. Энергия решетки. Примеры структур. Свойства.
Ван-дер-Ваальсовы силы — силы межмолекулярного взаимодействия с энергией 0,8 — 8,16 кДж/моль.
Выражение для энергии взаимодействия содержит два члена. Один из них соответствует притяжению м\умолекулами, а другой отталкиванию.
Энергия отталкивания: Uотт=bexp(-r/p(плотность)), где r-расстояние между центрами молекул. Энергия отталкивания определяется по коэффициентам сжимаемости кристаллов.
Энергия притяжения состоит из 3 слагаемых: U=U1+U2+U3, где
U1- ориентационное взаимодействие (если молекулы полярные ,т.е. обладают собственным дипольным моментом, то между диполями разных молекул возникает взаимодействие притяжения) U1= -A/r^6, где r-расстояние между диполями; величина А положительна и зависит от величины дипольного момента молекул, а также от температуры. Величина А тем больше, чем больше дипольный момент и меньше температура (из-за теплового эффекта)
U2- индукционное взаимодействие (возникновение дипольного момента под воздействием окружающих неполярных молекул) U2=-B/r^6, где В-постоянная, зависящая от дипольного момента и поляризуемости молекулы, т.е. от способности молекулы создавать вокруг себя наведенный диполь. В<А
U3- дисперсионное взаимодействие (взаимодействием между мгновенным и наведенным диполем).U3= -C/r^6, где постоянная С положительна и зависит от поляризуемости молекул и от частоты колебания молекул.
В полярных молекулах наиболее сильна ориентационная связь, в неполярных –дисперсионная
U=U1+U2+U3+Uотт
Среди простых кристаллических веществ с ван-дер-валльсовским взаимодействием обнаружено только у инертных газов в твердой фазе. Например: в кристаллах Н2, О2, N2 и молекулярных кристаллах большинства органических соединений. Все инертные газы и многие молекулярные вещества с простыми симметричными молекулами кристаллизуются в структуры с плотнейшими упаковками.
Свойства: низкие температуры плавления, малая твердость и значительное тепловое расширение. Всё это свидетельствует о непрочности ван-дер-ваал. Сил.
