
- •Экология. Основные понятия. Определения.
- •Экосистемы. Разновидности экосистем.
- •Экология: нормативная база. Примеры.
- •1. Закон минимума ю. Либиха.
- •2. Закон толерантности шелфорда.
- •3. Закон экологической сукцессии.
- •4. Закон гомеостаза.
- •5. Закон квантитативной компенсации.
- •6. Законы б.Коммонера.
- •1) Все связано со всем,
- •2) Все должно куда-то деваться,
- •3) Ничто не дается даром,
- •Правило ле шателье – браун.
- •Экологические факторы. Классификация. Разновидности.
- •Экология и иерархия естественных наук, уровни знаний.
- •7. Окружающая среда, атмосфера, ее состав.
- •Окружающая среда, атмосфера, основные процессы.
- •Особенности химических процессов в атмосфере
- •Воздух, которым мы дышим
- •9. Атмосфера, структура, характер изменения температуры и давления с высотой. Причины.
- •10. Атмосфера: поглощение солнечного излучения. Парниковый эффект, парниковые газы. Примеры.
- •11. Атмосфера, основные процессы, фотохимический смог.
- •Особенности химических процессов в атмосфере
- •Атмосфера
- •Воздух, которым мы дышим
- •Фотохимический смог.
- •12.Атмосфера, как кибернетическая система, функциональная схема.
- •Оболочка планеты: химические частицы, разновидности, примеры участия в процессах.
- •Экология большого города: атмосфера.
- •Окружающая среда: гидросфера, состав.
- •Природные воды, их качество, основные показатели, классификация.
- •Качество природной воды
- •17.Гидросфера, как кибернетическая система. Перенос вещества. Химические процессы в гидросфере
- •Особенности химических процессов в гидросфере
- •18. Загрязнение, загрязнители. Примеры.
- •Загрязнение и загрязнители окружающей среды
- •Загрязнения
- •19. Естественные и искусственные источники загрязнения.
- •Естественные источники загрязнения
- •В улканы
- •Антропогенные источники загрязнения
- •Загрязнения
- •20.Загрязнение среды обитания: коррозия. Примеры.
- •Вулканическая деятельность, неорганические и органические загрязнения.
- •В улканы
- •22.Локальная среда обитания. Основные источники загрязнения, упаковка лекарственных препаратов.
- •Наиболее опасные вещества и факторы воздействия
- •23.Загрязнение жидких лекарственных препаратов от контейнеров для их хранения: причины, последствия.
- •24. Загрязнители: разновидности, источники, нейтрализация.
- •25. Коррозия- один из основных источников загрязнения окружающей среды соединениями металлов. Примеры.
- •Техносфера, техногенез. Примеры.
- •27. Биосфера – особая оболочка планеты
- •Некоторые особенности биосферы
- •Биосфера, состав, основные процессы.
- •Химические процессы в биосфере
- •Примеры химических и фотохимических процессов в биосфере
- •29. Биота, основные функции живого вещества.
- •30.Биосфера, биота, накопление химических элементов. Примеры. Разведанные запасы некоторых химических элементов и их ежегодное
- •31.Литосфера: состав, почва, удобрение.
- •Литосфера, минералы биологического происхождения.
- •Химические процессы в литосфере
- •37. Взаимосвязь оболочек планеты. Примеры.
- •38. Оболочки планеты: окислительно-восстановительные процессы. Примеры.
- •39. Процессы гидролиза в оболочках планеты. Примеры.
- •40. Оболочки планеты: Принцип Ле Шателье Брауна.
- •41. Токсичность: нормативная база, основные положения. Примеры.
- •42.Пищевые добавки и безопасность жизнедеятельности. Примеры.
- •43.Токсичность, разновидности токсичных веществ. Примеры.
- •Супертоксиканты:
- •Нейтрализация токсичных веществ
- •44.Токсичность, основные положения накопление соединений в костных и мягких тканях. Примеры.
- •45. Пищевые добавки, функциональные классы, характеристика, токсичность.
- •П ищевые добавки Пищевые добавки и химические соединения
- •Взаимодействие между постоянным и переменным составом оболочек планеты. Примеры.
- •Коррозия алюминия в кислотах
- •48. Кибернетические системы. Океанические циркуляции.
- •Гидросфера.
- •Функциональная схема подсистемы «океанические циркуляции»
- •50.Системный подход к рассмотрению оболочек планеты. Примеры.
- •51. Экология и кибернетика. Кибернетические системы.
- •Причины:
- •Примеры построения функциональных схем для систем различного уровня Общий подход (алгоритм)
- •52.Большой город. Автотранспорт.
- •53.Экология большого города: химический фактор. Примеры. Экология городов
- •54.Экология большого города: население, влияющие факторы. Примеры.
- •Зоны воздействия экологического фактора на организм
- •55.Основные экологические проблемы и пути их решения.
- •1. Зеленые насаждения:
- •2. Полезные ископаемые:
- •3. Охрана земель:
- •Приложение 4 Данные по гигиеническому нормированию
- •Приложение 5 Данные по пдк некоторых веществ в водоемах
- •Приложение 7 Классификация воды по качеству
- •Приложение 8 Данные по качеству вод, используемых для питьевого снабжения в различных странах
- •Приложение 9 Санитарные нормы допустимых концентраций для некоторых химических веществ в почве
- •I28. Современное об-во и его воздействие на биосферу и ч-ка.
- •11. Ограниченность лесных ресурсов.
- •33. Стратегия выхода из эколог.Кризиса.
- •4.4 Влияние радиоактивных веществ
- •2. Доклады Римскому клубу.
- •Понятие ресурсы.
- •26. История формирования эколог. Ниш человека
- •17. 18. Климатические последствия загрязнения атмосферы.
- •Парниковый эффект.
- •Озоновый экран Земли
- •Принцип Ле-Шателье - Брауна
- •Естествознание как иерархия наук о природе
- •Атмосфера Земли, ее строение, состав и экологическое значение
- •Экология атмосферы, гидросферы, педосферы
- •Загрязнение атмосферы
- •Техногенез: глобальные и региональные проявления
- •Строение атмосферы
- •Загрязнение атмосферного воздуха
- •Защита атмосферного воздуха от загрязнения
- •Фотохимический смог
- •Токсиканты и их специфические биогеохимические особенности
- •Понятие токсичности и канцерогенности элементов и соединений
- •3.2. Токсиканты и их специфические биогеохимические особенности
- •3.3. Понятие токсичности и канцерогенности элементов и соединений
- •. Защита атмосферы
- •2. Основная нормативно-правовая база экологического менеджмента
- •Нормативно-правовая база пноолр Требования законодательства рф к проекту пноолр
- •Стандарты и сНиП
- •Санитарные, строительные нормы и правила
- •Рекомендации, методические указания, инструкции
- •Сильнодействующие ядовитые вещества (сдяв) Влияние сильнодействующих отравляющих веществ на организм
- •3. Правила хранения
- •4. Возможные изменения при несоблюдении правил хранения
Принцип Ле-Шателье - Брауна
Общее условие устойчивости равновесия изолированных систем может быть сформулировано на основе закона возрастания энтропии. Из этого закона следует, что возрастание энтропии изолированной системы происходит до тех пор, пока в ней не затухают все необратимые процессы. В этом случае энтропия достигает максимального значения. Следовательно, условие устойчивости состояния термодинамической системы можно сформулировать следующим образом:
Если энтропия адиабатически изолированной термодинамической системы принимает максимальное значение, то ее состояние термодинамически устойчиво.
Данное
условие означает, что при устойчивом
термодинамическом равновесии
энтропия ![]() адиабатически
изолированной системы имеет экстремум:
адиабатически
изолированной системы имеет экстремум: ![]() ,
где
,
где ![]() -
энтропия системы в состоянии
термодинамического равновесия.
Следовательно, в состоянии устойчивого
равновесия первая вариация
энтропии
-
энтропия системы в состоянии
термодинамического равновесия.
Следовательно, в состоянии устойчивого
равновесия первая вариация
энтропии ![]() изолированной
термодинамической системы равна
нулю:
изолированной
термодинамической системы равна
нулю: ![]() ,
а вторая ее вариация
,
а вторая ее вариация ![]() -
меньше нуля:
-
меньше нуля: ![]() .
В данном случае под вариацией энтропии
понимается ее бесконечно малое изменение
при бесконечно малом изменении параметров
состояния, которые приводят к переводу
системы в неравновесное состояние.
Условие равенства нулю первой вариации
энтропии
дает
необходимое условие равновесия
изолированной системы, а неравенство
.
В данном случае под вариацией энтропии
понимается ее бесконечно малое изменение
при бесконечно малом изменении параметров
состояния, которые приводят к переводу
системы в неравновесное состояние.
Условие равенства нулю первой вариации
энтропии
дает
необходимое условие равновесия
изолированной системы, а неравенство ![]() -
достаточное условие устойчивости
равновесного состояния.
-
достаточное условие устойчивости
равновесного состояния.
На термодинамическую систему, находящуюся в состоянии устойчивого равновесия, могут воздействовать внешние факторы, выводящие ее из этого состояния. Реакцию системы на эти воздействия можно качественно определить на основе принципа Ле-Шателье - Брауна, предложенного в 1884 году французским химиком Анри Луи Ле-Шателье (1850 - 1936) и обоснованного в 1887 году немецким физиком Карлом Фердинандом Брауном (1850 - 1918):
Внешние воздействия, выводящие термодинамическую систему из состояния устойчивого равновесия, вызывают в ней протекание процессов, которые уменьшают влияние этих внешних возмущений.
Противодействие внешним воздействиям протекающими в системе процессами напоминает известное в электродинамике правило Ленца, утверждающее, что индукционный ток в проводящем контуре всегда направлен так, что бы противодействовать изменению магнитного потока через поверхность, ограниченную этим контуром.
Сформулированный принцип позволяет предсказать направление протекания процессов в термодинамической системе, которая выводится из состояния устойчивого равновесия внешними воздействиями. Рассмотрим наглядный пример применения принципа Ле-Шателье-Брауна. Пусть имеется смесь льда и воды, находящаяся в состоянии устойчивого равновесия. Если этой смеси сообщить некоторое количество теплоты, то лед начнет таять, что будет препятствовать повышению температуры смеси. То есть, протекающий в системе процесс таяния льда будет ослаблять изменения, вызываемые подводом теплоты.
Примером использования в техническом устройстве процессов, следующих из принципа Ле-Шателье - Брауна, является поглощение газа в адсорбционных вакуумных насосах. Химическая адсорбция газа, как правило, происходит с выделением теплоты. Соответственно при охлаждении вещества (адсорбента), наблюдается резкое увеличение поглощения им газа, что позволяет уменьшить давление этого газа в вакуумируемом сосуде. При нагреве адсорбента газ из него выделяется, и система возвращается в исходное состояние.
Задача
4.6. Один моль идеального газа находится
в эластичной оболочке, с внешней стороны
которой действует постоянное давление.
Показать, что при подводе к этому газу
некоторого количества теплоты ![]() произойдет
его расширение, приводящее, в соответствии
с принципом Ле-Шателье - Брауна, к
уменьшению изменения его температуры
произойдет
его расширение, приводящее, в соответствии
с принципом Ле-Шателье - Брауна, к
уменьшению изменения его температуры ![]() по
сравнению с изменением температуры
по
сравнению с изменением температуры ![]() ,
которое имело бы место при неизменном
объеме газа:
,
которое имело бы место при неизменном
объеме газа: ![]() .
Проанализировать случай, когда в этой
оболочке находится фотонный газ.
.
Проанализировать случай, когда в этой
оболочке находится фотонный газ.
Решение: Для одного моля идеального газа в случае изобарического процесса изменение температуры может быть вычислено по формуле
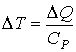 ,
,
а для изохорического - соответственно определяется выражением
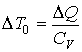 .
.
Из этих формул имеем:
 .
.
Так
как ![]() ,
то
.
Из этого следует, что в рассматриваемой
термодинамической системе при внешнем
воздействии (подводе теплоты) возникает
процесс (расширение газа), приводящий
к уменьшению влияния внешнего возмущения:
изменение температуры газа меньше,
чем, если бы расширение не возникало.
,
то
.
Из этого следует, что в рассматриваемой
термодинамической системе при внешнем
воздействии (подводе теплоты) возникает
процесс (расширение газа), приводящий
к уменьшению влияния внешнего возмущения:
изменение температуры газа меньше,
чем, если бы расширение не возникало.
Если
в оболочке находится фотонный газ,
уравнение состояния которого имеет
вид: ![]() ,
то при подводе теплоты в изобарическом
процессе при
,
то при подводе теплоты в изобарическом
процессе при ![]() ,
изменение температуры не происходит:
,
изменение температуры не происходит: ![]() .
А для изохорического процесса, учитывая
выражение для внутренней энергии
фотонного газа:
.
А для изохорического процесса, учитывая
выражение для внутренней энергии
фотонного газа: ![]() ,
можно записать
,
можно записать
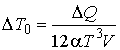 ,
,
где
изменение температуры
считается
малым, по сравнению с температурой
газа ![]() :
: ![]() .
.
Таким образом, происходящие в системе процессы могут не только уменьшить влияние внешнего воздействия, но и скомпенсировать его полностью. Из рассмотренного примера фотонного газа в эластичной оболочке следует, что для такой термодинамической системы подвод теплоты не приводит к увеличению её температуры.
Французский учёный поведал миру о законе динамического равновесия в 1884 году. Для конца девятнадцатого века открытие было весьма существенным и сразу привлекло внимание научной общественности. Но в силу отсутствия международного научного сотрудничества полтора века назад о научном прорыве Ле Шателье знали только его соотечественники. В 1887 году о смещении химического равновесия при изменении внешних условий сказал немецкий учёный Карл Фердинанд Браун, самостоятельно открывший тот же научный закон, будучи неосведомлённым об открытии француза. Не случайно данный принцип часто называют принцип Ле Шателье – Брауна.
Так в чём же заключается принцип Ле Шателье?
Находящиеся в равновесии системы всегда стремятся сохранить своё равновесие и противодействовать внешним силам, факторам и условиям. Данное правило действует для любых систем и для любых процессов: химических, электрических, механических, тепловых. Особую практическую значимость принцип Ле Шателье имеет для обратимых химических реакций.
Воздействие температуры на скорость протекания реакции находится в непосредственной зависимости от вида реакции по тепловому эффекту. С повышением температуры наблюдается смещение равновесия в сторону эндотермической реакции. Понижение температуры, соответственно, приводит к смещению химического равновесия в сторону экзотермической реакции. Причина этому видится в том, что при выведении системы из равновесия внешними силами она переходит в состояние меньшей зависимости от факторов извне. Зависимость эндотермических и экзотермических процессов от состояния равновесия выражается уравнением Вант-Гоффа:
V2 = V1*y (T2-T1)/10,
где V2 – это скорость химической реакции при изменённой температуре, V1 – исходная скорость реакции, у – показатель температурной разницы.
Шведский ученый Аррениус вывел формулу экспоненциальной зависимости скорости реакции от температурного режима.
К = А•е (-Е(RT)), где Е - энергия активации, R - универсальная газовая постоянная, T- температура в системе. Величина А является константой.
С увеличением давления наблюдается смещение химического равновесия в том направлении, где вещества занимают меньший объём. Если объём исходных веществ больше объёма продуктов реакции, то равновесие смещается в сторону исходных компонентов. Соответственно, если объём продуктов реакции превышает объём реагентов, то равновесие смещается в сторону получившихся химических соединений. При этом предполагается, что каждый моль газа занимает одинаковый объём при нормальных условиях. Но изменение давления в системе не всегда влияет на химическое равновесие. Принцип Ле Шателье показывает, что добавление в реакцию инертного газа меняет давление, но не выводит систему из равновесия. При этом для реакции значимо только то давление, которое связано с реагирующими веществами (гелий не имеет свободных электронов, он не вступает во взаимодействие с веществами в системе).
Добавление в реакцию определенного количества какого-либо вещества приводит к смещению равновесия в сторону того процесса, где этого вещества становится меньше.
Равновесие имеет динамический характер. Оно «нарушается» и «выравнивается» естественным путём в процессе протекания реакции. Объясним это положение через пример. При гидрировании раствора брома образуется бромоводородная кислота. Наступает момент, когда конечного продукта образуется слишком много, его объём превышает совокупный объём мономолекул водорода и брома, скорость реакции замедляется. Если добавить в систему водород или бром, то реакция пойдёт в обратном направлении.
