
- •Экология. Основные понятия. Определения.
- •Экосистемы. Разновидности экосистем.
- •Экология: нормативная база. Примеры.
- •1. Закон минимума ю. Либиха.
- •2. Закон толерантности шелфорда.
- •3. Закон экологической сукцессии.
- •4. Закон гомеостаза.
- •5. Закон квантитативной компенсации.
- •6. Законы б.Коммонера.
- •1) Все связано со всем,
- •2) Все должно куда-то деваться,
- •3) Ничто не дается даром,
- •Правило ле шателье – браун.
- •Экологические факторы. Классификация. Разновидности.
- •Экология и иерархия естественных наук, уровни знаний.
- •7. Окружающая среда, атмосфера, ее состав.
- •Окружающая среда, атмосфера, основные процессы.
- •Особенности химических процессов в атмосфере
- •Воздух, которым мы дышим
- •9. Атмосфера, структура, характер изменения температуры и давления с высотой. Причины.
- •10. Атмосфера: поглощение солнечного излучения. Парниковый эффект, парниковые газы. Примеры.
- •11. Атмосфера, основные процессы, фотохимический смог.
- •Особенности химических процессов в атмосфере
- •Атмосфера
- •Воздух, которым мы дышим
- •Фотохимический смог.
- •12.Атмосфера, как кибернетическая система, функциональная схема.
- •Оболочка планеты: химические частицы, разновидности, примеры участия в процессах.
- •Экология большого города: атмосфера.
- •Окружающая среда: гидросфера, состав.
- •Природные воды, их качество, основные показатели, классификация.
- •Качество природной воды
- •17.Гидросфера, как кибернетическая система. Перенос вещества. Химические процессы в гидросфере
- •Особенности химических процессов в гидросфере
- •18. Загрязнение, загрязнители. Примеры.
- •Загрязнение и загрязнители окружающей среды
- •Загрязнения
- •19. Естественные и искусственные источники загрязнения.
- •Естественные источники загрязнения
- •В улканы
- •Антропогенные источники загрязнения
- •Загрязнения
- •20.Загрязнение среды обитания: коррозия. Примеры.
- •Вулканическая деятельность, неорганические и органические загрязнения.
- •В улканы
- •22.Локальная среда обитания. Основные источники загрязнения, упаковка лекарственных препаратов.
- •Наиболее опасные вещества и факторы воздействия
- •23.Загрязнение жидких лекарственных препаратов от контейнеров для их хранения: причины, последствия.
- •24. Загрязнители: разновидности, источники, нейтрализация.
- •25. Коррозия- один из основных источников загрязнения окружающей среды соединениями металлов. Примеры.
- •Техносфера, техногенез. Примеры.
- •27. Биосфера – особая оболочка планеты
- •Некоторые особенности биосферы
- •Биосфера, состав, основные процессы.
- •Химические процессы в биосфере
- •Примеры химических и фотохимических процессов в биосфере
- •29. Биота, основные функции живого вещества.
- •30.Биосфера, биота, накопление химических элементов. Примеры. Разведанные запасы некоторых химических элементов и их ежегодное
- •31.Литосфера: состав, почва, удобрение.
- •Литосфера, минералы биологического происхождения.
- •Химические процессы в литосфере
- •37. Взаимосвязь оболочек планеты. Примеры.
- •38. Оболочки планеты: окислительно-восстановительные процессы. Примеры.
- •39. Процессы гидролиза в оболочках планеты. Примеры.
- •40. Оболочки планеты: Принцип Ле Шателье Брауна.
- •41. Токсичность: нормативная база, основные положения. Примеры.
- •42.Пищевые добавки и безопасность жизнедеятельности. Примеры.
- •43.Токсичность, разновидности токсичных веществ. Примеры.
- •Супертоксиканты:
- •Нейтрализация токсичных веществ
- •44.Токсичность, основные положения накопление соединений в костных и мягких тканях. Примеры.
- •45. Пищевые добавки, функциональные классы, характеристика, токсичность.
- •П ищевые добавки Пищевые добавки и химические соединения
- •Взаимодействие между постоянным и переменным составом оболочек планеты. Примеры.
- •Коррозия алюминия в кислотах
- •48. Кибернетические системы. Океанические циркуляции.
- •Гидросфера.
- •Функциональная схема подсистемы «океанические циркуляции»
- •50.Системный подход к рассмотрению оболочек планеты. Примеры.
- •51. Экология и кибернетика. Кибернетические системы.
- •Причины:
- •Примеры построения функциональных схем для систем различного уровня Общий подход (алгоритм)
- •52.Большой город. Автотранспорт.
- •53.Экология большого города: химический фактор. Примеры. Экология городов
- •54.Экология большого города: население, влияющие факторы. Примеры.
- •Зоны воздействия экологического фактора на организм
- •55.Основные экологические проблемы и пути их решения.
- •1. Зеленые насаждения:
- •2. Полезные ископаемые:
- •3. Охрана земель:
- •Приложение 4 Данные по гигиеническому нормированию
- •Приложение 5 Данные по пдк некоторых веществ в водоемах
- •Приложение 7 Классификация воды по качеству
- •Приложение 8 Данные по качеству вод, используемых для питьевого снабжения в различных странах
- •Приложение 9 Санитарные нормы допустимых концентраций для некоторых химических веществ в почве
- •I28. Современное об-во и его воздействие на биосферу и ч-ка.
- •11. Ограниченность лесных ресурсов.
- •33. Стратегия выхода из эколог.Кризиса.
- •4.4 Влияние радиоактивных веществ
- •2. Доклады Римскому клубу.
- •Понятие ресурсы.
- •26. История формирования эколог. Ниш человека
- •17. 18. Климатические последствия загрязнения атмосферы.
- •Парниковый эффект.
- •Озоновый экран Земли
- •Принцип Ле-Шателье - Брауна
- •Естествознание как иерархия наук о природе
- •Атмосфера Земли, ее строение, состав и экологическое значение
- •Экология атмосферы, гидросферы, педосферы
- •Загрязнение атмосферы
- •Техногенез: глобальные и региональные проявления
- •Строение атмосферы
- •Загрязнение атмосферного воздуха
- •Защита атмосферного воздуха от загрязнения
- •Фотохимический смог
- •Токсиканты и их специфические биогеохимические особенности
- •Понятие токсичности и канцерогенности элементов и соединений
- •3.2. Токсиканты и их специфические биогеохимические особенности
- •3.3. Понятие токсичности и канцерогенности элементов и соединений
- •. Защита атмосферы
- •2. Основная нормативно-правовая база экологического менеджмента
- •Нормативно-правовая база пноолр Требования законодательства рф к проекту пноолр
- •Стандарты и сНиП
- •Санитарные, строительные нормы и правила
- •Рекомендации, методические указания, инструкции
- •Сильнодействующие ядовитые вещества (сдяв) Влияние сильнодействующих отравляющих веществ на организм
- •3. Правила хранения
- •4. Возможные изменения при несоблюдении правил хранения
45. Пищевые добавки, функциональные классы, характеристика, токсичность.
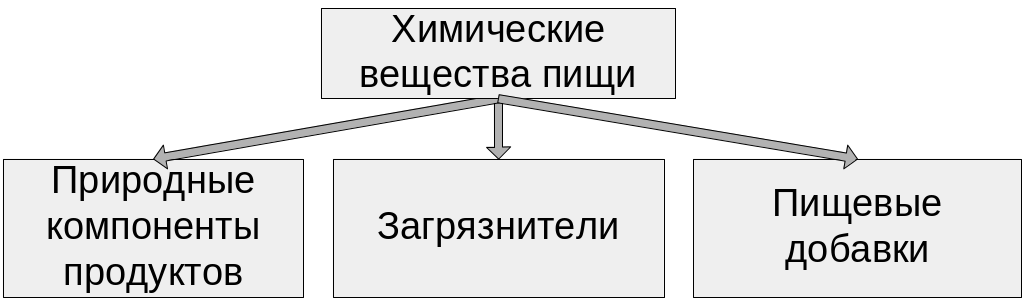
П ищевые добавки Пищевые добавки и химические соединения
П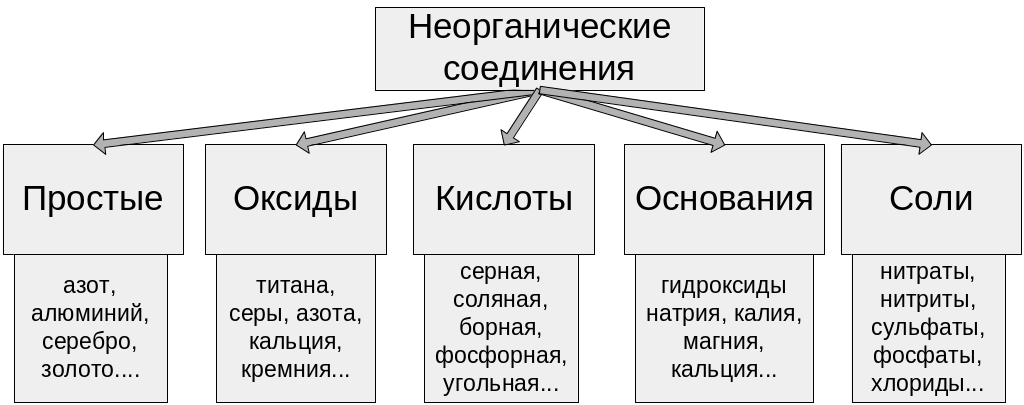 ищевые
добавки
– природные или синтетические вещества,
преднамеренно вводимые в пищевые
продукты (продукты питания) с целью
придания им определенных заданных
свойств и не употребляемые сами по себе
в качестве пищевых продуктов или обычных
компонентов пищи.
ищевые
добавки
– природные или синтетические вещества,
преднамеренно вводимые в пищевые
продукты (продукты питания) с целью
придания им определенных заданных
свойств и не употребляемые сами по себе
в качестве пищевых продуктов или обычных
компонентов пищи.

Органические соединения и пищевые добавки
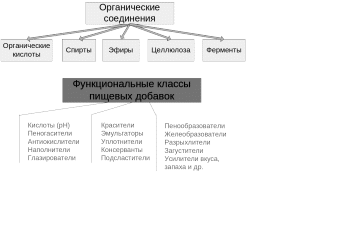
Состояние пищевых добавок в продуктах:
– полностью в неизменном виде;
– частично в неизменном виде;
– в виде новых веществ, образующихся в результате взаимодействия добавок с компонентами пищевых продуктов.
Большинство добавок не имеют, как правило, пищевого значения и в лучшем случае являются биологически инертными для организма, а в худшем – оказываются биологически активными и небезразличными для организма.
E – обозначение пищевых добавок, разработанных в Европе. Трехзначное число, следующее за буквой Е – код соответствующей добавки. Например, Е152 – активированный уголь, Е173 – мелкодисперсный алюминий.
Из добавок серии Е различают:
– разрешенные пищевые добавки (их большинство);
– не разрешенные в России (не завершен комплекс их испытаний). Их достаточно много (Е103, Е107, Е125, Е173-175, Е209, Е303, Е408, Е512, Е906 и др.);
– запрещенные в России (Е121, Е123, Е240 и др.).
Взаимодействие между постоянным и переменным составом оболочек планеты. Примеры.
Рассмотрим взаимодействие между оболочками планеты на примере атмосферы.
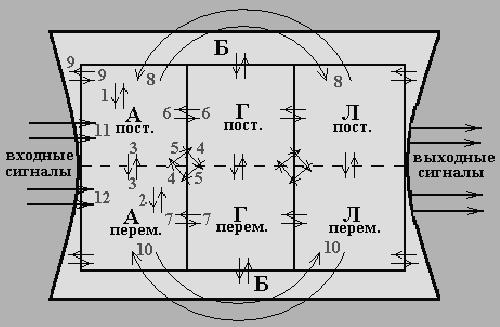
1 .
Взаимодействие между постоянным составом
атмосферы:
.
Взаимодействие между постоянным составом
атмосферы:
N2 2N; N + O2 → NO2
2. Взаимодействие между переменным составом атмосферы:
SO2 + H2O2 → H2SO4
3. Взаимодействие между постоянным и переменным составом атмосферы:
SO2 + O2 → SO3
4. Взаимодействие между переменным составом атмосферы и постоянным составом гидросферы:
SO2 + H2O → H2SO3
5. Взаимодействие между постоянным составом атмосферы и переменным составом гидросферы:
CaCO3 + CO2 + H2O = Ca(HCO3)2
6. Взаимодействие между постоянным составом гидросферы и постоянным составом атмосферы:
H2O + NO2 → HNO3 + HNO2
7. Взаимодействие между переменным составом гидросферы и переменным составом атмосферы:
CO + HO• → CO2 + H•
8. Взаимодействие между постоянным составом атмосферы и постоянным составом литосферы:
Na2S + O2 → Na2SO4
9. Взаимодействие между постоянным составом биосферы и постоянным составом литосферы:
(CH2O)106(NH3)16H3PO4 + 138O2 = 106CO2 +
122H2O + 16HNO3 + H3PO4
10. Взаимодействие между переменным составом литосферы и переменным составом гидросферы:
CaO + CO2 → CaCO3
11. Влияние внешнего сигнала на процесс с основным составом атмосферы:
O2 O + O*
12. Влияние внешнего сигнала на процесс с переменным составом атмосферы:
NO NO+ + e-
47.Коррозия алюминия (+ раствор щелочи, + раствор HCI, H2SO4, HNJ3
+ раствор соли NO2 S, Cu (NO3)2
Коррозия алюминия – разрушение металла под влиянием окружающей среды Для реакции Al3+ +3e → Al стандартный электродный потенциал алюминия составляет -1,66 В. Температура плавления алюминия - 660 °C. Плотность алюминия - 2,6989 г/см3 (при нормальных условиях). Алюминий, хоть и является активным металлом, отличается достаточно хорошими коррозионными свойствами. Это можно объяснить способностью пассивироваться во многих агрессивных средах .Коррозионная стойкость алюминия зависит от многих факторов: чистоты металла, коррозионной среды, концентрации агрессивных примесей в среде, температуры и т.д. Сильное влияние оказывает рН растворов. Оксид алюминия на поверхности металла образуется только в интервале рН от 3 до 9!Очень сильно влияет на коррозионную стойкость Al его чистота. Для изготовления химических агрегатов, оборудования используют только металл высокой чистоты (без примесей), например алюминий марки АВ1 и АВ2. Коррозия алюминия не наблюдается только в тех средах, где на поверхности металла образуется защитная оксидная пленка. При нагревании алюминий может реагировать с некоторыми неметаллами: 2Al + N2 → 2AlN – взаимодействие алюминия и азота с образованием нитрида алюминия; 4Al + 3С → Al4С3 – реакция взаимодействия алюминия с углеродом с образованием карбида алюминия; 2Al + 3S → Al2S3 – взаимодействие алюминия и серы с образованием сульфида алюминия.
КОРРОЗИЯ АЛЮМИНИЯ В ЩЕЛОЧАХ Щелочи легко растворяют защитную оксидную пленку на поверхности алюминия, он начинает реагировать с водой, в результате чего металл растворяется с выделением водорода (коррозия алюминия с водородной деполяризацией). 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑; 2(NaOH•H2O) + 2Al → 2NaAlO2 + 3H2↑.Образуются алюминаты. Также оксидную пленку разрушают соли ртути, меди и ионы хлора
