
- •6. Приведите способ уменьшения гидролиза для этой соли.
- •6. Приведите способ уменьшения гидролиза для этой соли.
- •6. Приведите способ уменьшения гидролиза для этой соли.
- •6. Приведите способ уменьшения гидролиза для этой соли.
- •6. Приведите способ уменьшения гидролиза для этой соли.
- •6. Приведите способ уменьшения гидролиза для этой соли.
- •6. Приведите способ уменьшения гидролиза для этой соли.
- •6. Приведите способ уменьшения гидролиза для этой соли.
- •6. Приведите способ уменьшения гидролиза для этой соли.
- •6. Приведите способ уменьшения гидролиза для этой соли.
- •6. Приведите способ уменьшения гидролиза для этой соли.
- •6. Приведите способ уменьшения гидролиза для этой соли.
- •6. Приведите способ уменьшения гидролиза для этой соли.
6. Приведите способ уменьшения гидролиза для этой соли.
7. Рассчитайте рН раствора соли NН4NO3, если её концентрация равна 0,01 моль/дм3
Билеты к коллоквиуму по теме:
«Растворы неэлектролитов и электролитов»
Вариант 28.
1. В 200 см3 воды растворили 34,2 г неэлектролита. Раствор замерзает при температуре -1,860С (Ккр=1.86). Чему равна молярная масса растворённого вещества?
2. Рассчитайте константу диссоциации азотистой кислоты HNO2
если концентрация ионов Н+ в её 0,01-молярном растворе составляет 1,8·10-3моль/дм3 ?
3. Рассчитайте массу хлорной кислоты HClO4 в 1,5 дм3 её раствора, если рН=4?
4. Растворимость соли А2В3 равна 5,5 ·10-4 г/дм3, а молярная масса – 220 г/моль. Рассчитайте величину ПР этой соли.
5. Напишите ионное и молекулярное уравнения реакций гидролиза соли СdBr2.
6. Приведите способ уменьшения гидролиза для этой соли.
7. Рассчитайте рН раствора соли Li2SO3, если её концентрация равна 0,94 г/дм3.
Билеты к коллоквиуму по теме:
«Растворы неэлектролитов и электролитов»
Вариант 29.
1. При какой температуре будет кипеть раствор 90 г мочевины (карбамида) СО(NH2)2 в 02,50 кг метанола (эбуллиоскопическая постоянная Е=0,84; tкип=64,70С).
2. Константа диссоциации бензойной кислоты С6Н5СООН равна Кдис.= 2,0·10-5. Какова концентрация ионов Н+ в её 0,1-молярном растворе?
3. Чему равна концентрация КОН в водном растворе, имеющем рН =13?
4. Растворимость гидроксида Ме(ОН)2 равна 5,7·10-2 г/дм3. а молярная масса – 190 г/моль. Чему равна величина ПР это соли?
5. Напишите ионное и молекулярное уравнения реакций гидролиза солей и ВаF2.
6. Приведите способ уменьшения гидролиза для этой соли.
7. Рассчитайте рН раствора соли BiCl3, если её концентрация равна 0,001моль/л.
Билеты к коллоквиуму по теме:
«Растворы неэлектролитов и электролитов»
Вариант 30.
1. При какой температуре будет кипеть раствор 8,55 г сахарозы С12Н22О11 в 100 г воды (эбуллиоскопическая постоянная Е=0,52 )?
2. Определите концентрацию ионов Н+ в 0,1-молярном растворе бромноватистой кислоты НОВr, если константа диссоциации этой кислоты Кд= 2,1·10-9.
3. В 0,25 дм3 раствора КОН содержится 0,014 г данного основания. Вычислите величину рН данного раствора.
4. Растворимость соли АВ2 в воде равна 2,8·10-3 г/дм3, а молярная масса – 56 г/моль. Рассчитайте величину ПР.
5. Напишите ионное и молекулярное уравнения реакций гидролиза соли KNО2.
6. Приведите 3 способа уменьшения гидролиза этой соли.
7. Рассчитайте рН раствора соли ZnSO4, если её концентрация равна 0,008 моль/л .
Ответы и решения к билетам для коллоквиума
«Водные растворы электролитов и неэлектролитов»
1) Формулы для решения задач №1:
∆Тзам.=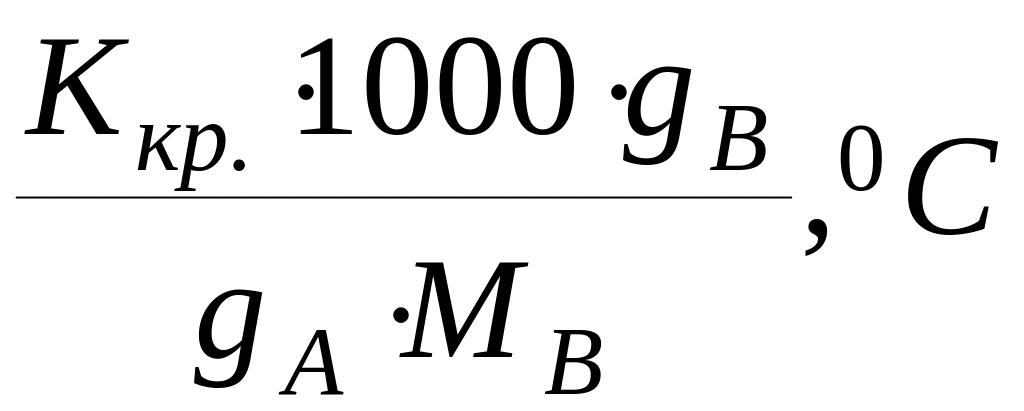 ;
;
∆Ткип.
=
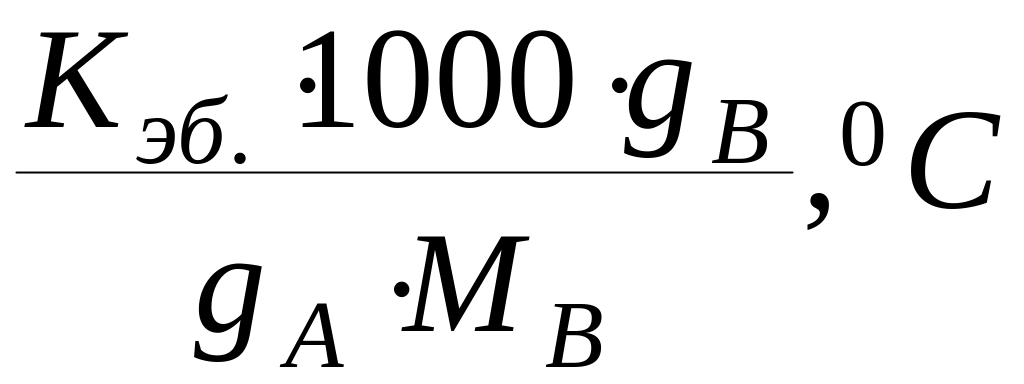 ,
откуда Мв
=
,
откуда Мв
=
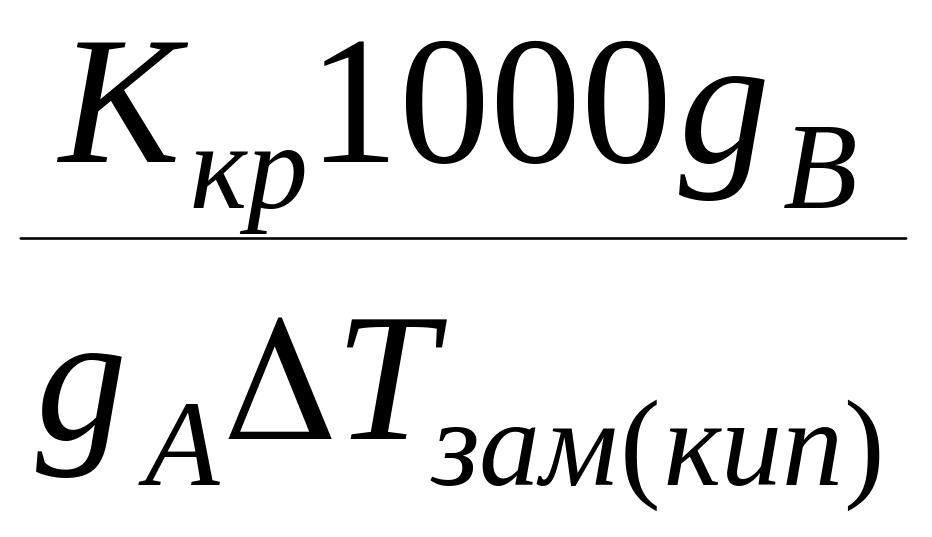
![]()
где gB - масса растворённого в-ва;
gA - масса растворителя;
МВ - молярная масса растворённого в-ва;
Ккр- криоскопическая постоянная;
Кэб. – эбуллиоскопическая постоянная;
∆Тзам - понижение температуры замерзания;
∆Ткип. – повышение температуры кипения.
2) Формулы для вопросов №№2,3:
рН кислот и оснований
Для сильных кислот
рН=-lgcкис
; для слабых кислот рН=![]() .
.
Для сильных оснований рН = 14 + lgCщёл.;
для слабых оснований
рН = 14 +![]()
3) Формулы для вопросов № 3:
![]()
4) Формулы для вопросов №№5,6:
рН гидролиза солей:
при гидролизе
по катиону рНгидр.
=
![]()
при гидролизе
по аниону рНгидр.
=
![]()
ОТВЕТЫ.
Вариант 1
1) -1,860С;
2) 1,35·10-3;
3) 3;
4) 4·10-9;
5) Na2S →2Na+ + S2-.
Na2S + H2O ↔ NaHS + NaOH
S2- + H2O = HS- + OH-;
6) добавить щелочи;
7) pH=4,7.
Вариант 2
1) 57,5;
2) 5,11·10-4;
3) 9,7;
4) 4·10-18.
5) FeCl3 + H2O↔ FeOHCl2 + HCl;
Fe3+ + H2O ↔ FeOH+2 + H+
6) подкислить раствор соли;
7) pH=9,44.
Вариант 3
1) -3,3Со;
2) 2,8·10-6;
3) 1,·10-6;
4) 4·10-21
5) NH4+ + H2O ↔ NH4OH + H+;
NH4NO3 + H2O ↔ NH4OH + HNO3
6) подкислить раствор соли;
7) pHгидр. =8,17.
Вариант 4
1) 100,730С,;
2) 5,04·10-8
3) рН = 11,7;
4) ПР = 4·10-15;
5) ВО22- + Н2О ↔ НВО2 + ОН-
КВО2 + Н2О ↔НВО2 + КОН
6) добавить в раствор соли щёлочь;
7) рН = 2,65
Вариант 5
1) МВ=342г/моль;
2) 2,22·10-5;
3) рН=2;
4) ПР = 3,2·10-17
5) Zn(NO3)2 + H2O ↔ ZnOHNO3 + HNO3
Zn2+ + H2O ↔ ZnOH + + H+
6) Подкислить раствор соли.
7) рНгидр. = 11,48
Вариант 6
1) Тзам.= - 0,930С;
2)Скисл.=![]() =
0,0015 моль/л;
=
0,0015 моль/л;
3) рН=11,7;
4) ПР = 3,2·10-20;
5) РО43- + Н2О ↔ НРО42- + ОН-;
Na3PO4 + H2O ↔ Na2HPO4 + NaOH
6) Добавить в раствор соли щёлочь.
7) pH =3,71
Вариант 7
1) Тзам. = - 2,790С ;
2) 1,45·10-5;
3) рН=12;
4) ПР = 2,7·10-19
5) Al3+ + H2O ↔ AlOH 2+ + H+;
Al(NO3)3 + H2O ↔ ALOH(NO3)2 + HNO3
6) Подкислить раствор соли.
7pH =11,25.
Вариант 8
1) Ткип = 36,140С;
2) Кдис.= 9,7·10-4;
3) С=10-4моль/л;
4) ПР = 1,1·1023
5) F- + H2O ↔ HF + OH-; KF + H2O ↔ HF + KOH.
6) Добавить щёлочи в раствор соли.
7) рНгидр. = 1,72
Вариант 9
1) Тзам. = - 7,440С;
2) С = 4,24·10-3;
3) рН=2,7;
4) ПР = 3,2·10-5
5) CH3COONH4 + H2O ↔ CH3COOH + NH4OH
6) Охладить раствор соли.
7) рНгидр.
= 14 + 0,5lg![]() =
14-3,5=10,5
=
14-3,5=10,5
Вариант 10
1) Ткип. = 100,830С;
2) Кдис. = 3,24·10-4;
3) рН=11,0;
4) ПР = 4·10-12
5) СО32- + Н2О↔НСО3- + ОН-
Nа2CО3 + H2O ↔ NаH CО3 + NаOH
6) Добавить щёлочи в раствор соли.
7) рНгидр. = 14 + 0,5lg = 10,5
Вариант 11
1) Тзам. = +3,50С;
2)
![]() дис.
= 4,24·10-2;
дис.
= 4,24·10-2;
3) 0,05 г;
4) ПР = 4·10-15
5) Fe3+ Н2О↔FeOH+2 + Н+
FeBr3 + H2O ↔ FeOHBr2 + HBr
6) Добавить в раствор соли кислоты.
7) рНгидр.
= 14 + 0,5lg![]() =
9,25
=
9,25
Вариант 12
1) Тзам. = -7,170С;
2) дис. = 8,9·10-5;
3) 0,08 г;
4) ПР = 2,7·10-15
5) (РО4)3- + Н2О↔ (HРО4)2- + (ОН)-
Na3РО4+ H2O ↔ Na2HРО4 + NaOH
6) Добавить в раствор соли щёлочи.
7) рНгидр.
= - 0,5lg![]() =
6,12
=
6,12
Вариант 13
1) Ткип. = 100,260С;
2) дис. = 7·10-3;
3) 10-3;
4) ПР = 4·10-12
5) NH4 + Н2О ↔ NH4OH + Н+
NH4NO3 + H2O ↔ NH4OH + HNO3
6) Добавить в раствор соли кислоты.
7) рНгидр.
= 14 + 0,5lg![]() =
11,73
=
11,73
Вариант 14
1) Ткип = 65,20С;
2) 1,4·10-4 моль/л;
3) С=10-10 моль/л;
4) ПР = 3,2·10-11_
5) F- + H2O ↔ HF + OH- ;
KF + H2O ↔ HF + KOH.
6) Добавить щёлочи в раствор соли.
7) рНгидр. = 4,07
Вариант15
1) Ткип = 100,520С;
2) 1,4·10-4 моль/л;
3) pH=11;
4) ПР = 4·1012-
5) SO3 2- + H2O ↔ HSO3- + OH- ;
K2SO3 + H2O ↔ KHSO3 + KOH.
6) Добавить щёлочи в раствор соли.
7) рНгидр. = 3,65
Вариант16
1) М=342 г/моль;
2) 2,2·10-5 моль/л;
3) pH=1;
4) ПР = 3,2·10-17
5) Al3+ + H2O ↔ AlOH2+ + H+ ;
Al(NO3)3 + H2O ↔ AlOH(NO3)2 + HNO3.
6) Добавить кислоты в раствор соли.
7) рНгдр. = 12,98
Вариант17
1) Ткип = 100,520С;
2) Кдис = 4,0·10-4 моль/л;
3) pH=11;
4) ПР = 3,2·10-14
5) Fe 3+ + H2O ↔ FeOH+2 + H+ ;
Fe2(SO4)3 + H2O ↔ FeOHSO4 + H2SO4.
6) Добавить кислоты в раствор соли.
7) рНгидр. = 10,74
Вариант 18
1) Ткип = 102,360С;
2)
 2,81
·10-6 моль/л;
2,81
·10-6 моль/л;
3)![]()
4) ПР = 4,32·10-26
5) NH4+ + H2O ↔ NH4OH + H+ ;
(NH4)2SO3 + 2H2O ↔ NH4OH + H2SO3.
6) Добавить кислоты в раствор соли.
7) рНгидр. = 6,04
Вариант19
1) Ткип = 101,190С;
2) Кдис. = 5.04·10-8;
3) pH=11;
4) ПР = 5·10-16
5) NO2 - + H2O ↔ HNO2 + OH- ;
KNO2 + H2O ↔ HNO2 + KOH.
6) Добавить щёлочи в раствор соли.
7) рНгидр. = 3,72
Вариант20
1) М = 342 г/моль;
2) 3,83·10-4 моль/л;
3) pH=12;
4) ПР = 3,2·10-20
5) Zn 2+ + H2O ↔ ZnOH+ + H+ ;
2 ZnSO4 + 2 H2O ↔ (ZnOH)2SO4 + H2SO4
2 6) Добавить кислоты в раствор соли.
7) рНгидр.= 12.35
Вариант 21
1) Ткип = 57,50С;
2) Кдис.= 5,11·10-4;
3) pH=10;
4) ПР = 4,32·1022-
5) Al3+ + H2O ↔ AlOH2+ + H+ ;
AlCl3 + H2O ↔ AlOHCl2 + HCl.
6) Добавить кислоты в раствор соли.
7) рНгидр. =10.
Вариант 22
1) М=300;
2)Сон-=
·Сосн.=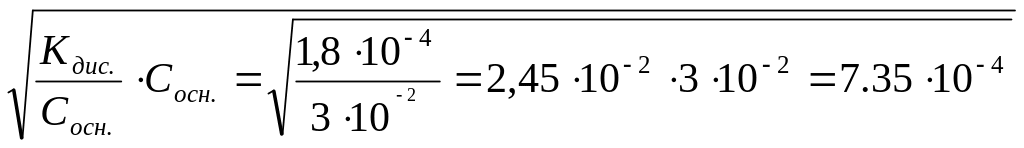 моль/л;
моль/л;
3) pH=3,3;
4) ПР
=
![]()
5) S2- + H2O ↔ HS- + OH- ;
K2S + H2O ↔ KHS + KOH.
6) Добавить щёлочи в раствор соли.
7) рНгидр. = 6.04
Вариант 23
1) Тзам = -1,3950С;
2) СН+ = 4,6·10-6 моль/л (решение по аналогии с 2) вар.22);
3) pH=14;
4)
![]()
5) Cd 2+ + H2O ↔ CdOH+ + H+ ;
Cd(NO3)2 + H2O ↔ CdOHNO3 + HNO3.
6) Добавить кислоты в раствор соли.
7) рНгидр. = 10,05
Вариант 24
1) Ткип = 36,140С;
2) Кдис.=9,67·10-4 ;
3) СКОН=10-1моль/л;
4) ПР = 3,375·10-25
5) F- + H2O ↔ HF + OH- ;
NaF + H2O ↔ HF + NaOH.
6) Добавить щёлочи в раствор соли.
7) рНгидр. = 5,72
Вариант25
1) ТЗАМ = 4,140С;
2) = 1,9·10-2 моль/л;
3) m=1,51г;
4) ПР = 3,2·1020-
5) SO3 2- + H2O ↔ HSO3- + OH- ;
K2SO3 + H2O ↔ KHSO3 + KOH.
6) Добавить щёлочи в раствор соли.
7) рНгидр. = 6,07
Вариант 26
1) Ткип = 100,520С;
2) =8,48·10-3 ;
3)
![]() =10-2моль/л;
=10-2моль/л;
4) ПР = 4,32·10-6;
5) NH4 + Н2О ↔ NH4OH + Н+
NH4NO3 + H2O ↔ NH4OH + HNO3
6) Добавить в раствор соли кислоты.
7) рНгидр. = 12,15
Вариант 27
1) Тзам = -6,780С;
2) =8,89·10-4 ;
3) m=1,0·10-3 г;
4) ПР = 4·10-18
5) ВO3 3- + H2O ↔ HВO32- + OH- ;
Na3BO3 +H2O ↔ Na2HВO3 + NaOH.
6) Добавить щёлочи в раствор соли.
7) рНгидр. = 6,13
Вариант 28
1) М = 171 г/моль
2) Кдис.= 3,24·10-4 ;
3) m=0,0151г HClO4;
4) ПР = 1,05·10 -26
5) Сd 2+ + H2O ↔ CdOH+ +H+ ;
CdBr2 + H2O ↔ CdOHBr + HBr.
6) Добавить кислоты в раствор соли.
7) рНгидр. = 9,6.
Вариант 29
1) Ткип = 65,20С;
2) 1,4·10-3 моль/л;
3) СКОН=0,1моль/л
4) ПР = 1,08·10-10
5) F - + H2O ↔ HF + OH- ;
KF + H2O ↔ HF + KOH.
6) Добавить щёлочи в раствор соли.
7) рНгидр. = 2,25
Вариант30
1) Ткип = 100,130С;
2) СН+= 1,45·10-5 моль/л;
3) pH=11;
4) ПР = 5·10-13
5) NO2 - + H2O ↔ HNO2 + OH- ;
KNO2 + H2O ↔ HNO2 + KOH.
6) Добавить щёлочи в раствор соли.
7) рНгидр. = 3,8
