
- •Значение периодического закона
- •2. Горение
- •3. Разложение.
- •4. Изомеризация.
- •2. Циклоалканы, их общая формула, строение, свойства, нахождение в природе, практическое значение.
- •1. Реакции окисления.
- •2. Реакции присоединения.
- •3. Реакции полимеризации.
- •2. Реакции присоединения
- •3. Полимеризация
- •1. Реакции окисления
- •2. Реакции присоединения
- •3. Полимеризация
- •1. Окисление.
- •2. Реакции замещения.
- •3. Реакции присоединения
- •1. Все атомы, образующие молекулы органических веществ, связаны в определённой последовательности согласно их валентности.
- •2. Свойства веществ зависят не только от того, какие атомы и в каком количестве входят в состав молекулы, но и от порядка соединения атомов в молекуле (то есть от химического строения).
- •3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы можно предвидеть свойства.
- •4. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
- •3. Изомерия положения функциональной группы.
- •4. Межклассовая изомерия.
- •2) По числу и составу исходных и образующихся веществ.
- •3) По тепловому эффекту.
- •4) По признаку обратимости.
- •4. Повышение температуры.
- •5. Катализаторы.
- •1. Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена.
- •1. Электрохимический ряд напряжений металлов. Вытеснение металлов из растворов солей другими металлами.
- •Свойства веществ в свете теории электролитической диссоциации. Ионные реакции.
- •2. Анилин взаимодействует с кислотами с образованием солей:
2. Анилин взаимодействует с кислотами с образованием солей:
C6H5–NH2 + HCl → C6H5NH3Cl (хлорид фениламмония)
2C6H5–NH2 + H2SO4→ (C6H5NH3)2SO4 (сульфат фениламмония)
Получение анилина в промышленности основано на реакции восстановления нитробензола, которую открыл русский учёный Н. Н. Зинин. Нитробензол восстанавливают в присутствии чугунных стружек и соляной кислоты. Вначале выделяется атомарный водород, который и взаимодействует с нитробензолом.
Fe + 2HCl → FeCl2 + H2
C6H5–NO2 + 6H → C6H5–NH2 + 2H2O
Применение
Анилин находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств.
Билет 22.
1.
Окислительно-восстановительные свойства серы и ее соединений.
Сера находится в главной подгруппе 6 группы. Степени окисления серы и примеры соединений:
-2 0 +4 +6
H2S S SO2 SO3
ZnS H2SO3 H2SO4
Na2SO3 Na2SO4
восстанов. восстановитель и окислитель
окислитель
В низшей степени окисления -2 сера проявляет восстановительные свойства:
2H2S +3O2→ 3SO2+2H2O
S-2 - 6e→ S-4
В степенях окисления 0 и +4 сера может быть и окислителем и восстановителем:
Zn+S →ZnS S0 +2e→ S-2 окислитель
S + O2 →SO2 S0 -4e→ S+4 восстановитель
2SO2+O2→2SO3 S+4 - 2e→ S+6 восстановитель
В степени окисления +6 сера является только окислителем:
2H2SO4+Cu→ CuSO4+2H2O+SO2 S+6 +2e→ S+4 окислитель
2.
Аминокислоты, их состав и химические свойства (взаимодействие с соляной кислотой, щелочами, друг с другом). Применение, биологическая роль.
Аминокислотами называются азотосодержащие органические вещества, молекулы которых содержат карбоксильную группу – COOH и аминогруппу – NH2.
NH2–CH2–COOH NH2–CH2–CH2–COOH
аминоуксусная. кислота β-аминопропиновая кислота
CH3-CH-COOH α-аминопропиновая кислота
NH2
Физические свойства
Аминокислоты – бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом.
Химические свойства
1. Кислотные свойства
а) Взаимодействие со щелочами
NH2–CH2–COOH + NaOH →NH2–CH2–COONa + H2O
б) Взаимодействие со спиртами
NH2–CH2–COOH + C2H5OH →NH2–CH2–COOC2H5 + H2O
2. Основные свойства
Взаимодействие с кислотами
NH2–CH2–COOH + HCl → NH3Cl–CH2–COOH
Аминокислоты – амфотерные вещества.
3. Аминокислоты взаимодействуют друг с другом
NH2–CH2–COOH + NH2–CH2–COOH → NH2–CH2–CO-NH–CH2–COOH + Н2О
дипептид
-СО–NH – пептидная группа (амидная группа)
Применение
Аминокислоты, преимущественно α-аминокислоты, необходимы для синтеза белков в живых организмах. Нужные для этого аминокислоты человек и животные получают в виде пищи, содержащей различные белки. Последние подвергаются в пищеварительном тракте расщеплению на отдельные аминокислоты, из которых затем синтезируются белки, свойственные данному организму. Некоторые аминокислоты применяются в медицинских целях. Многие аминокислоты служат для подкормки животных.
Производные аминокислот используются для синтеза волокна, например капрона.
Билет 23.
1.
Железо: положение в периодической системе химических элементов Д. И. Менделеева, строение атома, возможные степени окисления, физические свойства, взаимодействие с кислородом, галогенами, растворами кислот и солей. Сплавы железа.
В периодической системе железо находится в четвёртом периоде, в побочной подгруппе VIII группы.
Химический знак – Fe (феррум). Порядковый номер – 26,
Валентные электроны у атома железа находятся на последнем и предпоследнем электронных слоях. В химических реакциях железо может отдавать эти электроны и проявлять степени окисления +2, +3 и иногда +6.
Fe+2 FeO Fe(OH)2 основный характер
Fe+3 Fe2O3 Fe(OH)3 амфотерный характер
Физические свойства железа. Чистое железо пластичный металл серебристо-белого цвета, проводит электрический ток. Плотность железа 7,87 г/см3, температура плавления 1539 C. В отличие от многих других металлов железо легко подвергается коррозии, способно намагничиваться.
Химические свойства железа.
Железо взаимодействует с неметаллами:
2Fe + 3Cl2 = 2FeCl3 хлорид железа (III).
2Fe + 3O2 = Fe2O3
Из растворов солей железо вытесняет металлы, которые расположены правее его в электрохимическом ряду напряжений:
Fe + CuSO4 = FeSO4 + Cu,
Fe0 + Cu2+ = Fe2+ + Cu0.
Железо реагирует с разбавленной серной и соляной кислотами, вытесняя из них водород:
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
Fe0 + 2H+ = Fe2+ + H20
Сплавы железа. Важнейшие сплавы железа – чугун и стали – являются основными конструкционными материалами практически во всех отраслях современного производства. Чугун – сплав железа с углеродом, хрупкий. Большую часть выплавленного чугуна перерабатывают в стали. Сталь пластична, её можно ковать, содержание углерода в стали – менее 1,4%. Легированные стали содержат хром, никель и другие добавки. Эти стали обладают высокой пластичностью, прочностью, стойкостью к действию окислителей (не ржавеют).
2.
Взаимосвязь между важнейшими классами органических соединений (раскрыть на примере превращений: предельный углеводород→ непредельный углеводород →альдегид → предельная одноосновная карбоновая кислота →сложный эфир).
1 2 3 4
СН4 → СН≡СН → СН3СНО → СН3СООН → СН3СООС2Н5
метан ацетилен ацетальдегид уксусная кислота этиловый эфир
t уксусной кислоты
1. 2СН4 → СН≡СН + 3Н2
2. СН≡СН + Н2О → СН3СНО
3. СН3СНО + Ag2O → СН3СООН + 2Ag
4. СН3СООН + C2H5OH → СН3СООС2Н5 + H2O (реакция этерификации)
Билет 24.
1.
Промышленный способ получения серной кислоты: научные принципы данного химического производства. Защита окружающей среды от химических загрязнений.
Сырьём для производства серной кислоты могут служить минералы, содержащие серу: самородная сера S, серный колчедан FeS2 и другие.
Первая стадия – получение оксида серы (IV) SO2:
S+O2→ SO2
4FeS2+ 11O2→2Fe2O3+8SO2 +Q (обжиг серного колчедана – пирита)
Для ускорения процесса используется чистый кислород, для увеличения поверхности соприкосновения веществ пирит измельчают и реакцию проводят в «кипящем слое».
2. Вторая стадия – окисление SO2 в SO3:
2SO2+O2 2SO3
эта реакция обратимая, чтобы увеличить скорость реакции, вводят катализатор оксид ванадия V2O5 и повышают давление. 3. Третья стадия – образование серной кислоты:
SO3 + H2O H2SO4.
Если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную серную кислоту.
Экологические проблемы: загрязнение атмосферы оксидами серы и пылью. Во избежание этого герметизируют аппаратуру, создают специальные фильтры.
2.
Белки как биополимеры. Свойства и биологические функции белков.
Белки – это биополимеры, состоящие из остатков α-аминокислот, соединённых между собой пептидными связями (-CO-NH-). Белки входят в состав клеток и тканей всех живых организмов. В молекулы белков входит 20 остатков различных аминокислот.
Структура белка
Белки обладают неисчерпаемым разнообразием структур.
Первичная структура белка – это последовательность аминокислотных звеньев в линейной полипептидной цепи.
Вторичная структура – это пространственная конфигурация белковой молекулы, напоминающая спираль, которая образуется в результате скручивания полипептидной цепи за счёт водородных связей между группами: CO и NH.
Третичная структура – это пространственная конфигурация, которую принимает закрученная в спираль полипептидная цепь.
Четвертичная структура – это полимерные образования из нескольких макромолекул белка.
Физические свойства
Свойства белков весьма разнообразны, которые они выполняют. Одни белки растворяются в воде, образуя, как правило, коллоидные растворы (например, белок яйца); другие растворяются в разбавленных растворах солей; третьи нерастворимы (например, белки покровных тканей).
Химические свойства
1. Денатурация – разрушение вторичной, третичной структуры белка под действием различных факторов: температура, действие кислот, солей тяжёлых металлов, спиртов и т.д.
2. Качественные реакции на белки:
а) При горении белка – запах палёных перьев.
б) Белок +HNO3 → жёлтая окраска
в) Раствор белка +NaOH + CuSO4 → фиолетовая окраска
3. Гидролиз
Белок + Н2О → смесь аминокислот
Функции белков в природе:
каталитические (ферменты);
регуляторные (гормоны);
структурные (кератин шерсти, фиброин шелка, коллаген);
двигательные (актин, миозин);
транспортные (гемоглобин);
запасные (казеин, яичный альбумин);
защитные (иммуноглобулины) и т.д.
Билет 25.
1.
Причина многообразия неорганических и органических веществ; взаимосвязь веществ.
1.Многообразие неорганических веществ.
а) Химические элементы образуют как простые, так и сложные вещества. Для многих простых веществ известны их аллотропные формы существования: углерод — в форме графита и алмаза, фосфор белый и красный и т.д. В настоящее время известно около 400 аллотропных видоизменений простых веществ. б) Многообразие сложных веществ обусловлено их различным качественным и количественным составом. Например, известно для азота пять форм оксидов: N2O, NO, N2O3, NO2, N2O5; для водорода две формы: Н2О и Н2О2 и др.
2. Многообразие органических веществ.
Органических веществ в настоящее время известно более 15 миллионов, в то время как неорганических веществ насчитывается несколько сотен тысяч.
Многообразие органических веществ объясняется следующим: Атомы углерода способны соединяться с атомами большого числа других химических элементов. Атомы углерода способны соединяться друг с другом в цепи различной длины и строения:
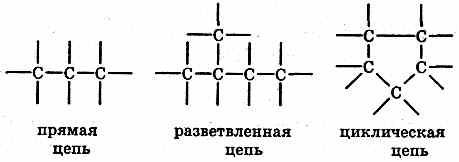 При
этом углеродные атомы связываются друг
с другом с помощью простых (одинарных),
двойных и тройных химических связей,
например:
При
этом углеродные атомы связываются друг
с другом с помощью простых (одинарных),
двойных и тройных химических связей,
например:
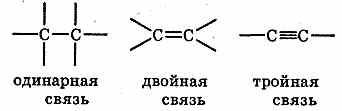 Однако,
несмотря на различие в свойствах
органических и неорганических соединений,
резкой грани между ними не существует.
Ярким примером является синтез
органических веществ из неорганических.
Однако,
несмотря на различие в свойствах
органических и неорганических соединений,
резкой грани между ними не существует.
Ярким примером является синтез
органических веществ из неорганических.
2.
Общая характеристика высокомолекулярных соединений: состав, строение, реакции, лежащие в основе их получения (на примере полиэтилена или синтетического каучука).
Высокомолекулярными соединениями (ВМС) или полимерами называются вещества, имеющие большую молекулярную массу, состоящую из множества повторяющихся структурных звеньев. Существуют природные полимеры (крахмал, белки, целлюлоза, каучук) и синтетические полимеры (полиэтилен, фенопласты). Низкомолекулярные вещества, из которых синтезируют полимеры, называются мономерами.
CH2=CH2 мономер полиэтилена - этилен
(-CH2-CH2-)n –молекула полимера
-CH2-CH2- – структурное звено – многократно повторяющаяся группа атомов
n – степень полимеризации (число звеньев в молекуле полимера)
Молекулярная масса полимера непостоянна и зависит от числа n. Макромолекулы полимеров могут иметь различную пространственную структуру:
Линейную (полиэтилен, полипропилен);
Разветвлённую (крахмал);
Пространственную (резина).
Физические свойства
Полимеры имеют высокую механическую прочность. Химически стойкие (с кислотами и щелочами не реагируют). Не имеют определённой температуры плавления, не растворяются в воде и в большинстве органических растворителей.
Синтез полимеров
Полимеры синтезируют двумя способами:
Реакцией полимеризации;
Реакцией поликонденсации.
Реакцией полимеризации называется процесс соединения молекул мономера в более крупные молекулы.
n CH2=CH2 → (-CH2-CH2-)n
этилен полиэтилен
Полиэтилен – полупрозрачный материал, жирный на ощупь, воздухо- и влагонепроницаем, легкоплавкий, химически стойкий, не гниёт, диэлектрик. Применяется для производства плёнок, труб, бытовых изделий (посуда, игрушки), электроизоляции, поверхностных покрытий.
Реакцией поликонденсации называется процесс получения высокомолекулярных веществ, идущих с выделением побочного низкомолекулярного продукта.
