- •Значение периодического закона
- •2. Горение
- •3. Разложение.
- •4. Изомеризация.
- •2. Циклоалканы, их общая формула, строение, свойства, нахождение в природе, практическое значение.
- •1. Реакции окисления.
- •2. Реакции присоединения.
- •3. Реакции полимеризации.
- •2. Реакции присоединения
- •3. Полимеризация
- •1. Реакции окисления
- •2. Реакции присоединения
- •3. Полимеризация
- •1. Окисление.
- •2. Реакции замещения.
- •3. Реакции присоединения
- •1. Все атомы, образующие молекулы органических веществ, связаны в определённой последовательности согласно их валентности.
- •2. Свойства веществ зависят не только от того, какие атомы и в каком количестве входят в состав молекулы, но и от порядка соединения атомов в молекуле (то есть от химического строения).
- •3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы можно предвидеть свойства.
- •4. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
- •3. Изомерия положения функциональной группы.
- •4. Межклассовая изомерия.
- •2) По числу и составу исходных и образующихся веществ.
- •3) По тепловому эффекту.
- •4) По признаку обратимости.
- •4. Повышение температуры.
- •5. Катализаторы.
- •1. Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена.
- •1. Электрохимический ряд напряжений металлов. Вытеснение металлов из растворов солей другими металлами.
- •Свойства веществ в свете теории электролитической диссоциации. Ионные реакции.
- •2. Анилин взаимодействует с кислотами с образованием солей:
1. Электрохимический ряд напряжений металлов. Вытеснение металлов из растворов солей другими металлами.
Электрохимический ряд напряжений металлов:
активные малоактивные неактивные
Li K Ba Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H Cu Hg Ag Pt Au
способность атомов отдавать электроны убывает
Ряд напряжений металлов справедлив лишь для реакций, протекающих в водных растворах.
Металлы в ряду напряжений расположены по убыванию их восстановительной способности в растворах. Ряд напряжений металлов позволяет определить возможность прохождения реакций металлов с растворами кислот, солей и водой.
Взаимодействие с водой:
2Na+2H2O→2NaOH+H2
Mg+2H2O→Mg(OH)2+H2
С водой с образованием основания и водорода взаимодействуют только активные металлы (стоящие в ряду напряжений до алюминия).
Взаимодействие с кислотами:
2Na+H2SO4→2Na2SO4+H2
Mg+2HCl→MgCl2+H2
Водород из кислот вытесняют металлы, стоящие в ряду напряжений до водорода.
Взаимодействие с растворами солей
Zn+CuSO4 →Cu+ZnSO4
Fe+2AgNO3→2Ag+Fe(NO3)2
Более активный металл (стоящий в ряду напряжений левее) вытесняет менее активный металл из раствора его соли.
Свойства веществ в свете теории электролитической диссоциации. Ионные реакции.
Химические свойства кислот |
|
1.кислота + металл (стоящий до водорода в ряду напряжений) |
2HCl + Mg MgCl2 + H2 2H+ + 2Cl- +Mg Mg2+ + 2Cl- + H2 2H+ + Mg Mg2+ + H2 |
2.кислота + основный оксид |
2HCl + MgO MgCl2 + H2O 2H+ + 2Cl- + MgO Mg2+ + 2Cl-+ H2O 2H+ +MgO Mg2+ + H2O |
3. кислота + основание |
HCl + NaOH NaCl + H2O H+ + Cl- + Na+ + OH- Na++ Cl- + H2O H+ +OH- H2O |
4. кислота + соль |
HCl + AgNO3 AgCl + HNO3 H+ + Cl- + Ag+ + NO3- AgCl + H+ +NO3- Ag+ + Cl- AgCl |
Химические свойства щелочей |
|
1.щёлочь + кислота |
NaOH + HCl NaCl + H2O Na+ + OH- + H+ + Cl- Na++ Cl- + H2O H+ + OH- H2O |
2.щёлочь + кислотный оксид |
2NaOH +CO2 Na2CO3 + H2O 2Na+ + 2OH- + CO2 2Na+ + CO32- + H2O 2OH- + CO2 CO32- + H2O |
3.щёлочь + соль |
2NaOH + MgCl2 Mg(OH)2 + 2NaCl 2Na+ + 2OH-+ Mg2++ 2Cl- Mg(OH)2 +2Na++2Cl- 2OH-+ Mg2+ Mg(OH)2 |
Химические свойства солей |
|
1.соль + металл |
Fe + CuSO4 FeSO4 + Cu Fe + Cu2+ +SO42- Fe2++ SO42- + Cu Fe + Cu2+ Fe2++ Cu |
2.соль + щёлочь |
2NaOH + MgCl2 Mg(OH)2 + 2NaCl 2Na++2OH- +Mg2++2Cl- Mg(OH)2 + 2Na++ 2Cl- 2OH- + Mg2+ Mg(OH)2 |
3.соль + кислота |
HCl + AgNO3 AgCl + HNO3 H+ + Cl- + Ag+ + NO3- AgCl + H+ + NO3- Ag+ + Cl- AgCl |
4.соль + соль |
NaCl +AgNO3 AgCl + NaNO3 Na+ + Cl- + Ag+ + NO3- AgCl + Na + +NO3- Ag+ + Cl- AgCl |
2.
Крахмал. Нахождение в природе, гидролиз крахмала, применение.
Крахмал (C6H10O5)n - аморфный порошок белого цвета, без вкуса и запаха, плохо растворим в воде, в горячей воде образует коллоидный раствор (клейстер). Макромолекулы крахмала построены из большого числа остатков α-глюкозы. Крахмал состоит из двух фракций: амилозы и амилопектина. Амилоза имеет линейные молекулы, амилопектин – разветвлённые.
Биологическая роль.
Крахмал – один из продуктов фотосинтеза, главное питательное запасное вещество растений. Крахмал – основной углевод в пище человека.
Получение.
Крахмал получают чаще всего из картофеля. Для этого картофель измельчают, промывают водой и перекачивают в большие сосуды, где происходит отстаивание. Полученный крахмал ещё раз промывают водой, отстаивают и сушат в струе теплого воздуха.
Химические свойства.
1. С иодом крахмал даёт фиолетовое окрашивание.
2. Крахмал – многоатомный спирт.
3. Крахмал сравнительно легко подвергается гидролизу в кислой среде и под действием ферментов:
(C6H10O5)n + nH2O → nC6H12O6
крахмал глюкоза
В зависимости от условий гидролиз крахмала может протекать ступенчато, с образованием различных промежуточных продуктов:
(С6H10O5)n → (C6H1005)x → (C6H1005)y→ C12H22O11 → nC6H12O6
крахмал растворимый декстрины мальтоза глюкоза
крахмал
Происходит постепенное расщепление макромолекул.
Применение крахмала.
Крахмал применяется в кондитерском производстве (получение глюкозы и патоки), является сырьём для производства этилового, н-бутилового спиртов, ацетона, лимонной кислоты, глицерина и так далее. Он используется в медицине в качестве наполнителей (в мазях и присыпках), как клеящее вещество.
Крахмал является ценным питательным продуктом. Чтобы облегчить его усвоение, содержащие крахмал продукты подвергают действию высокой температуры, то есть картофель варят, хлеб пекут. В этих условиях происходит частичный гидролиз крахмала и образуются декстрины, растворимые в воде. Декстрины в пищеварительном тракте подвергаются дальнейшему гидролизу до глюкозы, которая усваивается организмом. Избыток глюкозы превращается в гликоген (животный крахмал). Состав гликогена такой же, как у крахмала, – (C6H10O5)n, но его молекулы более разветвлённые.
Билет 20.
1.
Общие способы получения металлов.
Природные минералы и горные породы, содержащие металлы и пригодные для их промышленного получения, называются рудами. По составу большинство руд представляют собой оксиды.
1.Восстановление металлов из оксидов происходит разными способами:
1) восстановление углеродом:
2ZnO + C → 2Zn + CO2
восстановление оксидом углерода (II):
Fe2O3 + 3CO → 2Fe + 3CO2
восстановление водородом:
CuO + H2 → Cu + H2O
восстановление другими металлами (металлотермия):
Cr2O3 + Al → Al2O3 + Cr
2.Из растворов солей металлы можно выделить действием более активного металла:
CuSO4 + Fe → Cu + FeSO4
3. Для получения активных металлов используют электролиз растворов и расплавов солей. Электролиз – окислительно-восстановительный процесс, протекающий при прохождении электрического тока через электролит. Катод (отрицательный электрод) – восстановитель, анод (положительный электрод) – окислитель, он забирает электроны.
Если в расплав хлорида натрия опустить электроды и пропустить постоянный электрический ток, то на катоде выделится натрий, а на аноде – хлор:
NaCl Na++Cl-
катод (-) Na+ + 1e → Na0
анод (+) Cl- - 1e → Cl0 Cl0 + Cl0 → Cl2
Суммарный процесс: 2NaCl →2Na+Cl2
2.
Целлюлоза, состав, физические и химические свойства, применение. Понятие об искусственных волокнах на примере ацетатного волокна.
Целлюлоза (C6H10O5)n – природный полимер, полисахарид, состоящий из остатков β-глюкозы, молекулы имеют линейное строение. В каждом остатке молекулы глюкозы содержатся три гидроксильные группы, поэтому она проявляет свойства многоатомного спирта.
Физические свойства
Целлюлоза – волокнистое вещество, нерастворимое ни в воде, ни в обычных органических растворителях, гигроскопична. Обладает большой механической и химической прочностью.
Химические свойства
1. Целлюлоза – полисахирид, подвергается гидролизу с образованием глюкозы:
(C6H10O5)n + nН2О → nС6Н12О6
2. Целлюлоза – многоатомный спирт, вступает в реакции этерификации с образованием сложных эфиров
[С6Н7О2(ОН)3]n + 3nCH3COOH → 3nH2O + [С6Н7О2(ОCOCH3)3]n
триацетат целлюлозы
Ацетаты целлюлозы – искусственные полимеры, применяются в производстве ацетатного шёлка, плёнки (киноплёнки), лаков.
Применение
Применение целлюлозы весьма разнообразно. Из неё получают бумагу, ткани, лаки, плёнки, взрывчатые вещества, искусственный шёлк (ацетатный, вискозный), пластмассы (целлулоид), глюкозу и многое другое.
Билет 21.
1.
Окислительно-восстановительные реакции (на примере взаимодействия алюминия с оксидом железа (III), азотной кислоты с медью).
Химические реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
В окислительно-восстановительных реакциях всегда происходит присоединение или отдача электронов атомами элементов. Это единый взаимосвязанный процесс.
Если атом, ион или молекула в процессе реакции отдают электроны, то они называются восстановителями, а сам процесс отдачи электронов – окислением:
Al0-3e→Al+3; Fe+2-1e→Fe+3;
Если атом в процессе реакции принимает электроны, то он называется окислителем, а сам процесс присоединения электронов – восстановлением. Например:
S0+2e→S-2; N+5+1e→N+4;
Атомы металлов – восстановители; атомы неметаллов – окислители. Наиболее сильный восстановитель - франций (Fr), а наиболее сильный окислитель – фтор (F).
Взаимодействие алюминия с оксидами металлов имеет большое практическое значение в промышленности для получения таких металлов, как хром, марганец, титан, вольфрам. Этот способ получил название алюминотермии.
Fe2+3O3+Al0→Fe0+Al2+3O3
Fe+3+3e→Fe0 3 1 окислитель
Al0 -3e→Al+3 3 1 восстановитель
Fe2+3O3+2Al0→2Fe0+Al2+3O3
Взаимодействие азотной кислоты с медью.
Особенности азотной кислоты: она взаимодействует почти со всеми металлами, при этом никогда не выделяется водород.
Взаимодействие концентрированной азотной кислоты с медью приводит к восстановлению её до оксида азота (IV):
+5 0 +2 +4
4HNO3+Cu →Cu(NO3)2+2NO2+2H2O
+5 +4
N +1e → N 1 2 окислитель
0 +2
Cu -2e → Cu 2 1 восстановитель
2.
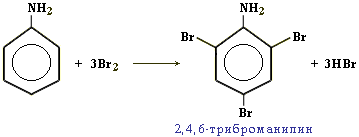
Анилин - представитель ароматических аминов; строение и свойства; получение и применение.
Аминами называются производные аммиака, в молекулах которых один или несколько атомов водорода замещены углеводородными радикалами:
CH3 – NH2 C2H5 – NH2 C3H7 – NH2
метиламин этиламин пропиламин
Группа -NH2 называется аминогруппой. Амины – органические основания.
Наибольшее
практическое значение имеет ароматический
амин анилин.
 Анилин
C6H5
– NH2
(фениламин)
Анилин
C6H5
– NH2
(фениламин)
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. Анилин более слабое основание, чем амины предельного ряда.
Химические свойства
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. 1. Анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Эта реакция может использоваться для качественного определения анилина: