
Глинозем підвищує вогнетривкість глин, тонкодисперсний кремнезем знижує, а грубозернистий підвищує. Солі лужних металів (натрію, калію) різко понижають вогнетривкість глин і служать найбільш сильними плавнями, оксиди лужноземельних металів також знижують вогнетривкість глин, але їхня дія виявляється при більш високих температурах. За показником вогнетривкості (оС) глинисту сировину поділяють на три групи: 1 - вогнетривкі (1580оС і вище), 2 - тугоплавкі (менше 1580оС до 1350оС), 3 - легкоплавкі (менше 1350оС).
Здатність до обпалення – спроможність глин ущільнюватися при випалі з утворенням твердого коренеподібного черепка. Вона характеризується ступенем й інтервалом спікання.
Ступінь спікання контролюють величиною водопоглинання та щільністю керамічного черепка. У залежності від ступеня спікання глинисту сировину підрозділяють на сильноспікливу (утворюється черепок без ознак перепалювання з водопоглинанням менше 2%), середньоспікливу (черепок із водопоглинанням 2- 5%) і неспікливу (черепок із водопоглинанням 5% і менше без ознак перепалювання не утворюється). Ознаками перепалювання є деформація зразка, видиме спушування або зниження його загальної щільності більш ніж на 0,0510-3 гр/см3. Зазначені значення водопоглинання повинні зберігатися не менше ніж у двох температурних точках з інтервалом 50оС. Наприклад, якщо у процесі випалу глини при температурі 1150оС черепок має водопоглинання 0,5%, а при 1100оС - 2%, глина сильно спіклива, а якщо та ж глина при температурі 1100оС утворить черепок із водопоглинанням 4%, її відносять до середньоспікливої.
Спікання у глин може відбуватися при різних температурах. Якщо температура спікання глин нижче 1100оС, їх називають глинами низькотемпературного спікання, 1100-1300оС - середньотемпературного спікання, більш 1300оС - високотемпературного спікання.
Інтервал спікання також характеризує здатність глин до спікання і являє собою різницю між температурою початку перепалювання (деформації) глини та температурою початку спікання, при якій починається інтенсивне ущільнення матеріалу. Найменший інтервал спікання (приблизно 50-100оС) у легкоплавких глин, найбіль-ший (до 400оС) - у вогнетривких.
Інтервал випалу виробів, на відміну від інтервалу спікання глин являє собою різницю між температурами випалу виробу, у межах яких одержують придатний виріб, тобто його водопоглинання знаходиться в межах вимог стандарту на виріб.
Вогнева усадка – зменшення розмірів абсолютно сухого глиняного зразка при його випалюванні. Зближення глинистих часток відбувається під час випалу, тільки з'явиться рідка фаза. Частки маси, що не розплавилися, при цьому змочуються та зближаються під впливом сил поверхневого натягу. Вогнева усадка коливається від 2 до 8%.
7.2.2. Технологічні властивості непластичних матеріалів.
До технологічних властивостей непластичних матеріалів відноситься здатність матеріалу адсорбувати та утримувати воду. Звичайно, непластичні матеріали поділяють на гідрофільні, ті, що дуже добре адсорбують та утримують воду, та гідрофобні, які дуже погано адсорбують та утримують воду.
7.3. Фізико-хімічні основи створення керамічних
Виробів
Створення керамічних виробів ґрунтується та супроводжується фізичними та хімічними процесами. Особливості цих процесів базуються на особливостях складу і структури сировинних компонентів. Усі процеси, що відбуваються при отриманні кераміки, проходять при дії підвищених температур. Тому і розглянемо, як температура впливає на формування структури керамічного матеріалу.
Практично усі глинисті матеріали мають структуру, у якій шари глинистої речовини роз'єднано шарами води. Окрім цього, для надання керамічному виробові певної форми, керамічні сировинні матеріали змішують із водою, яка додатково вводиться у систему. Отримана керамічна маса набуває формувальних властивостей, тобто їй можна надавати форму виробу.
Якщо сухий глинистий порошок змочити водою, його температура підвищиться. Це пояснюється тим, що молекули води міцно зв'язуються з мінералами, що утворюють глину, і розташовуються на них у визначеному порядку, тобто орієнтуються. Схематично це можна уявити в такому вигляді (рис. 7.1,а).
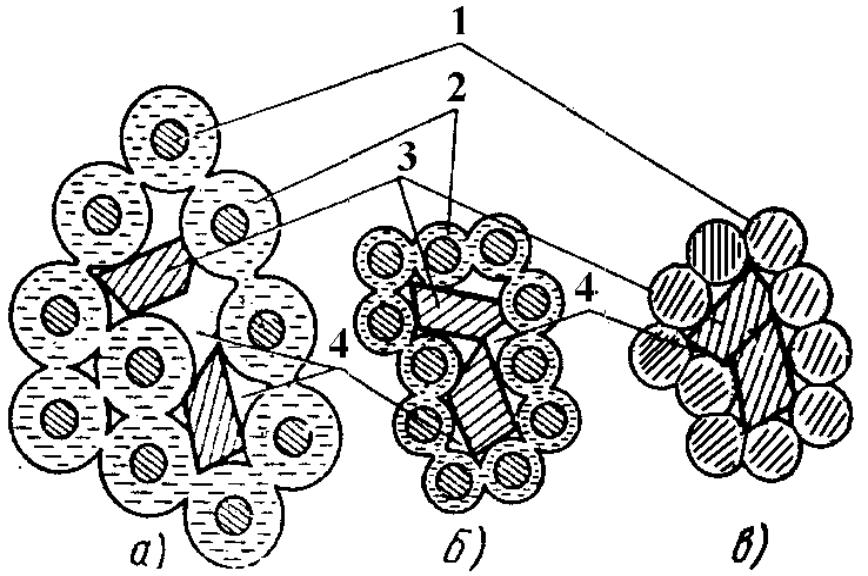
Рис. 7.1. Розташування часток вологої глини:
а – при зволоженні; б, в – при сушінні; 1 — зерно мінералу, що
утворює глину; 2 — гідратна оболонка; 3 — зерна непластичного
матеріалу; 4 — капіляри.
Елементарне зерно мінералу, що утворює глину, має завжди негативний електричний заряд, навколо якого створюється силове поле. Під його впливом молекули води у вигляді диполів своїм позитивно зарядженим кінцем орієнтуються та притягаються до негативного заряду зерна, щільно оточують його поверхню, створюючи прошарок зв'язаної води, сильно стиснутий під впливом силового поля.
У міру видалення від поверхні зерна величина тяжіння молекул води зменшується.
Уся, зв'язана навколо зерна, вода утворить гідратну оболонку – 2, товщина якої залежить від мінералогічного складу глин і домішок.
Звичайно, вода в гідратних оболонках керамічної маси знаходиться у двох станах: фізична вода – вода, що утримується навколо часток керамічної маси та зв'язана з нею фізичними силами притягування; хімічно зв'язана вода, – вода, яка входить до складу глинистих мінералів. Фізична вода має два різновиди: капілярна та адсорбована. Капілярна вода знаходиться у капілярах, які утворилися у процесі змішування керамічних сировинних матеріалів із водою. Адсорбована вода знаходиться безпосередньо на поверхні часток керамічної маси. Ця вода більш міцно утримується в керамічній масі. Будовою гідратної оболонки пояснюються багато властивостей глин, у тому числі вологоємкість, набрякання, розмокання, тиксотропне зміцнення.
Важливе значення для технології кераміки грає подвійний електричний прошарок, що утвориться при іонному обміні у глинах. У решітці глин деяку частину іонів Si4+ ізоморфно замінено іонами А13+, а іони А13+, у свою чергу, можуть замінятися іонами Mg2+ і Fe2+. Таке заміщення призводить до виникнення негативного заряду часток глинистих мінералів, що нейтралізується адсорбцією на їх поверхні позитивних іонів, та обумовлює утворення подвійного електричного прошарку. Якщо адсорбованими іонами є сильно гідратовані іони лугів, розмір яких великий, а заряд малий, то негативний заряд глинистих часток у водяному середовищі не може бути повністю нейтралізованим одноатомним прошарком адсорбованих катіонів. Це призводить до утворення дифузійного подвійного прошарку та зберігання визначеного негативного заряду часток, взаємне відштовхування котрих і обумовлює можливість утворення стабільних суспензій. Загальний розподіл заряду в такій частинці показано на рис. 7.2.

Рис. 7.2. Подвійний дифузійний шар та від'ємний заряд Na-каолініту.
Основними складовими керамічної маси є оксид алюмінію та оксид кремнію. При нагріванні цієї маси, її складові піддаються змінам. Кристалічний кремнезем відіграє двояку роль, знижуючи усадку в період сушіння та випалу, з одного боку. З іншого боку - вступаючи при високих температурах у фізико-хімічні реакції з компонентами маси, він утворює з'єднання, що обумовлюють визначені технічні властивості матеріалу. Однак при нагріванні кремнезем зазнає модифікаційних перетворень, тобто у ньому відбуваються зміни структури кристала.
Розглянемо, які перетворення проходять при нагріванні глиняної речовини.
При нагріванні до 200оС із неї починає випаровуватися фізична вода. При цьому в першу чергу з глини випаровується капілярна вода, що має менш міцний зв'язок із глинистими частинками. Потім адсорбована вода з гідратних оболонок починає переміщатися в капіляри 4 (рис. 7.1), товщина оболонок зменшується, і частки глини починають зближатися (рис. 7.1,б).
При нагріванні глиняної речовини від 300оС до 400оС із неї починає випаровуватися хімічна вода. Каолініт переходить у метакаолін (рис. 7.3)
2[Al2O32SiO22H2O] 2Al2O34SiO2 + 4H2O
каолініт метакаолін
Цей процес супроводжується подальшим зближенням часток глинистої речовини. У результаті настає момент, коли частки приходять у зіткнення (рис. 7.1,в). Усадка керамічної маси поступово припиняється. Зерна 3 непластичних матеріалів (рис. 7.1,в) також зближаються за рахунок зближення глинистих часток, проте вони перешкоджають повному зближенню глинистих часток, тобто наявність у масі непластичних матеріалів зменшує повітряну усадку.
При нагріванні глиняної речовини до 500оС – 600оС починається руйнування каоліну (рис. 7.3)
2Al2O34SiO2 2Al2O33SiO2 + SiO2
метакаолін фаза шпінелевого типу
При температурі 573оС -кварц, який найбільш часто зустрічається у природі, переходить у -кварц. При цьому перетворенні миттєве збільшення об'єму кремнезему складає 2,8%.
При нагріванні глиняної речовини до 700оС починається спікання маси, що супроводжується хімічною взаємодією деяких мінералів з утворенням легкоплавких з'єднань. До таких мінералів відноситься кремнезем (SiO2), який вступає в хімічну взаємодію з лугами та оксидами заліза. При цьому утворюється склоподібна речовина (рис. 7.3), яка частково заповнює пори керамічної маси та цементує частинки інших мінералів.
При нагріванні глиняної речовини до 800оС – 850оС матакаолініт розкладається на первинні оксиди з утворенням аморфного глинозему Al2O3 і аморфного кремнезему SiO2 (рис. 7.3).
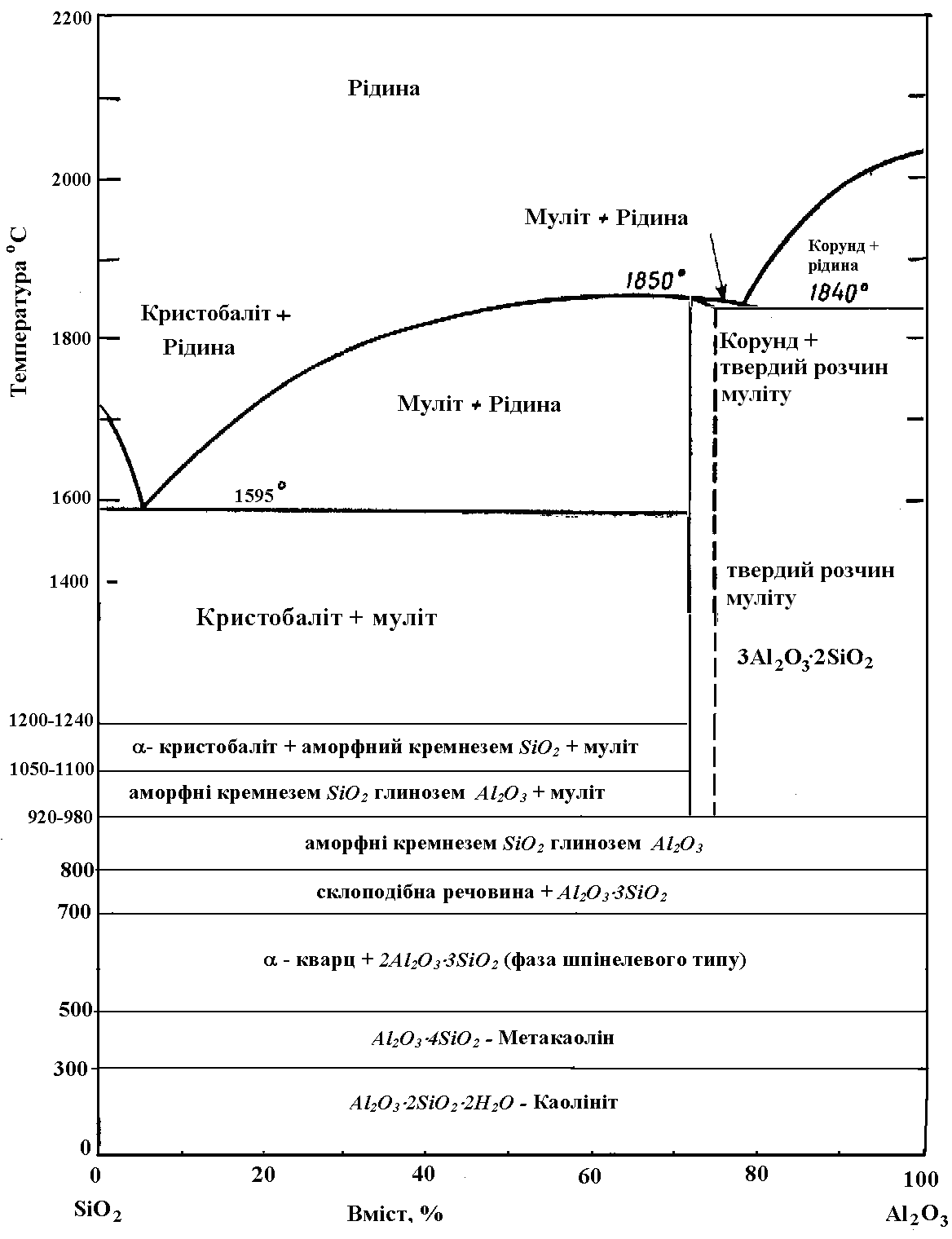
Рис. 7.3. Фазові переходи у бінарній системі Al2O3 – SiO2
При підвищенні температури до 920-980оС (рис. 7.3) починає утворюватися муліт 3Al2O32SiO2, який надає виробу основні властивості: міцність, водо- і термостійкість. З подальшим підвищенням температури вміст муліту зростає.
При подальшому нагріванні при температурах 1050 – 1100оС - кварц перетворюється в - кристобаліт (рис. 7.3) із значними змінами об'єму (+15,7%). При застосуванні мінералізаторів (лугів й ін.) протікає процес перетворення - кристобаліту, що утворився з кварцу, в -тридиміт, стійкий в інтервалі температур 870-1470оС, при цьому відбуваються також значні зміни об'єму, що у результаті перетворень - кварц - тридиміт складають +16,1% .
Таким чином, утворення - кристобаліту є проміжним ступенем оборотного процесу перетворення кварцу у тридиміт.
Підвищення температури до 1200-1240оС супроводжується найбільшою усадкою. При цьому з аморфного кремнезему, який залишився після утворення муліту, кристалізується кристобаліт (рис. 7.3).
Вище температури своєї стабільності тридиміт переходить у кристобаліт. При температурі 1500оС це перетворення йде повільно, причому одночасно відбувається ріст кристалів тридиміту. При 1570оС тридиміт цілком переходить у кристобаліт. При 1728оС кристобаліт плавиться, розплав, який застиг, утворить кварцове скло.
При охолодженні та кристалізації кварцового скла первинною фазою виділяється кристобаліт, у присутності лугів він частково перетворюється у тридиміт і кварц.
При подальшому охолодженні - кристобаліт, що залишився, при температурі 220-275оС (у залежності від наявності домішок) переходить у свою низькотемпературну форму -- кристобаліт із зміною об'єму на 3,7%. Тридиміт має два низькотемпературних перетворення з - у - із - у - тридиміт, що у залежності від складу домішок також протікають у деякому температурному інтервалі (163-117оС) і в сумі дають зміни об'єму на 1,77%. Модифікаційні перетворення тридиміту проходять достатньо м'яко і не викликають руйнацій керамічного черепка.
Оскільки модифікаційні перетворення кремнезему супроводжуються значними змінами в об'ємі, то вони впливають на міцність і цілісність виробу при випалі і, отже, на вибір відповідних режимів випалу, особливо у стадії охолодження. В інтервалах температур 650-500оС і 275-220оС можуть виникнути модифікаційні перетворення кварцу та кристобаліту, що супроводжуються значними об'ємними разовими змінами в 1,8 і 3,7% відповідно. Крім того, швидкий перехід через температури 573оС і 253оС викликає загальне розпушення обпаленого черепка та появу у виробах тонких тріщин («холодний тріск»).
Діаграма, яку наведено на рис. 7.3, дозволяє виявити ряд факторів, що можуть впливати на виробництво та використання таких вогнетривких матеріалів, як кремнеземиста цегла (0,2-1% Al2O3), шамот (35-40% Al2O3), високоглиноземиста цегла (60-90% Al2O3), чистий плавлений муліт (72% Al2O3) і чисто плавлений чи спечений окис алюмінію (більше 99% Al2O3). На одному кінці інтервалу сполук цієї діаграми знаходиться кремнеземиста цегла, широко використовувана у заводських печах та інших подібних конструкціях, де потрібна висока міцність при підвищених температурах. Основною областю застосування такого матеріалу у вигляді цегли є мартенівські печі, температура в яких, звичайно, дорівнює 1625—1650°С. При цій температурі частина цегли фактично знаходиться в розплавленому стані. При розробці технології кремнеземистої цегли було встановлено, що невеликі домішки окису алюмінію до деякої міри погіршують властивості цегли, тому що склад евтектики дуже близький до кремнеземистого кінця діаграми. Отже, присутність у матеріалі навіть невеликих домішок окису алюмінію приводить до утворення значної кількості рідкої фази при температурі близько 1600°С. З цієї причини в конструкціях, що працюють при підвищених температурах, застосовують кремнеземисту цеглу підвищеної якості, у якій завдяки використанню спеціально обраних сировинних матеріалів або обробці міститься знижена кількість окису алюмінію.
Шамотні цеглини містять від 35 до 55% окису алюмінію. Для складів, що не містять домішок, рівноважними фазами, що є присутніми при температурах нижче 1595° С, є муліт і кремнезем. Відносна кількість цих фаз змінюється зі складом, що приводить до відповідних змін у властивостях цегли. При температурах вище 1600°С кількість рідкої фази, що присутня у системі, сильно залежить від відносної кількості глинозему та кремнезему, у зв'язку з чим при таких високих температурах більш бажано застосовувати високоглиноземисту цеглу.
Вогнетривкі властивості цегли можуть бути значно поліпшені, якщо для збільшення кількості муліту, що міститься в її складі, додати в масу відповідну кількість окису алюмінію. При вмісті в цеглі 72% окису алюмінію її склад буде цілком складатися з муліту, а при більшому вмісті окису алюмінію — із суміші муліту та корунду. За цих умов у матеріалі не утвориться ніякої рідкої фази аж до температури 1840°С. Для деяких цілей використовують плавлену мулітову цеглу, що має чудову стійкість до корозії та деформації при підвищених температурах. Найбільшу вогнетривкість у цьому ряді матеріалів має чистий окис алюмінію. Спечений окис алюмінію використовується для виготовлення виробів лабораторного призначення, а литий плавлений окис алюмінію - як вогнетрив для печей, у яких варять скло.
Одною з істотних переваг трикомпонентних мас, що містять кварц, польовий шпат і глину, є те, що вони не чутливі до невеликих змін у складі, методі виробництва та температурі випалу. Це пов'язано з тим, що при взаємодії присутніх фаз в'язкість рідкої фази, що утвориться при підвищених температурах у великих кількостях, безупинно збільшується. Якщо ми розглянемо фазову рівноважну діаграму (рис. 7.4.), то переконаємося, що в міру взаємодії польово-шпатових реліктів із глинистою речовиною зростає не тільки кількість рідкої фази, але також і її в'язкість (рідка фаза збагачується кремнеземом).
При температурі 1300°С між глинистою речовиною і польовим шпатом досягається рівновага з утворенням муліту, розподіленого в склоподібній масі (рис. 7.5).
При подальшій взаємодії зазначених фаз із кварцовими зернами кількість рідкої фази зростає, і вона безперервно збагачується кремнеземом, що призводить до підвищення її в'язкості. Унаслідок наведених реакцій подібні маси мають тривалий інтервал спікання і низьку чутливість до змін у складі.
Зміни, що відбуваються у структурі трикомпонентних порцелянових мас у процесі випалу, у значній мірі залежать від складу даної маси та умов її випалу.
Як видно з рис. 7.4, найменша температура потрійної евтектики в системі польовий шпат — глина — кварц дорівнює 990°С, у той час як температура, під дією якої зерна польового шпату утворять рідку фазу, дорівнює 1140°С. При більш високих температурах відбувається збільшення кількості рідкої фази, і єдиною можливою рівноважною твердою фазою повинен бути за діаграмою стану муліт.
У дійсності ж рівноваги у процесі випалу, звичайно, не досягається, тому що швидкості дифузії малі, а різниця у величині вільної енергії між різними присутніми в системі фазами невелика.
Вихідна суміш складається з відносно великих зерен кварцу і польового шпату, розподілених у тонкозернистій глинистій масі.
У процесі випалу зерна польового шпату плавляться при температурі близько 1140°С, але через високу в'язкість рідини, що утвориться, форма зерен не змінюється аж до температури 1200оС. При температурі близько 1250°С зерна польового шпату з розміром менше 10 мкм зникають за рахунок протікання реакції з глинистою речовиною, а більш великі зерна продовжують реагувати (луги дифундують із польового шпату, і у склі утворюються кристали муліту).
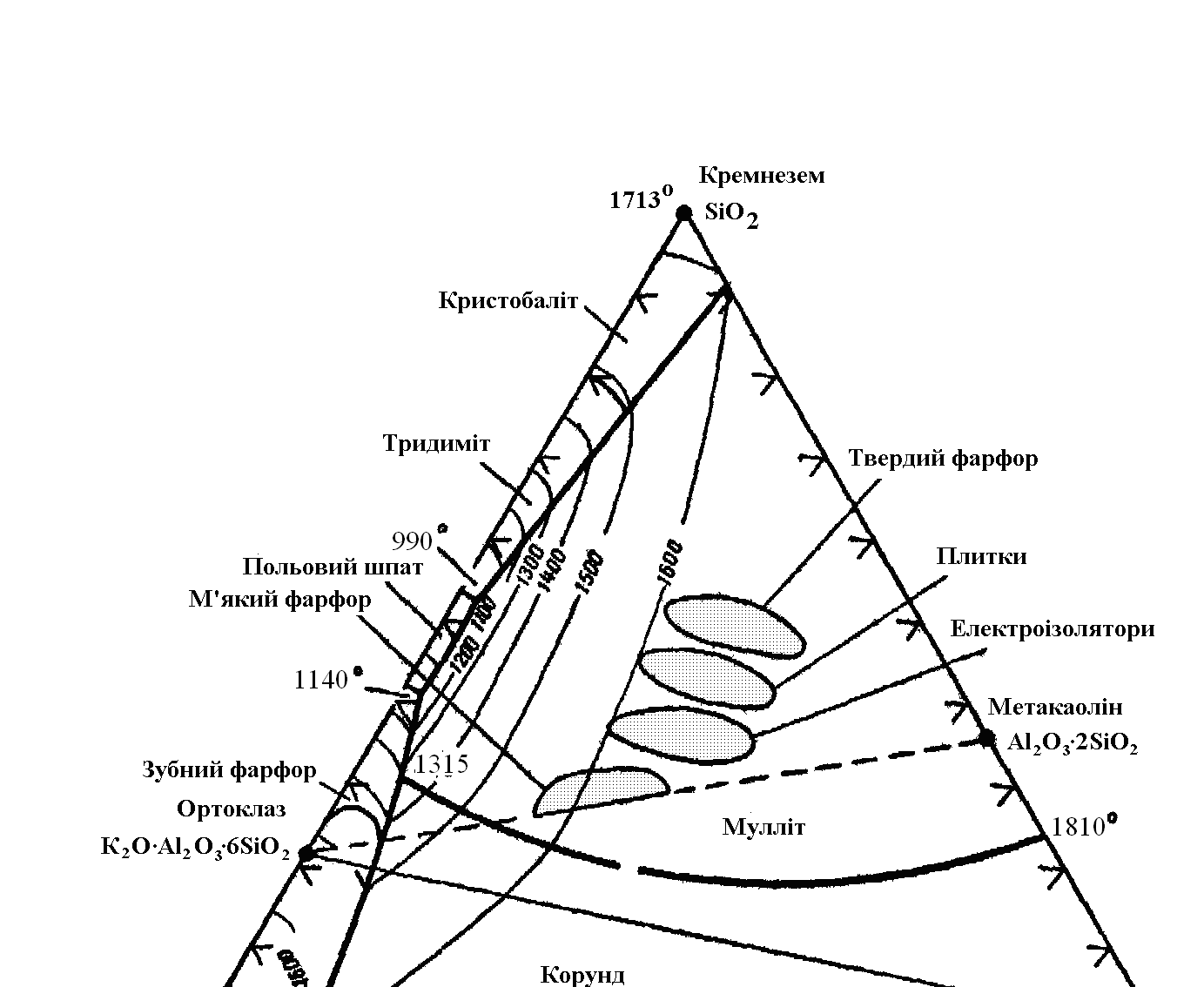
Рис. 7.4. Система Al2O3 – SiO2 – K2OAl2O3 4SiO2 (польовий шпат).
Глиниста фаза спочатку зазнає усадки, і в ній утворюються численні тріщинки. Тонкі голки муліту з'являються в матеріалі при температурі (920-980)°С, але сила звичайного оптичного мікроскопа дозволяє їх спостерігати лише після досягнення температури, принаймні, рівної 1250°С. При подальшому підвищенні температури кристали муліту безупинно ростуть. Після випалу при температурах вище 1400°С муліт є присутнім у вигляді призматичних кристалів, довжина яких досягає 0,01 мм і більше. У кварцовій фазі не спостерігається ніяких змін аж до температури близько 1250°С. Потім відбувається округлення країв невеликих часток.
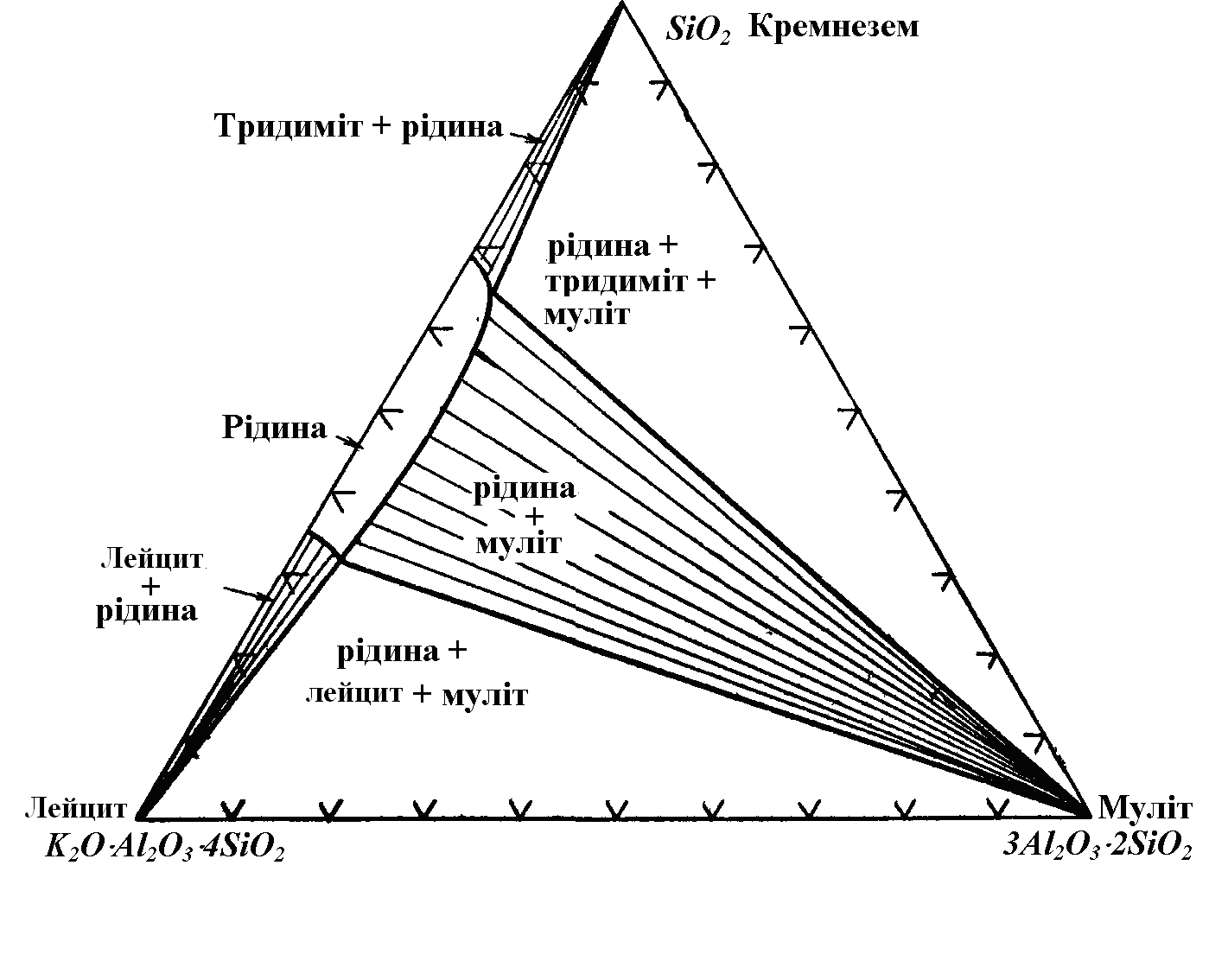
Рис. 7.5. Ізотермічний перетин фазової рівновагової діаграми системи
кремнезем - лейцит - муліт при 1300оС.
При більш високих температурах у масі збільшується кількість висококремнеземистого скла, що утворить обідки навколо зерен кварцу, які розчиняються.
При 1350°С зерна з розміром менше 20 мкм повністю розчиняються. Вище 1400°С у матеріалі залишається незначна кількість кварцу, і порцеляна майже цілком складається з муліту та скла. У реліктах польового шпату великі голки муліту ростуть від поверхні в міру зміни складу за рахунок дифузії лугів. З кварцу, звичайно, утвориться лише скло, але в деяких масах, обпалених при високих температурах, відбувається перетворення кварцу у кристобаліт, причому останній починає утворюватися на зовнішній поверхні кварцових зерен. У мікроструктурі кераміки чітко розрізняються зерна кварцу, мікротріщини, обідки висококремнеземистого скла, релікти польового шпату, що складаються зі скла й муліту, а також ділянки тонкозернистої скловидно-мулітової маси.
Швидкість змін у мікроструктурі, що відбуваються у процесі випалу, залежить від часу, температури й розміру часток. Найбільш повільним процесом є процес утворення кварцу. При нормальних умовах випалу рівновага досягається лише при температурі близько 1400°С, і структура являє собою суміш кремнеземистої рідкої фази й муліту. В усіх випадках рідка фаза, що утворилася при температурі випалу, перетворюється при охолодженні у скло, так, що кінцевими фазами, що є присутнім у матеріалі при кімнатній температурі, звичайно, є скло, муліт і кварц у кількостях, що залежать від вихідного складу й умов теплової обробки. У складах із великою кількістю польового шпату утвориться більша кількість кремнеземистої рідкої фази при більш низьких температурах, і, відповідно, має місце наявність більшої кількості скла, ніж у складах із більш високим утриманням глини.
