
- •Розділ 2 технологія магнезіальних в'яжучих
- •2.1. Сировина для магнезіальних в'яжучих
- •2.2. Теоретичні основи обпалення магнезиту й доломіту
- •2.3. Виробництво магнезіальних в'яжучих
- •1. Сировина для магнезіальних в'яжучих.
- •Розділ 3 технологія гідравлічного вапна
- •3.1. Сировина для виробництва гідравлічного вапна
- •3.2. Процеси, що відбуваються при обпаленні
- •3.3. Виробництво гідравлічного вапна
- •Розділ 4 технологія портландцементу
- •4.1. Сировинні матеріали
- •4.2. Паливо для виготовлення портландцементу
- •4.3. Технологічні схеми виробництва портландцементу
2.2. Теоретичні основи обпалення магнезиту й доломіту
Дисоціація магнезиту починається вже при 400°С, але швидке розкладання відбувається при температурі понад 640оС:
MgCO3 ↔ MgО + CO2 + 29 ккал.
При розкладанні карбонату магнію площадки на термограмах виходять не горизонтальні, а похилі, й існує припущення, що MgCO3 утворює тверді розчини з MgО. Пружність парів дисоціації MgCO3 можна з достатньою точністю визначити за формулою:
![]()
MgО залежно від температури випалу виходить у різному стані. При температурі 650—800°С виходить пухкий порошок, що має щільність 2,3 г/см3. Хоча й рентгенографічно виявлені в MgО, обпаленому при 800оС, кристали периклазу (MgО), однак у світловому мікроскопі їх не видно. Гідратується такий MgО дуже активно.
При підвищенні температури випалу спостерігається ріст кристалів, і відбуваються процеси їхньої рекристалізації. Зростає щільність.
У процесі випалу чистого MgО при 800 і 1000оС утворюються дрібні кристали розміром 0,05 мкм, при 1200°С—0,08 мкм, при 1400оС — від 1 до 4 мкм, а при 1600—1800°С — 9—11 мкм. Домішки істотно впливають на процес рекристалізації та розміри кристалів. Так, у процесі обпалення ропного MgО (з ропи Сиваша) уже при 1200°С спостерігалися кристали розміром 5 мкм. Домішки іонів заліза Fe3+ також значно прискорюють спікання. Активність MgО і швидкість його гідратації з підвищенням температури різко знижується. Про це наочно свідчить падіння питомої електропровідності (χ) при розчиненні MgО, попередньо здрібненого до величини зерен менш 50 мкм (рис. 2.1), а також кількості зв'язаної води (табл. 2.1).
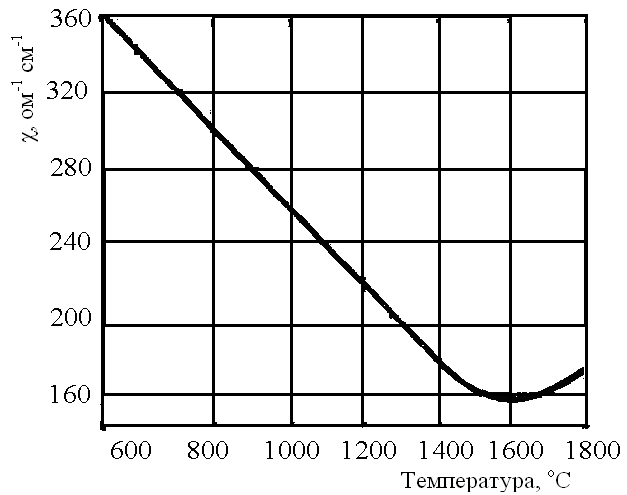
Рис. 2.1. Залежність питомої електропровідності розчину
MgО від температури його випалу.
Отже, для одержання активного MgО, здатного швидко гідратуватися, магнезит обпалюють при температурі приблизно 700—750°С. При підвищенні температури випалу в'яжучі властивості різко погіршуються.
Таблиця 2.1
Ступінь гідратації MgO, обпаленого при різних температурах
(за кількістю зв'язаної води),%
Термін гідратації, діб |
Температура обпалення, оС |
||||
800 |
1200 |
1300 |
1400 |
1800 |
|
1 |
75,40 |
66,48 |
14,62 |
4,72 |
3,95 |
3 |
100,0 |
- |
38,15 |
9,27 |
14,12 |
30 |
99,82 |
94,76 |
69,50 |
32,80 |
36,40 |
А в процесі випалу при 1400°С виходить так званий намертво обпалений магнезит, що використовується в металургійній промисловості для виготовлення вогнетривів.
Щільність металургійного магнезиту, або мінералу периклазу якладає від 3,5 до 3,6 г/см3, твердість — 5,5. Кристалізується периклаз у кубічних кристалах, кристалічна решітка типу NaCl. У природі периклаз зустрічається дуже рідко, тому що швидкість взаємодії його з водою й вуглекислотою досить велика. Під дією води він перетворюється в брусит або гідромагнезит. Слід зазначити, що MgО одержують не тільки з магнезиту, але й з Mg(OН)2. Гідратна вода видаляється при температурі 385— 410°С. На практиці випал Mg(OН)2, отриманого з ропи, рекомендується проводити при температурі приблизно 500оС. При вивченні процесів одержання MgО установлено, що в первісний період він зберігає структуру вихідної речовини. Так, при розкладанні Mg(OН)2, одержують MgО із шаруватою структурою брусита, а при розкладанні MgСО3 - своєрідні псевдоморфози, що зберігають зовнішні обриси магнезиту. Розкладання доломіту відбувається в інтервалі температур 700—900оС, причому на термограмі є два ендотермічних ефекти: перший — в інтервалі температур 720— 760°С, другий — при 895— 910°С. Отже, процес протікає у дві стадії.
Щодо того, які процеси протікають на кожній із стадій, існують різні точки зору. Найбільш імовірною, на користь якої свідчать електронно-мікроскопічні дослідження, є схема дисоціації, при якій на першій стадії утворяться MgО й карбонат кальцію:
CaMg(CO3)2 = CaCO3 + MgО + CO2.
На другій стадії відбувається розкладання CaCO3:
CaCO3 = CaО + CO2.
Існують
також припущення, що крім MgО
на першій стадії дисоціації утвориться
також твердий розчин карбонатів
MgCO3nCaCO3
або основний карбонат CaCO3·MgO.
Однак рентгенографічно ані твердий
розчин, ані основний карбонат визначити
поки що не вдалось. Вважається, що на
перші стадії при 730°С відбувається
розкладання решітки доломіту на CaCO3
та MgCO3.
Так як температура розкладання MgCO3
майже на 100°С нижче, ніж CaCO3,
він одразу ж розкладається. При
парціальному тиску CO
в 0,1 МПа температура початку розкладання
MgCO3
буде найменшою (640°С),
CaCO3
— найвищою (906°С),
а доломіту —
проміжною
(730°С).
Це пояснюється тим, що іон Mg2+
у наслідок малого радіусу значно сильніше
деформує іони
![]() ,
ніж іони Са2+.
Тому іон
послаблюється
й розкладається на СО2
та О2-
легше,
ніж в CaCO3.
У кристалічній решітці доломіту (рис.
2.2), де чередують шари іонів Mg2+,
та
CaO2+,
першими розпадуться іони
,
оточені іонами Mg2+,
іони ж
,
які знаходяться в оточенні іонів СаО2+,
більш стійкі. Однак швидкість розкладання
доломіту набагато менше швидкості
розкладання не тільки СаСО3,
але й MgCO3.
,
ніж іони Са2+.
Тому іон
послаблюється
й розкладається на СО2
та О2-
легше,
ніж в CaCO3.
У кристалічній решітці доломіту (рис.
2.2), де чередують шари іонів Mg2+,
та
CaO2+,
першими розпадуться іони
,
оточені іонами Mg2+,
іони ж
,
які знаходяться в оточенні іонів СаО2+,
більш стійкі. Однак швидкість розкладання
доломіту набагато менше швидкості
розкладання не тільки СаСО3,
але й MgCO3.
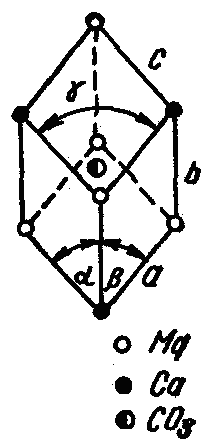
Рис. 2.2. Кристалічна решітка доломіту.
Це можна пояснити тим, що при розкладанні доломіту відбувається більш складна перебудова кристалічної решітки, а також тим, що досягнення рівноваги при розкладанні СаСО3 настає в короткий строк; при розкладанні MgCO3 це відбувається набагато повільніше, а при дисоціації доломіту рівноваги не вдається досягти навіть протягом декількох діб. Оскільки перерозподіл іонів у кристалічній решітці визначає кінетику розкладання, швидкість розкладання істотно залежить від добавок. Так із зразка доломіту з 1 % протягом 2 годин при температурі 700°С виділяється майже вдвічі більше О2, ніж з доломіту без добавки. Прискорювачами процесу є також інші солі лужних металів. Уведення ж обпаленого магнезиту, тобто зародків нової фази, не робить такого вирішального впливу. Це можна пояснити тим, що стадією у перебудові кристалічної решітки, що обмежує, є не виникнення зародків нових фаз, а повільна доставка до них матеріалу, тобто процес переміщення іонів. Таку ж дію робить і добавка гіпсу. Усі ці добавки знижують температуру початку розкладання доломіту.
